儿童急性淋巴细胞性白血病维持治疗期间巯嘌呤的减量及对远期预后的影响
2021-03-06管玉洁韩金芬朱莹莹毛彦娜刘炜
管玉洁,韩金芬,朱莹莹,毛彦娜,刘炜
(1.郑州大学附属儿童医院,河南省儿童医院,郑州儿童医院,河南郑州 450000;2.新乡医学院第三附属医院,河南新乡 453000)
急性淋巴细胞性白血病(acute lymphoblastic leukemia,ALL)是儿童常见的恶性肿瘤,对患儿生命及健康造成了严重威胁。化疗是ALL患儿获得痊愈的主要治疗手段,无论是中华医学会儿科学分会血液学组推荐的2006年方案还是2018年方案,巯嘌呤(6-mercaptopurine,6-MP)均是其主要治疗药物。但在ALL的治疗中,因患儿个体差异较大,对巯嘌呤片耐受性不同,很大一部分患儿 6-MP 不能按标准剂量应用,常因发生白细胞(WBC)或中性粒细胞(ANC)严重减低或缺乏等不良反应而不得不减量,甚至停用,但减量或停药是否对ALL患儿远期预后产生影响,临床研究罕见报道。本研究探讨儿童ALL维持治疗中,依据外周WBC、ANC调低6-MP用量或停药对远期预后的影响。
1 资料和方法
1.1 方案设计
选取2011年1月至2016年1月郑州儿童医院收治的ALL患儿为研究对象,纳入标准:(1)符合儿童ALL诊疗建议相关诊断标准确诊的非高危ALL(2006的制定第三次修订草案,以下简称06方案)[1];(2)年龄2~10岁;(3)按06方案早期强化治疗结束后进入维持治疗;(4)全程均在郑州儿童医院治疗并定期来院复诊。排除标准:(1)合并其他恶性肿瘤或非初诊;(2)对本研究所用药物过敏;(3)进入维持治疗前未缓解或早期复发;(4)合并严重免疫系统疾病;(5)6-MP超标准剂量应用。
符合入组条件的患儿,均严格按06方案进入维持治疗:6-MP 75 mg/(m2·d),夜间睡前顿服。第1~21天(d1~d21):甲氨蝶呤(MTX)每次20 mg/m2,肌肉注射,每周1次,连用3周。接着长春新碱+地塞米松(VDex)治疗1周:长春新碱(VCR)1.5 mg/m2,静脉注射1次,地塞米松(Dex)8 mg/(m2·d),d1~d7口服。4周一个循环,如此反复序贯用药,遇强化治疗时暂停。所用6-MP均为同一厂家药物(浙江浙北药业有限公司,每片50 mg,50片/瓶)。全程治疗依据06方案:低危ALL(LR-ALL)女孩治疗2.0年,男孩治疗2.5年;中危ALL(IR-ALL):女孩治疗2.5年,男孩治疗3.0年。为保证患儿具有一定的抗感染能力,避免重症感染,本研究依据患儿WBC及ANC计数仅调整6-MP用量,使患儿WBC计数保持(1.5~3.0)×109/L,同时ANC保持(0.5~1.5)×109/L,如经过调低用量仍不能维持上述细胞计数标准,则停用6-MP,但继续使用其他药物。
本研究前瞻性的设计患儿组别,依据6-MP用量分为四组:(1)标准剂量治疗组,每个循环每日6-MP用量为标准剂量;(2)半剂量及以上组,每个循环每日6-MP用量小于标准剂量但不小于标准剂量一半;(3)半剂量以下组,每个循环每日6-MP用量<1/2标准剂量;(4)停药组,因WBC及ANC过低,致每个循环中任何剂量的 6-MP 累积用药时间≤7 d。其中1组、2组、3组合并称为用药组。符合分组条件的患儿进入相应组别,自2011年1月开始收集病例,2016年1月收集结束,共有120例患儿入选。全程治疗结束2年后统计每组患儿的无病生存率、复发率、病死率及治疗过程中患儿出现皮疹、胃肠道反应、肝功能异常、重症感染的发生率。
1.2 一般资料
自2011年1月至2016年1月共入组120例ALL患儿,年龄2.67~9.17(5.70±1.82)岁,其中<3岁共2例;男72例,女48例;低危(LR)-ALL 42例,中危(IR)-ALL 78例;标准剂量治疗组21例,半剂量以上组57例,半剂量以下组31例,停药组11例。四组患儿年龄、性别、危险度分层比较差异均无统计学意义(P均>0.05)。不耐受发生率=[半剂量以上组例数+半剂量以下组例数+停药的例数(即不耐受标准用药剂量例数)]÷总例数。
1.3 观察指标
(1)临床疗效比较:比较四组患儿全部疗程治疗结束2年后无病生存(event-free survival,EFS)率、复发率及病死率。(2)比较用药组与停药组EFS、复发率及病死率;(3)药物安全性比较:比较四组患儿6-MP调整后的皮疹、胃肠道反应、肝功损伤、重症感染的发生率。
1.4 统计学方法
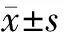
2 结果
2.1 四组患儿临床特征比较
6-MP不耐受发生率为82.5%(99/120)。治疗结束2年后,用药组间患儿EFS、复发率、病死率比较差异无统计学意义(P>0.05),但停药组复发率明显高于用药组,差异有统计学意义(P<0.05)。死亡的3例患儿均为维持治疗期间接受强化治疗中骨髓抑制期出现重症感染、脏器出血而死亡,而非复发死亡。见表1。
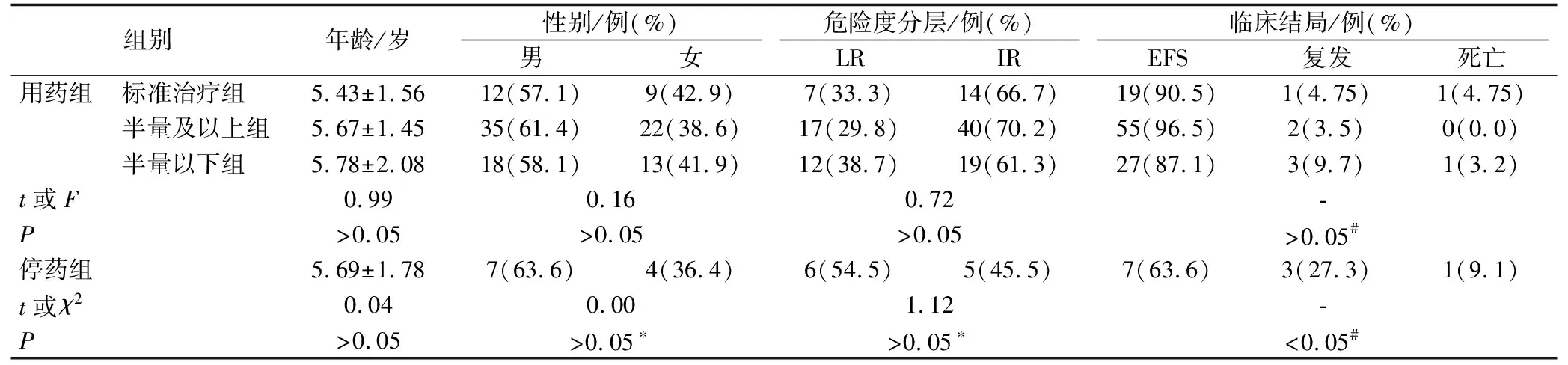
表1 四组患儿临床特征比较
2.2 四组药物安全性比较
依据WBC、ANC调低6-MP后,四组患儿6-MP相关毒副反应发生率非常低,仅有少数患儿有轻微皮疹、厌食、肝转氨酶增高,给予对症处理后均可缓解,无1例重症感染发生。
3 讨论
ALL是儿童常见的恶性肿瘤,我国每年新增白血病患儿1.6万~2.0万人[2],其中80%为ALL,发病高峰为3~7岁[3]。随着治疗方案的不断优化,近年来ALL疗效有明显提高,5年生存率可超过80%[4],非高危患儿无病生存率更高,这主要得益于规范的化疗。
在ALL化疗中,6-MP是最早应用的药物[2],尽管治疗方法不断地发展、优化,但目前6-MP仍是儿童ALL化疗方案的重要组成部分。有研究显示,含6-MP的维持治疗方案是减少患者复发及提高无病生存率的关键环节[5]。规范的维持治疗是提高无病生存率的基础[6],对减少疾病复发起着重要作用[7]。然而,6-MP的靶向性较差,治疗窗非常窄,导致治疗浓度和中毒浓度接近,这是患儿出现不耐受的主要原因[8]。因6-MP药物代谢动力学个体差异较大,仅少数患儿能依据化疗方案规范应用,大部分患儿因不能耐受其骨髓毒性等副作用需调低剂量,甚至停止使用。国内马晓莉等[9]的报道中约46%的患儿不能耐受,而在张世恒等[2]的报道中有68.75%的患儿因不耐受而调低剂量[2]。但国外Tantawy Azza A G等[10]报道不耐受发生率更高,达96.9%,且这些患儿均为骨髓毒性,在维持治疗期间,由于WBC和/或ANC严重减少均需要1~3次的剂量调整,甚至停药。而本研究中6-MP不耐受发生率为82.5%(99/120),这些患儿均因骨髓毒性需要不同程度地减少药物用量,甚至停药,与国内外报道相似,可能因种族及样本量的不同而出现了少许差异。
6-MP是一种嘌呤核苷类似物,其本身属于没有药理活性的前体药,进入机体之后,代谢生成有药理活性的产物6-硫鸟苷酸(6-TGNs)。6-MP在人体内的代谢主要分为合成和分解代谢。合成代谢是6-MP生成活性代谢产物产生疗效的主要途径。6-MP首先在次黄嘌呤-鸟嘌呤磷酸核糖转移酶(HPRT)作用下生成巯基次黄嘌呤单磷酸盐(6-TIMP),6-TIMP再经过次黄嘌呤单磷酸脱氢酶(IMPDH)转化为巯基黄嘌呤单磷酸盐(6-TXMP),最后6-TXMP通过鸟苷酸合成酶(GMPS)转化生成巯基鸟嘌呤单磷酸盐(6-TGMP)、巯基鸟嘌呤二磷酸盐(6-TGDP)和巯基鸟嘌呤三磷酸盐(6-TGTP),此3种巯基鸟嘌呤磷酸盐统称为6-TGNs,是6-MP在体内产生药理活性的主要物质,其药理活性的发挥主要是通过并入RNA(RNA-TG)和DNA(DNA-TG),错配修复导致细胞周期停滞和细胞凋亡,使DNA链断裂而产生细胞毒性[11-12]。6-MP通过分解代谢及时排出体外避免体内药物浓度蓄积产生毒副作用。硫嘌呤甲基转移酶(TPMT)和黄嘌呤氧化酶(XO)为主要的分解代谢酶。6-MP通过TPMT代谢为没有药理活性的甲基化产物排出体外,通过XO代谢为没有药理活性的6-硫尿酸(6-TUA)排出体外。而三磷酸肌苷焦磷酸酶(ITPA)可以促进6-TIMP的再循环利用,增加6-TIMP蓄积[13]。nudix水解酶NUDT15可使6-MP的活性成分生成途径逆转,阻止其并入DNA和RNA,并避免细胞凋亡[13]。
6-MP的半衰期约为90 min,其细胞毒性呈剂量依赖性,与活性成分6-TGNs的浓度有关,而与6-MP的血浆浓度无关。有研究[26]显示,患儿在服用6-MP后7~14 d,其红细胞内6-TGNs呈现稳态浓度,并与随后的WBC呈明显负相关。据此本研究设定为每个循环的 6-MP 累积用药时间≤7 d者,被视为停药组。结合白细胞的细胞周期相对较短,在特定的时间段内处于S期的细胞比例就相对较高,特定时段内的或许对活性成分6-TGNs的浓度有较好的反映。因此本研究设定了WBC、ANC计数为观察指标,用以反映6-MP的治疗强度,但不反映血浆中6-MP的浓度。6-MP的血浆浓度与其肝毒性等副作用相关联。本研究结果显示,依据WBC、ANC计数调低6-MP用量,并不影响ALL患儿的远期预后,且调低后没有明显的毒副作用发生,但如果停用6-MP,则可增加ALL患儿的复发率。因此建议,在临床实践中,可以依据患儿WBC、ANC计数结果探索患儿适宜的6-MP耐受剂量,以保证患儿细胞内有足够浓度的6-TGNs活性成分,用以促使肿瘤细胞的凋亡,而不是完全停用。但6-MP的体内代谢过程复杂,影响因素繁多,欲准确监测6-MP的耐受性及药效学,还需要临床不断去探索。且ALL患儿前期强化治疗也是远期疗效的重要影响因素,维持治疗期间6-MP减量或停药是否影响ALL患儿的远期预后尚需扩大样本量来进一步验证,是否有比WBC更好的指标来检测6-MP的治疗强度仍是我们今后努力的方向。
