自体富血小板血浆联合少阳生骨方治疗大鼠膝关节软骨 缺损的实验研究
2021-03-05王波高海明曹家全瞿刚波邓莉吴佳奇
王波,高海明,曹家全,瞿刚波,邓莉,吴佳奇*
(1.西南医科大学中西医结合学院,四川 泸州 646000;2.西南医科大学附属中医医院,四川 泸州 646000)
0 引言
各种创伤和骨病造成的关节软骨缺损在临床中常见,因此治疗关节软骨缺损是现代骨科领域研究的重点。目前对于软骨损伤修复办法主要有:组织工程修复、微骨折术[1,2]、软骨细胞移植术(autologous chondrocytes implantation,ACI)[3]等。但上述方法对于修复较大、较深的软骨缺损疗效尚不理想。随着血小板浓缩生物的发展,富血小板血浆(platelet-rich plasma,PRP)为治疗关节软骨缺损提供新的途径。富血小板血浆是全血通过离心获得的含高浓度血小板的血浆成分[4]。PRP 因富含生物活性因子被广泛应用于再生医学和组织修复领域的临床和实验研究[5,7]。目前众多研究显示PRP 在修复关节软骨缺损、促进软骨再生方面具有独特作用。近年来,中医药的发展受到重视,我院使用少阳生骨方治疗关节软骨缺损取得较好疗效。PRP 与少阳生骨方均能有效治疗关节软骨缺损,然而PRP 与少阳生骨方联合运用是否能进一步促进缺损关节软骨的修复目前未见报道。本研究拟分析PRP 与少阳生骨方联合运用修复缺损关节软骨的疗效,以期为临床治疗关节软骨缺损提供新思路。
1 材料与方法
1.1 实验动物、主要试剂及仪器
4 周龄SD 实验大鼠20 只,体重(300g±10g),雌雄各半,均由西南医科大学动物实验中心提供。
4%多聚甲醛(国药集团化学试剂有限公司);PBS 磷酸盐缓冲液(北京中杉金桥生物技术有限公司);无水乙醇(成都科龙化工试剂厂);二甲苯(天津致远化学试剂有限公司);伊红染液、苏木素染液(珠海贝索生物技术有限公司);柠檬酸盐缓冲液(北京中杉金桥生物技术有限公司);甲苯胺蓝(上海如吉生物科技发展有限公司);collagen Ⅰ、collagen Ⅱ (proteintech 公司,美国)。
转轮式切片机( 徕卡-2016,德国);PHY- Ⅲ型病理组织漂烘仪器、TSJ-Ⅱ型全自动封闭式组织脱水机(常州市中威电子仪器有限公司);BMJ-Ⅲ型包埋机(常州郊区中威电子仪器有限公司);数码三目摄像显微镜(BA400Digital,麦克奥迪实业集团有限公司);图像分析软件Image-Pro Plus 6.0(Media Cybernetics 公司,美国)。
1.2 PRP 制备
采用改良的PCCS kit 法[8]无菌提取PRP,具体过程为:取SD 实验大鼠眶后静脉血3.0 mL 加入预先放置10%构椽酸钠抗凝剂的离心管中,离心3 000 r·min-1,3 min 45 s,吸取上层血浆及血小板,再次离心,3 000 r·min-1,13 min,弃上层清液,将剩余液体与激活剂(凝血酶与10% CaCl 2 的混合物)适当比例震荡,混匀,血凝块充分收缩后再离心,1 500 r·min-1×15 min,吸取全部上清液即为PRP 液。
1.3 模型建立
各大鼠适应性饲养3 天,观察各大鼠均生存良好,术前10小时禁食、禁饮。具体手术过程:10%聚维酮碘常规腹部消毒后,以3%戊巴比妥(1mL/100g)腹腔注射麻醉大鼠,麻醉满意后大鼠取仰卧位固定于手术台上,选取右侧膝关节以4%硫化钠脱毛,以10%聚维酮碘消毒右下肢皮肤,铺巾后进行手术。膝关节取伸直位,于髌骨内侧依次切开皮肤、皮下组织直达关节囊,分离关节囊进入关节腔,向外侧翻开髌骨并屈膝,充分暴露股骨滑车,于股骨滑车正中以一2.0mm 克氏针垂直关节平面转孔至有落空感为止,边转边用生理盐水冲洗,避免局部热损伤,反复冲洗关节腔后依次缝合关节囊、皮下组织、皮肤,常规消毒后无菌敷料包扎伤口,术毕。手术均由本人及固定助手完成。术后观察各大鼠饮水、摄食、活动情况,每日常规伤口换药,术后两周伤口拆线。见图1。
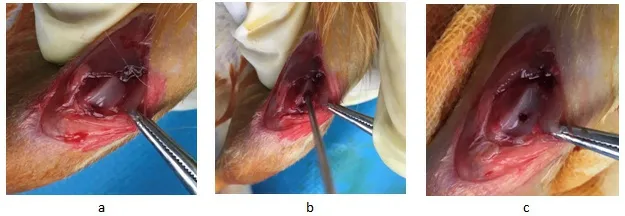
图1 制备大鼠关节软骨缺损模型 a.暴露髌股关节;b.造模;c.造模完成后
1.4 少阳生骨方剂量计算
少阳生骨方由柴胡10g、半夏10g、党参10g、黄芩6g、骨碎补10g、怀牛膝6g、大枣6g、甘草6g 组成(由西南医科大学附属中医医院制剂室提供),依照参考文献并以临床成人有效用药量,按照Meeh-Ruber 公式,大鼠所需药物剂量g=人所需药物剂量g.m-1X 大鼠体表面积(大鼠体表面积=K*W(体重)2/3×10-4),K 为常数:小白鼠和大鼠为9.1,豚鼠为9.8,家兔为10,人为10.6,计算出大鼠给药剂量作为大鼠与成人的等效剂量,10 倍等效剂量为实际灌胃量[9]。100g 大鼠少阳生骨方组给药量为8.5g/d(浓缩至含生药4g/mL 的药液,100g 大鼠每天需要量为2.2mL/d)。
1.5 实验分组及干预方法
将造模成功的20 只大鼠随机分为A 组(空白对照组)、B组(PRP 组)、C 组(少阳生骨方组)、D 组(PRP+少阳生骨方组),采取不同干预措施,A 组:不采取干预措施;B 组:关节腔注射PRP;C 组:灌胃少阳生骨方;D 组:关节腔注射PRP+灌胃少阳生骨方。
1.6 观测指标
1.6.1 大体标本观察
术后3 月脱颈处死各组大鼠,取各组实验大鼠患肢修复组织,大体观察缺损处修复情况,包括修复组织的色泽、形态、组织弹性、表面光滑度,观察修复处组织的大体形态及与周围组织的愈合情况。
1.6.2 HE 染色观察
术后3 月脱颈处死各组大鼠,获取术侧关节软骨缺损处组织,以10%多聚甲醛固定标本24h,EDTA 脱钙液脱钙1 周,固定组织经全自动脱水机脱水,石蜡包埋,轮转式切片机切片,染色后经下观察,采用数码三目显微摄像系统对切片进行图像采集,每张切片先于40 倍下观察全部组织,观察大体病变,选择要观察区域采集100 倍和400 倍图片,观察具体病变。
1.6.3 甲苯胺蓝染色观察
标本经上述固定、脱钙、包埋切片处理后,将切片置于甲苯胺蓝染色液中染色30 min,然后以蒸馏水反复漂洗并在冰醋酸中分化数秒,再用蒸馏水冲洗2 次,冷风吹干,乙醇梯度脱水后二甲苯透明,中性树胶封片,镜下观察软骨组织病理变化。
1.6.4 免疫组化检测Ⅰ型胶原及Ⅱ型胶原表达
标本经上述固定、脱钙、包埋切片处理后,加入抗体显色后,采用数码三目显微摄像系统进行图像采集,镜下观察Ⅰ胶原、Ⅱ型胶原表达。
1.6.5 通过平均光密度分析Ⅱ型胶原表达量
上述所收集图像采用Image-Pro Plus 6.0 图像分析系统测定所采集全部图像的光密度(integrated optical density,IOD)和面积,并计算出3 张图像的平均光密度,通过平均光密度分析Ⅱ型胶原表达量。
1.7 统计学方法
采用SPSS 17.0 统计软件进行分析,数据以均数±标准差表示,以Levene 法行方差齐性检验,组间比较采用单因素方差分析,两两比较采用LSD-α 法;检验水α=0.05。
2 结果
2.1 大体标本观察
术后第3 月脱颈处死各组大鼠,大体观察缺损软骨修复情况。A 组缺损面清晰可见,缺损处见少量淡黄色组织填充,缺损表面不整齐,与周围软骨组织界限明显;B 组软骨缺损处可见半透明样组织软组填充,缺损未完全填满,缺损处表面较光滑,与周围软骨组织界限较明显;C 组软骨缺损处可见半透明样组织填充,缺损未完全填满,缺损处表面较粗糙,与周围软骨组织界限较清晰;D 组软骨缺损处可见近透明样组织填充,缺损近填满,缺损处表面光滑,与周围软骨组织界限较模糊。见图2。
2.2 HE 染色观察
HE 染色示,A 组修复组织内软骨细胞数量明显减少,排列紊乱;B、C 组软骨细胞数量减少,排列较紊乱,软骨表层较粗糙;D 组软骨细胞数量明显增多,可见软骨陷窝,排列紧密,软骨表面较光滑。见图3。
2.3 甲苯胺蓝染色观察
甲苯胺蓝染色示,A 组未见明显正常关节软骨基质分泌;B组见细胞内有少量紫色异染颗粒存在,有正常软骨基质分泌;C组见细胞内有少量紫色异染颗粒存在,细胞周围少量正常软骨基质分泌;D 组见细胞内有大量紫色异染颗粒,近正常软骨基质分泌,接近正常关节软骨细胞。见图4。
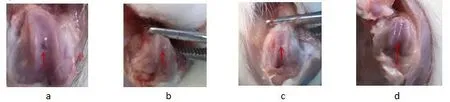
图2 术后3 月各组大体标本观察,箭头所示为缺损处修复情况a. A 组;b. B 组;c. C 组;d. D 组
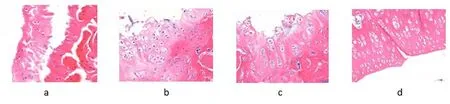
图3 术后3 月各组HE 染色观察(×400) a. A 组;b .B 组;c. C 组;d. D 组

图4 术后3 月各组甲苯胺蓝染色观察(×400) a. A 组;b. B 组;c. C 组;d. D 组
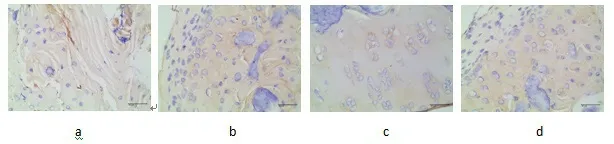
图5 术后3 月各组免疫组化染色观察Ⅰ型胶原(×400) a. A 组;b. B 组;c. C 组;d. D 组

图6 术后3 月各组免疫组化染色观察Ⅱ型胶原(×400) a. A 组;b. B 组;c. C 组;d. D 组
2.4 免疫组化观察Ⅰ型胶原及Ⅱ型胶原表达
Ⅰ型胶原检测示,A 组见少量Ⅰ型胶原表达,B、C、D 组未见明显Ⅰ型胶原表达。Ⅱ型胶原检测示,A 组软骨修复组织中Ⅱ型胶原少量表达;B 组、C 组软骨修复组织中可见较多Ⅱ型胶原表达;D 组软骨修复组织中细胞内及细胞外Ⅱ胶原表达明显增加,出现黄褐色或棕黄色颗粒,修复组织中细胞同周围软骨及软骨结合良好。见图5、图6。
2.5 通过平均光密度分析Ⅱ型胶原表达量
D 组Ⅱ型胶原表达量高于A 组、B 组、C 组,差异有统计学意义(P<0.05);A 组Ⅱ型胶原表达量低于B 组、C 组,差异有统计学意义(P<0.05);B 组、C 组之间差异无统计学意义(P>0.05)。
表1 Ⅱ型胶原表达量统计结果( ±sD)
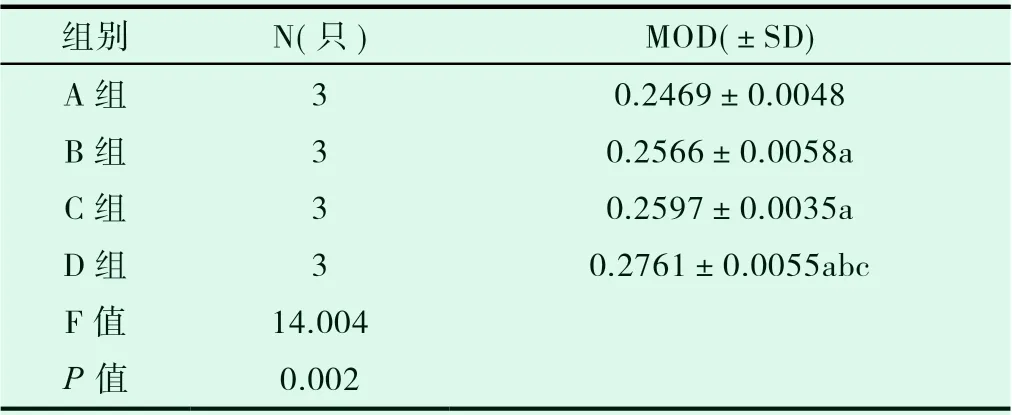
表1 Ⅱ型胶原表达量统计结果( ±sD)
注:a:以A 组为对照组,P<0.05;b;以B 组为对照组,P<0.05;c 以C 组为对照组,P<0.05。
组别 N(只) MOD(images/BZ_15_1128_1554_1154_1582.png ±sD)A 组 3 0.2469±0.0048 B 组 3 0.2566±0.0058a C 组 3 0.2597±0.0035a D 组 3 0.2761±0.0055abc F 值 14.004 P 值 0.002
3 讨论
关节软骨在关节活动中起重要作用,其表面光滑,能减少相邻两骨的摩擦,缓冲运动时产生的震动[10]。关节软骨为透明软骨,是一种无血管、淋巴及神经分布的结缔组织,其由软骨细胞和细胞外基质构组成,二者相互依存,相互作用。其中细胞基质由水、胶原和蛋白多糖组成,水占软骨容量的65%-80%[11],三者使关节面具有抗变形能力和刚性。胶原是关节软骨的主要成分和张力的决定性因素[12,13]。正常人关节软骨中有Ⅱ、Ⅵ、Ⅸ、Ⅹ、Ⅺ型5 种胶原,它们共同组成的软骨内纤维网架结构[14],约占关节湿重的30%。其中Ⅱ型胶原是构成关节软骨的主要成分,约占90%-95%。通常以3 条Ⅱ型胶原纤维构成螺旋分子,排列规则[15]。
PRP 中富含高浓度的血小板,多种生长因子与纤维蛋白原[16],PRP 所含的各种生长因子相互作用,可与靶细胞表面的受体结合,激活细胞的信号通路,诱导细胞产生伤口愈合所需的各种蛋白质,诱导细胞增殖、调整细胞排列形态,促进骨样组织及胶原合成[17]。而纤维蛋白原在凝血酶作用下可缓慢聚合,释放出内部生长因子,有利于发挥生长因子间的协同作用,增进组织修复效果。PRP 通过活化后释放的各种生物活性因子和血浆中的各种蛋白发挥促进损伤关节软骨修复的作用,如能够刺激软骨细胞增殖,促进骨髓间充质干细胞等骨软骨前体细胞迁移、增殖、向软骨分化和分泌软骨细胞基质,抑制损伤部位炎症反应,刺激滑膜细胞分泌透明质酸和关节滑液,形成凝胶为损伤部位提供早期修复并为前体细胞创造增殖、分化的三维环境等[18]。PRP 治疗关节软骨缺损已运用于临床,但对于较大、较深的关节软骨缺损的修复效果尚不理想。
随着中医药的发展,我院运用少阳生骨方治疗关节软骨缺损取得了较好疗效。祖国医学《黄帝内经》中明确提出“少阳主骨”的观点,《素问·热论》云:“少阳主骨”,《灵枢·经脉》记载”足少阳之脉主骨所生病”。“少阳生骨方”以“小柴胡汤”加减而成,方组由柴胡、半夏、党参、黄芩、骨碎补、怀牛膝、大枣、甘草组成,以小柴胡汤为基础可和解少阳,通利胆经,消除痹痛,同时辅以骨碎补、怀牛膝补益肝而达到和补共用作用。研究表明少阳生骨方能调节大鼠软骨细胞中Ⅱ型胶原、基质金属蛋白酶13 的m RNA 和蛋白的表达水平、可显著降低关节液中导致软骨细胞损伤的炎性介质IL-1β 水平,提高软骨损伤后修复组织中Ⅱ型胶原的表达,从而有助于软骨损伤的修复[19,20]。此外少阳生骨方能促进去分化软骨细胞的增殖,促进SD 大鼠在体软骨损伤后软骨的修复,且修复组织更接近透明软骨[21,22]。
本实验研究结果显示PRP 与少阳生骨方联合运用组对想缺损关节软骨修复效果明显优于PRP、少阳生骨方单独应用组,在一定程度上佐证了PRP 与少阳生骨方联合运用会进一步促进缺损关节软骨组织修复。我们认为其机制可能为PRP 与少阳生骨方对缺损关节软骨组织的修复作用产生协同效应。本研究在实验指标上选择Ⅰ型胶原Ⅱ型胶原来确定胶原表达的类型来说明疗效,因为Ⅱ型胶原是关节软骨的正常表型。本研究结果显示各组修复组织中未见明显Ⅰ型胶原表达,PRP 与少阳生骨方联合运用组Ⅱ型胶原表达量明显高于其他组,证实了修复组织为软骨组织而不是瘢痕组织,且PRP与少阳生骨方联合运用组修复效果优于其他各组。但值得注意的是,中药复方具有多成分,代谢多途径,作用多靶点等特点,其药理作用是每个有效成分的叠加、协同或互补。
综上述,PRP 与少阳生骨方联合运用能发挥协同效应,进一步促进缺损关节软骨组织的修复,但具体机制有待进一步研究明确。
作者贡献:王波直接参与实验设计、实施、数据收集及统计分析,文章撰写;高海明直接参与实验实施及数据收集;曹家全直接参与实验实施、材料购买;瞿刚波参与实验指导;邓莉参与数据统计分析;吴佳奇设计实验,并对文章的知识性内容作批评性审阅。
利益冲突:所有作者声明,在课题研究和文章撰写过程中不存在利益冲突。基金项目经费支持没有影响文章观点和对研究数据客观结果的统计分析及报道。
机构伦理问题:本研究方案获西南医科大学伦理委员会批准(2020-071)。实验动物使用许可证号:SYXK(川)2013-065。
