急性分泌性中耳炎患者外周血T淋巴细胞亚群与中耳积液炎症因子的相关性
2021-03-05崔喜财赵恒威张鲁壮宋晓洁崔凯
崔喜财,赵恒威,张鲁壮,宋晓洁,崔凯
(1.辽宁中医药大学附属第四医院检验科,辽宁 沈阳 110101;2.秦皇岛市工人医院普外科,河北 秦皇岛 066200)
分泌性中耳炎(otitis media with effusion,OME)是以听力下降及中耳积液为主要临床特征的中耳非化脓性炎性疾病,一般不表现为耳部急性感染。相关研究[1]报道,OME人群发病率超过10%,在各年龄段都可能发病,但在儿童中更为多见。大样本量的流行病学调查[2]显示,90%的学龄前儿童曾罹患OME,但多数可自行消退。根据病程不同,OME可分为急性和慢性,病程短于3个月为急性OME,如未得到及时的有效治疗则可发展为慢性OME,进而引发中耳粘连、鼓膜萎缩硬化、听骨坏死、鼓室硬化等严重并发症,持久不愈的OME更是最常见的儿童致聋、语言发育迟缓原因[3]。但是,OME的发病机制尚未明确,尽管学术界已形成了咽鼓管功能不良、感染、免疫异常等多个病因假说,但始终未能从根源上解释OME的发生及进展机制,这也导致了OME目前在治疗上仍缺乏公认的确切方案[4]。近年来,研究[5]发现,OME患者同时罹患机体免疫功能异常和中耳局部炎症损害,该两种病症在OME的病程中扮演着重要的角色,但两者之间是否存在关联性、治疗方案能否通过纠正机体免疫失衡来缓解病灶局部的炎症损害等问题仍亟需临床证据予以支撑。本研究分析了针对急性OME患者外周血T淋巴细胞亚群与中耳积液炎症因子的相关性,旨在阐明OME的发病机制,为合理制订治疗策略提供一定的依据。
1 资料与方法
1.1 一般资料
连续选取2017年2月至2020年2月辽宁中医药大学附属第四医院收治的122例急性OME患者作为病例组,并以同期100例接受健康体检者为对照组。两组患者或其监护人均签署知情同意书,本研究方案经医院医学伦理委员会审核通过。
纳入标准:(1)病例组患者均符合美国耳鼻咽喉头颈外科学会(American academy of otolaryngology-head and neck surgery,AAO-HNS)于2015年更新的《分泌性中耳炎临床实践指南》中的急性OME诊断标准[6],即均表现出急性发作的耳鸣、耳痛、自听过强、鼓膜变色、听力下降等临床症状及体征,耳镜检查可见鼓膜变形、活动度差、反射光锥消失、锤骨柄移位,鼓室积液较多者可见到积液平面,当头部位置改变时积液平面也随之变换,鼓膜可呈黄色或橘红色而发亮。(2)患者临床资料完整。(3)对照组患者均经临床检查排除耳部疾病。排除标准:(1)合并恶性肿瘤、重要器官功能不全、自身免疫疾病或免疫缺陷症、血液系统疾病者;(2)入组前已接受治疗或既往有OME病史者;(3)入组前1月内有应用糖皮质激素、免疫调节药物或确诊发生全身性感染疾病者;(4)外耳道、鼓膜或中耳发育畸形或具有鼓膜穿刺检查应用禁忌者。
1.2 观察指标
1.2.1 基线资料 对两组研究对象的年龄、性别、体质指数(body mass index,BMI)、合并基础疾病、吸烟史、饮酒史等基线资料进行调查和对比。
1.2.2 外周血T淋巴细胞亚群及血清炎症因子 分别采用乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝管、普遍真空管采集研究对象的晨起空腹外周静脉血样本2 mL、3 mL,对照组的采血时间为体检当日,病例组的采血时间为入院次日。抗凝血样本采用Invitrogen Attune NxT流式细胞仪(美国Thermo Fisher Scientific公司)检测CD4+T、CD8+T淋巴细胞比例、CD4+/CD8+T淋巴细胞比值。普遍血样则在室温下静置2 h后,以1 500 rpm速度(离心半径10 cm)离心20 min,并通过酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA法)分析血清中白细胞介素-2(interleukin,IL-2)、IL-4、IL-6、IL-10及肿瘤坏死因子-α(tumor necrosis factor,TNF-α)的水平。
1.2.3 中耳积液炎症因子 于入院次日通过耳内镜对病例组患者行鼓膜穿刺,采集0.3 mL中耳积液样本,并采用ELISA法检测IL-2、IL-4、IL-6、IL-10、TNF-α的水平。
1.3 统计学分析
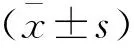
2 结果
2.1 两组研究对象基线资料的比较
两组研究对象基线资料的比较,差异均无统计学意义(P>0.05)。见表1。
2.2 两组研究对象外周血T淋巴细胞亚群和血清炎症因子的比较
病例组患者的CD4+T淋巴细胞的含量及CD4+/CD8+T淋巴细胞比值均低于对照组(P>0.05),但其CD8+T淋巴细胞的含量却高于对照组(P<0.05)。两组研究对象的血清炎症因子水平比较,差异无统计学意义(P>0.05)。见表2。
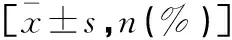
表1 两组研究对象基线资料的比较
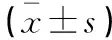
表2 两组研究对象外周血T淋巴细胞亚群和血清炎症因子的比较
2.3 病例组患者耳积液中的炎症因子水平与外周血T淋巴细胞亚群的相关性
病例组患者耳积液中的炎症因子水平均高于其血清中的炎症因子水平(P<0.05),见表3。其中,IL-2、IL-4、IL-6、TNF-α水平与外周血CD4+T淋巴细胞的含量及CD4+/CD8+T淋巴细胞的比值均呈负相关(P<0.001),与CD8+T淋巴细胞比例呈正相关(P<0.001),IL-10水平与外周血CD4+T淋巴细胞含量及CD4+/CD8+T淋巴细胞的比值呈正相关(P<0.001),与CD8+T淋巴细胞比例呈负相关(P<0.001)。见表4。
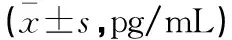
表3 病例组中耳积液与血清炎症因子水平比较
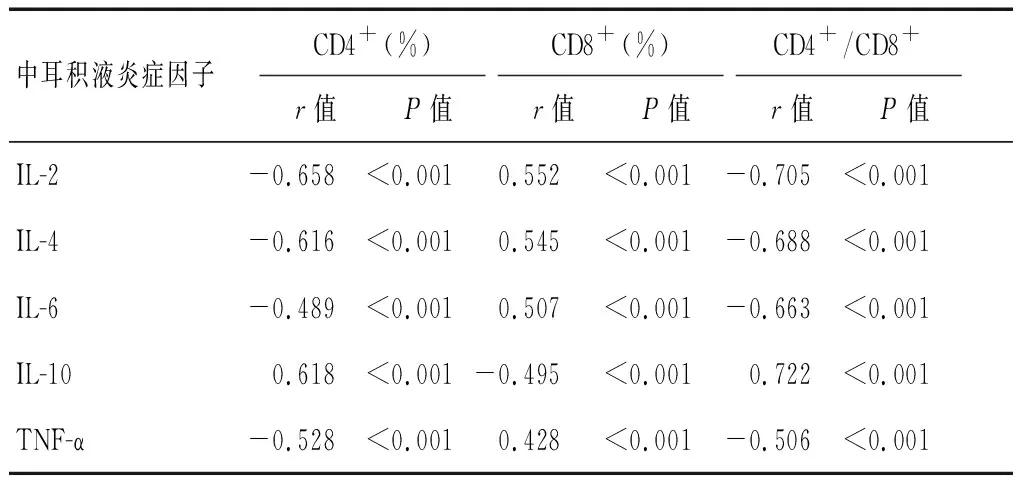
表4 病例组患者耳积液中炎症因子的水平与外周血T淋巴细胞亚群的相关性
3 讨论
免疫功能失调对OME病程的影响较大。本研究表明,急性OME患者机体存在明显的免疫功能障碍,处于显著的免疫抑制状态,与刘振等研究一致[7]。近年来,针对不同病程OME患者的免疫功能进行的对比分析[8-10]显示,随着OME由急性向亚急性、慢性进展,患者免疫功能的损害程度逐渐升高。并且,伴有腺样体肥大的OME患者的腺样体中也会出现淋巴细胞含量突变和免疫功能失调。
本研究发现,虽然急性OME患者的血清炎症因子水平均明显升高,但病例组与对照组之间进行比较却无明显的统计学意义,提示OME的发病未能显著相关于全身性炎症反应。但是,相关研究[11-13]指出,OME患者的血清炎症因子异常水平与病情的严重程度密切相关,如合并腺样体肥大的OME患者的炎症损伤程度显著高于未出现腺样体肥大的OME患者。此外,急性OME患者虽然存在外周血免疫细胞的紊乱,但外周血中IL-2、IL-4、IL-6、IL-10、TNF-α、γ-干扰素等炎症因子水平未见明显改变,仅在耳积液中表达明显异常,与迟作华等[14]研究一致。其原因可能是由于初发急性OME的免疫功能紊乱及其所致机体炎症损害程度明显低于慢性OME或合并腺样体肥大的患者,故其血清炎症因子水平变化不够明显。
本研究还发现,急性OME患者耳积液中的炎症因子水平明显高于其血清中的炎症因子水平,且炎症因子的水平与外周血T淋巴细胞的指标相关。OME患者耳积液的细胞学研究[15-16]证实,患者耳积液中含有大量的单核-巨噬细胞、中性粒细胞和嗜酸性粒细胞等炎性细胞,多种炎症因子失衡同时出现且相互关联。此外,急性OME患者耳积液中的IL-6、IL-10、TNF-α等炎症因子过表达,其水平与患者的预后相关[17-18],可能是由于微环境中编码炎症介质基因表达的转录因子NF-κB活性增强,IL-18等上游炎症因子通过活化Th细胞和Th1/Th2细胞功能失衡促进了一系列炎症因子的过度分泌[19-20],而局部大量过表达的炎症因子又进一步加剧了局部免疫功能的损害和中耳积液的形成。但是,OME患者耳积液中TNF-α、IL-2、IL-6、IL-10等炎症因子的水平也会随着抗生素、糖皮质激素、黏液促排剂、手术等治疗措施的有效应用而逐渐下降[21]。在临床治疗中,除了重视对中耳局部病灶的处理外,还应采取有效措施纠正患者机体的免疫失衡,从而提高治疗效果、改善预后。
综上所述,急性OME患者耳积液中炎症因子的水平明显高于血清,且与外周血T淋巴细胞亚群指标相关。
