miR-145-5p通过抑制ROCK1的表达减轻脓毒症诱导的急性肺损伤
2021-03-05徐锐峰杨威王剑冰赵鸣雁
徐锐峰,杨威,王剑冰,赵鸣雁
(哈尔滨医科大学附属第一医院重症医学科,黑龙江 哈尔滨 150000)
脓毒症是一种危及生命的综合症,其特征是由致病菌、真菌或病毒引起的过度性全身炎症反应[1-2]。严重脓毒症患者通常表现为微血管血栓和多器官功能障碍[3]。急性肺损伤(acute lung injury,ALI)是一种由多种急性低氧性呼吸衰竭疾病组成的临床综合征,已成为严重脓毒症最常见的并发症之一[4]。脓毒症诱导ALI是一种急性炎症过程,同时产生炎症细胞因子和趋化因子。如 ALI患者的支气管肺泡灌洗液中发现了白细胞介素-1β (IL-1β)[5]。ALI进展的另一个关键步骤是肺泡上皮细胞的广泛凋亡,是ALI患者肺上皮细胞死亡的主要原因[6]。因此,阻断肺部炎症反应和凋亡信号传导可能是改善脓毒症诱导的ALI的有效治疗策略。MicroRNAs (miRNAs)是一类小的非编码RNA,在许多病理过程中表现出了新兴的调节作用,包括脓毒症诱导的器官功能障碍[7]。研究[8]发现miR-146a过表达通过抑制NF-kB的激活和炎症细胞因子的表达,在体外减轻脓毒症引发的心肌功能障碍。miR-27a通过抑制NF-kB/TAB3信号通路,介导紫杉醇对脓毒症小鼠受损肝脏的保护作用[9]。研究[10]表明miR-145-5p在肺损伤组织中异常表达可能在ALI的发展中具有潜在作用,但miR-145-5p在ALI中的具体机制仍清楚。本研究通过小鼠脓毒症模型和原代小鼠肺微血管内皮细胞,研究miR-145-5p在脓毒症诱导ALI中的调控作用和潜在分子机制,旨在为脓毒症诱导的ALI的治疗提供一种新的方法。
1 材料与方法
1.1 材料及仪器
水合氯醛(Sigma-Aldrich,St.Louis,MI,USA);线性聚乙烯亚胺(PEI)纳米颗粒(Sigma-Aldrich,USA);胎牛血清(FBS;Thermo Fisher Scientific,Inc.,Waltham,MA,USA);Lipofectamine®2000 (Thermo Fisher Scientific,Inc.);脂多糖(Sigma-Aldrich,USA);荧光素酶检测试剂盒(Promega,USA); miRVanaTM miRNA分离试剂盒(Invitrogen);All-in-OneTM miRNA RT-qPCR Detection Kit (GeneCopoeiaInc.,Rockville,MD,USA) ;ReverTra Ace qPCR RT试剂盒提取总RNA (Toyobo,Osaka,Japan);7300 Real-Time PCR系统(Applied Biosystem,Foster City,CA,USA);BD FACS流式细胞仪分析细胞凋亡率(BD Biosciences,San Jose,CA,USA);RIA裂解缓冲液(PRO-PREPTM,iNtRON Biotechnology,Korea);AlphalmagerTM 2000成像系统(Alpha Innotech,San Leandro,CA,USA)。
1.2 脓毒症小鼠模型和质粒DNA的体内传导
选取24只成年雄性SPF级C57BL/6小鼠(28~32)g,平均(30±2)g,购买自中国医学科学院放射医学研究所动物实验中心,饲养于23~25 ℃、相对湿度45%~60%及光照12 h的环境中,并可随意获得食物和水,适应性饲养一周。将C57BL/6小鼠随机分为CLP组、CLP+NC agomir组、CLP+miR-145-5p agomir组和假手术组(Sham组),每组6只。CLP组、CLP+NC agomir组、CLP+miR-145-5p agomir组小鼠接受盲肠结扎穿刺(CLP)手术,建立CLP诱导的脓毒症模型[11],方法如下:小鼠注射10%水合氯醛(3 mL /kg,Sigma-Aldrich,St.Louis,MI,USA),并以仰卧位固定在手术台上,在小鼠腹部做一个4 mm的纵向切口以暴露盲肠。将暴露的盲肠在离针尖10 mm处用丝线结扎,然后在离结扎5 mm处用针穿刺1次。轻轻挤压盲肠,挤出少量粪便后,重新定位肠管,无菌缝合腹部肌肉、腹膜和皮肤。术后立即皮下注射5 mL/100 g生理盐水进行复苏。Sham组进行与其他三组相同的手术过程,但不结扎或穿孔盲肠。CLP组、CLP+NC agomir组、CLP+miR-145-5p agomir组miRNA试剂、miR-145-5p agomir 和 scrambled control (NC agomir)均购置GenePharm公司(中国上海),与线性聚乙烯亚胺(PEI)纳米颗粒(Sigma-Aldrich)混合[12]。CLP手术前一周,经尾静脉将200 μL含5 nmol miRNA (miR-145-5p agomir或NC agomir)的混悬液经静脉注射到指定组。术后24 h对各组小鼠实施二氧化碳窒息安乐死,收集肺部组织并妥善储存以供进一步分析。
1.3 组织学分析
采集各组同样部位的小鼠肺组织标本用于组织病理学检查,采用4%多聚甲醛固定,石蜡包埋,切成5 μm的切片,使用苏木精和伊红染色(HE)。肺损伤的程度由对实验不知情的研究者使用肺损伤评分来估计[13],每张切片随机选取5个区域在400倍数下进行评分,评分越高,损伤程度越大。
1.4 细胞培养和转染
分离原代小鼠肺微血管内皮细胞(primary mouse lung microvascular endothelial cells,MPVECs)置于DMEM培养基中,辅以10%胎牛血清(FBS;Thermo Fisher Scientific,Inc.,Waltham,MA,USA)、100 U/mL 青霉素和100 μg/mL链霉素在37 ℃、5% CO2饱和湿度的培养箱培养[14]。miR-145-5p模拟物(miR-145-5p mimics)和对照模拟物(NC mimics)均购自上海基因制药有限公司(中国上海),根据使用说明,取对数生长期的MPVECs细胞接种于6孔板中,用含10%胎牛血清的DMEM培养液培养细胞,当细胞达60%融合时,采用Lipofectamine®2000 (Thermo Fisher Scientific,Inc.)将miR-145-5p mimics、NC mimics转染到MPVECs细胞中。转染24 h后,用1 mg/mL脂多糖(LPS)刺激细胞。在救援实验中,在LPS处理24 h前,用过表达ROCK1的慢病毒载体(ROCK1)(或空慢病毒载体)和miR-145-5p模拟物共转染MPVECs。用空慢病毒载体(vector)和对照模拟物(NC mimics)共转染MPVECs作为对照组。
1.5 双荧光素酶报告分析
扩增含有miR-145-5p预测结合位点的ROCK1 3’-UTR片段,并克隆到pmirGlo载体(GenePharm)中荧光素酶基因的下游。将对数生长期的MPVECs细胞接种到24孔板中(每孔1×103个细胞),待细胞达到60%融合时,将miR-145-5p模拟物和对照模拟物分别与ROCK1 3’-UTR野生型或突变型重组质粒共转染。转染48 h后,使用Renilla luciferase报告基因(pRL-CMV,Promega,USA)检测荧光素酶活性。报告基因活性采用荧光素酶检测试剂盒(Promega,USA)根据生产厂家的方案进行测定。
1.6 实时荧光定量PCR(qRT-PCR)
使用miRVanaTM miRNA分离试剂盒(Invitrogen)从小鼠肺组织和MPVECs中提取靶miRNA。采用All-in-OneTM miRNA RT-qPCR Detection Kit (GeneCopoeiaInc.,Rockville,MD,USA) 对miR-145-5p进行逆转录。根据制造商的说明,使用ReverTra Ace qPCR RT试剂盒提取总RNA (Toyobo,Osaka,Japan)。目的基因扩增采用7300 Real-Time PCR系统(Applied Biosystem,Foster City,CA,USA),U6作为miR-145-5p的内参,β-actin作为mRNA表达的内参。每个样本检测3次,采用2-ΔΔCt法计算表达情况。所用引物及片段大小如下:miR-145-5p (23 bp):F:5′-CCT TGT CCT CAC GGT CCA GT-3′, R:5′-AAC CAT GAC CTC AAG AAC AGT ATT T-3′; U6 (75 bp):F:5′-CGC AAG GAT GAC ACG CAA ATT CG-3′, R:5′-AAC GCT TCA CGA ATT TGC GT-3′;IL-1β (314 bp):F:5′-CCA GGA TGA GGA CCC AAG CA-3′, R:5′-TCC CGA CCA TTG CTG TTT CC-3′; IL-6 (474 bp):F:5′-TAG CCG CCC CAC ACA GAC AG-3′,R:5′-GGC TGG CAT TTG TGG TTG GG-3′; ROCK1 (230 bp):F:5′-AAA GAA AGG ATG GAG GAT GAA GT-3′, R:5′-TGT AAC AAC AGC CGC TTA TTT G-3′; β-actin (325 bp) F:5′-ATC ACT GCC ACC CAG AAG AC-3′, F:5′-TTT CTA GAC GGC AGG TCA GG-3′。使用miRVanaTM miRNA分离试剂盒(Invitrogen)从MPVECs中提取靶miRNA,采用上述同样的方法进行qRT-PCR实验。
1.7 酶联免疫吸附试验(ELISA)
提取小鼠肺组织的总蛋白和MPVEC裂解液,根据制造商的说明,采用ELISA试剂盒(R&D Systems,Minneapolis,MN,USA,XY-EM1810,XY-EM1624)检测IL-6和IL-1β蛋白水平。制备MPVECs裂解液,根据制造商的说明,采用ELISA试剂盒(R&D Systems,Minneapolis,MN,USA,XY-EM1810,XY-EM1624)检测IL-6和IL-1β蛋白水平。
1.8 转录活性分析
小鼠肺组织中caspase-3的转录活性采用caspase-3检测试剂盒(Abcam,Cambridge,UK)根据生产厂家的方案检测。采用蛋白酶抑制剂RIPA缓冲液(Bio-Rad Laboratories,Hercules,CA,USA)制备肺组织匀浆。将所有样品的蛋白浓度调整为每50 μL细胞裂解缓冲液对应100~150 μg蛋白。将50 μL羟色胺2×反应缓冲液与10 mM DTT混合,加入到50 μL的样品中,再加入5 μL 4 mM DEVD-p-NA在37 ℃下孵育2 h。采用酶标仪在450 nm处测定过氧化物酶反应产物的光密度值。采用caspase-3检测试剂盒(Abcam,Cambridge,UK)根据生产厂家的方案检测MPVECs中caspase-3的转录活性,经LPS处理30 min后,在细胞裂解缓冲液中裂解MPVECs,采用上述同样的方法测定过氧化物酶反应产物的光密度值。
1.9 细胞凋亡检测
采用Annexin V-FITC Apoptosis Detection Kit (#14085,Abcam),根据说明书进行细胞凋亡检测。将转染后的MPVECs细胞培养于6孔板中,达到70%~80%的融合度,经LPS处理24 h后,收集细胞,离心,重悬于500 μL 1×缓冲液中,浓度为5×105个细胞/mL。然后将5 μL Annexin V-FITC和5 μL碘化丙啶(PI)加入样品中,避光室温孵育5 min。使用BD FACS流式细胞仪分析细胞凋亡率(BD Biosciences,San Jose,CA,USA)。
1.10 Western blot
采用RIA裂解缓冲液(PRO-PREPTM,iNtRON Biotechnology,Korea)提取转染后MPVECs细胞系总蛋白。取相同量总蛋白上样,经10% SDS-PAGE分离并转移到PVDF膜上(MilliporeSigma,Burlington,MA,USA),在37 ℃下用5%脱脂乳封闭1 h,加入一抗(ROCK1浓度1∶2000,#ab45171,Abcam;β-actin浓度1∶2 000,#ab32572,Abcam)在4 ℃下,持续6 h。随后,将PVDF膜用TBS洗涤3次,每次10 min。加入羊抗兔二抗(1∶3000,#ab6721,Abcam),室温孵育45 h,TBS洗涤3次,每次10 min。应用AlphalmagerTM2000成像系统对蛋白条带进行可视化(Alpha Innotech,San Leandro,CA,USA),并对谱带密度进行量化分析。
1.11 统计学分析
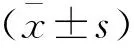
2 结果
2.1 各组miR-145-5p表达水平及肺损伤情况比较
与Sham组相比,CLP组肺组织中miR-145-5p表达明显降低(P<0.05);与CLP+NC agomir组相比,在脓毒症小鼠中注射miR-145-5p过表达质粒显著提高了miR-145-5p的表达水平(P<0.05)(图1A)。采用肺损伤评分法评估肺组织损伤程度,其中miR-145-5p过表达可显著改善CLP手术引起的肺组织的损伤程度(P<0.05)(图1B)。Sham组肺泡形态结构正常,而CLP组小鼠肺泡壁和间隔增厚,肺泡囊塌陷,可见血管充血和出血。脓毒症小鼠注射对照agomir后的组织病理学特征与模型组相似。而miR-145-5p的诱导减轻了脓毒症引起的肺泡损伤(图1C)。
2.2 miR-145-5p对各组小鼠肺组织凋亡标志物的活性和炎症因子水平的影响
与Sham组相比,CLP术后肺组织中凋亡标志物caspase-3的转录活性显著升高(P<0.05)。相比CLP+NC agomir组,miR-145-5p过表达导致caspase-3的活性显著降低(P<0.05)(图2A)。相比Sham组,脓毒症小鼠IL-1β和IL-6 mRNA和蛋白表达水平均显著升高(P<0.05)(图2B)。相比CLP+NC agomir组,miR-145-5p过表达可显著降低IL-1β和IL-6的mRNA和蛋白表达水平(P<0.05)(图2C)。

2.3 过表达miR-145-5p对脂多糖诱导的MPVECs细胞凋亡和炎症反应的影响
采用LPS刺激MPVECs模拟体外肺损伤,与未采用LPS处理的对照组相比,经LPS处理的细胞中miR-145-5p水平显著降低(P<0.05)。相比NC mimics组,miR-145-5p模拟物转染显著增加miR-145-5p的表达水平(P<0.05)(图3A)。经LPS处理后caspase-3的活性显著提高,而miR-145-5p过表达明显降低了caspase-3的活性(P<0.05)(图3B)。miR-145-5p过表达显著抑制了LPS诱导的MPVECs中IL-1β和IL-6的mRNA和蛋白表达水平(P<0.05)(图3C-D)。流式细胞仪数据显示,与NC mimics组相比,LPS刺激了MPVECs的凋亡(图3E)。提示转染miR-145-5p模拟物可有效地降低细胞凋亡率。
2.4 miR-145-5p直接靶向ROCK1
为了探究miR-145-5p参与ALI的潜在分子机制,使用TargetScan预测miR-145-5p的下游靶点,发现ROCK1是miR-145-5p的直接靶基因,并在其3’-UTR存在一个结合位点(图4A)。双荧光素酶报告基因实验显示,转染miR-145-5p模拟物的细胞ROCK1-WT的荧光素酶活性明显低于NC mimics组(P<0.05)(图4B)。此外,相比NC mimics组,miR-145-5p过表达显著降低了ROCK1 mRNA和蛋白表达水平(P<0.05)(图4C-D)。


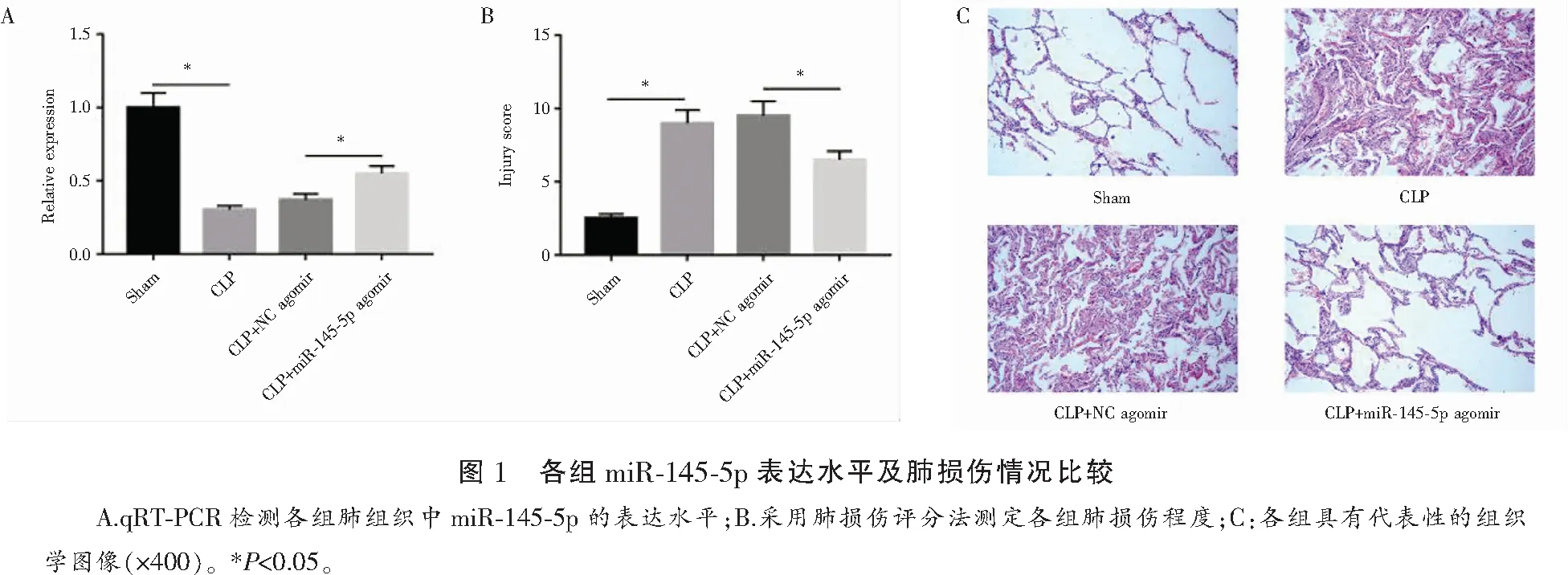
2.5 miR-145-5p通过抑制ROCK1抑制细胞凋亡和炎症反应
为进一步研究miR-145-5p是否通过靶向ROCK1调控细胞凋亡和炎症反应,LPS处理前24 h,将miR-145-5p模拟物和过表达的ROCK1的慢病毒载体(或空载体)共转染MPVECs。转染后的MPVECs中ROCK1 mRNA和蛋白表达水平均显著增加,证实了其转染成功(图5A-B)。与Vector+NC mimics相比,miR-145-5p+Vector共转染MPVECs的caspase-3活性明显降低(P<0.05),ROCK1过表达可使caspase-3转录活性恢复到对照组水平(图5C)。miR-145-5p过表达显著抑制MPVECs中IL-1β和IL-6的mRNA和蛋白表达水平(P<0.05),而ROCK1过表达导致IL-1β和IL-6的mRNA和蛋白表达水平显著上调(P<0.05)(图5D-E)。此外,过表达miR-145-5p可显著降低MPVECs的凋亡率,而过表达ROCK1的则显著促进MPVECs细胞凋亡(P<0.05)(图5F)。
3 讨论
脓毒症会导致更严重的疾病和更高的死亡率,是造成急性肺损伤的主要病因[15-16]。ALI作为一种由过度炎症发展而来的综合征,具有多种潜在的治疗靶点和信号传导途径[17]。小鼠CLP模型与人类腹部穿孔所致的脓毒症病理生理学相似,小鼠脓毒症模型已广泛应用于脓毒症所致器官功能障碍的研究中[18]。脓毒症发生时肺部细胞凋亡的增强和促炎因子的过度表达在ALI的发病机制中起关键作用[19]。IL-1β和IL-6是ALI炎症级联反应中积极分泌的两种促炎细胞因子[20]。抑制凋亡信号途径和炎症反应可能改善脓毒症诱导的肺损caspase-3是细胞凋亡的重要标志,在ALI动物模型中已报道caspase-3转录活性增加[21]。本研究发现ALI小鼠模型中caspase-3活性增强,IL-1β和IL-6分泌增多,细胞凋亡率明显增加。LPS是构成革兰氏阴性菌外膜的内毒素,已被广泛用于急性肺损伤的研究[22]。另外,在体外模型中,与未处理的细胞相比,LPS的刺激可导致MPVECs炎症细胞因子水平和细胞凋亡率明显增加,由此可见,ALI的发生发展与细胞凋亡和炎症因子的过度激活密切相关。
研究[23]表明在LPS诱导的肺损伤小鼠模型中miRNA可能参与ALI的发生发展,其中某些类型的miRNA显著下调,而有些miRNA显著上调或保持不变。miRNA在ALI中作用的进一步研究表明,miRNA可通过靶向特定分子或调控下游基因来调控ALI进程中的炎症反应和凋亡途径[24]。Liu等[25]研究表明miR-155的下调通过靶向SIRT1抑制了CLP诱导的ALI小鼠的肺细胞凋亡和炎症反应,提高了小鼠的存活率。miR-1246通过抑制其下游靶点ACE2降低ALI小鼠的细胞凋亡、IL-1β的释放和中性粒细胞浸润[26]。Xie等[27]研究表明在肺损伤过程中,miR-127表达明显降低,而过表达miR-127通过调节巨噬细胞的CD46来减轻肺部炎症反应。在另一项动物研究[28]发现miR-146a的上调通过抑制IRAK-1和TRAF-6的表达减轻了脂多糖诱导的ALI模型中炎症因子的分泌。本研究发现,与假手术组相比,CLP手术后小鼠肺部组织miR-145-5p水平显著下调。而术前转染miR-145-5p模拟物可有效缓解脓毒症诱导的肺损伤,同时可有效降低caspase-3的转录活性,抑制炎症细胞因子IL-1β和IL-6的表达,降低细胞凋亡率。此外,miR-145-5p在脂多糖处理的MPVECs中也表现出同样的抗凋亡和抗炎的作用。此外,ROCK1被预测并证实为miR-145-5p的直接下游靶点。前期CLP大鼠模型研究[29]表明,ROCK1的激活参与了脓毒症诱导ALI的发病机制,可能与氧化应激和凋亡有关。在本研究中,ROCK1过表达可使caspase-3转录活性恢复到对照组水平,而ROCK1过表达导致IL-1β和IL-6的mRNA和蛋白表达水平显著上调。此外,过表达ROCK1则显著促进MPVECs细胞凋亡。提示miR-145-5p通过抑制其下游目标ROCK1的表达,改善脓毒症诱导的急性肺损伤。本研究通过探讨miR-145-5p在体内外对脓毒症诱导的ALI发生的分子机制,发现miR-145-5p在脓毒症模型中诱导降低促炎细胞因子IL-1β和IL-6的表达,抑制凋亡标志物caspase-3的转录活性。进一步研究发现,miR-145-5p通过负调控其下游靶点ROCK1的表达,降低脓毒症诱导的ALI细胞凋亡和炎症反应。
综上所述,miR-145-5p通过下调ROCK1的表达,减轻了脓毒症诱导的ALI肺部细胞凋亡和促炎细胞因子的产生。miR-145-5p有望作为脓毒症诱导的ALI治疗的潜在靶点。
