常见淡水鱼肉制品快速鉴别方法的建立
2021-03-05张林周剑光喻亚丽何力
张林,周剑光,喻亚丽,何力
(农业农村部淡水鱼类种质监督检验测试中心, 中国水产科学研究院长江水产研究所, 湖北 武汉 4300223)
中国是水产品生产大国,也是水产品加工、出口大国,水产品及其加工品在中国经济与对外贸易中均占有举足轻重的地位。特别是由四大家鱼加工制备的鱼肉制品(鱼片、鱼丸、鱼糕和鱼排等)的消费量逐年增大,在超市、餐厅广受消费者青睐。由于制备鱼肉制品的鱼肉种类及组成不同,其营养价值及品质等方面存在较大的差异,而鱼肉制品经过加工,已经不能从外观等形态学特征鉴定组成鱼肉的鱼类品种,因此有不法商家以低值品种鱼假冒高值品种鱼制备鱼肉制品。近年来中国鱼肉制品的标签存在标识错误的现象,不法商贩为追求利润存在以次充好的现象,如以油鱼(Pseudogyrincheilusprocheilus)冒充鳕(Gadus)[1],或掺入廉价鱼肉品种等现象,这些现象容易造成无法针对所生产的鱼肉制品采取有效的保藏措施,进而引发更多的问题,如鱼肉制品老化、劣化等,对后续的鱼糜制品生产造成严重的影响。此外,这种掺假行为严重扰乱了行业正常秩序,侵犯了消费者的知情权,对消费者的利益造成损害,甚至造成食品安全隐患[2]。目前,对于青鱼(Mylopharyngodonpiceus)、草鱼(Ctenopharyngodonidellus)、鲢(Hypophthalmichthysmolitrix)和鳙(Aristichthysnobilis)4种鱼肉制品的快速检测方法还未有相关报道。为了维护鱼肉制品尤其是鱼糜产业的健康发展,保护消费者的合法权益,杜绝不安全食品流向餐桌,急需针对四大家鱼鱼肉制品建立一种能够快速、准确、高效地鉴定区分鱼肉制品成分的快速检测方法。因此本研究通过对已报道的四大家鱼序列进行比对分析,筛选青鱼、草鱼、鲢和鳙四大家鱼特异基因序列,设计了4对特异性引物,采用多重PCR的方法[3-4],运用基因克隆技术和生物信息学技术,建立同时针对青鱼、草鱼、鲢和鳙的准确、快速且高效的多重PCR检测方法,以期为安全的鱼肉制品市场监管提供技术支持,为广大消费者提供食用安全保障。
1 材料与方法
1.1 实验材料
实验所用的70个四大家鱼鱼肉样品为本地市场上随机抽取,包括冷冻鱼10个、鱼排15个、鱼丸15个、鱼糕15个和烤鱼片15个。将冷冻鱼、鱼排、鱼丸和鱼糕置于-20 ℃冰箱保存备用,烤鱼片置于常温条件下备用。品种明确的青鱼、草鱼、鲢和鳙鲜活鱼均由长江水产研究所养殖场提供。
1.2 主要试剂
Taq DNA聚合酶、MgCl2、dNTPs (2.5 mmol/L)。100 bp DNA ladder、pMD-18T载体及Top10感受态细胞均购自Takara公司。Tris-平衡酚(pH 8.0)、无水乙醇等化学试剂购自上海国药集团化学试剂有限公司。琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司。蛋白酶K购自德国Sigma公司。
1.3 仪器与设备
3K15冷冻离心机(德国Sigma公司);PCR仪(Thermofisher公司);DYCP-31E电泳仪(北京六一仪器厂);凝胶成像系统(Bio Rad公司)和Nanodrop微量核酸蛋白测定仪(Thermofisher公司)。
1.4 实验方法
1.4.1 鱼肉制品DNA提取
鱼肉组织DNA的提取采用传统的苯酚/氯仿方法[5]。取30 mg捣碎的鱼肉样品,向其中加入600 μL含有蛋白酶K(终质量浓度为200 μg/mL)的组织裂解液(10 mmol/L Tris-HCl,0.1 mol/L EDTA,0.5% SDS,pH 8.0),充分混匀,于55 ℃水浴锅裂解至澄清,加入600 μL由苯酚-氯仿-异戊醇(25∶24∶1,V/V)组成的抽提液进行抽提,上下翻转3~5次混匀后,12 000 r/min。离心10 min,取上清至新的离心管中,再次加入600 μL氯仿进行二次抽提,上下翻转3~5次混匀,12 000 r/min离心10 min。再次取上清至新的离心管中,加入700 μL冰乙醇静置2~3 min,5 000 r/min离心3 min,弃去上清液,收集沉淀DNA。用70%乙醇清洗沉淀2次,室温下晾干;加入50 μL无菌水溶解DNA,-30 ℃储存备用。
1.4.2 样品DNA纯度及质量浓度的测定
吸取经10倍稀释后的DNA溶液2 μL,以去离子水作为空白对照,使用微量核酸蛋白测定仪测定DNA的浓度及纯度。
1.5 扩增的目的基因及引物设计
NCBI网站下载青鱼D-LOOP基因、草鱼的COI基因、鲢16SrRNA基因和鳙12SrRNA基因序列,通过DNAstar 5.0软件中的Megalign进行比对分析,根据每种基因的特异性保守序列,设计4对特异性引物(表1)。引物均由生工生物工程(上海)股份有限公司合成。

表1 目的基因名称及引物序列Tab.1 Target gene and primer sequence
1.6 目的片段的PCR扩增及特异性分析
先用已知的4种鱼肉制品进行单一扩增,扩增体系为:10×Taq酶buffer(含Mg2+)2.5 μL,上、下游引物各0.5 μL(10 μmol/L),dNTPs 2 μL(2.5 mmol/L),模板DNA 2 μL以及Taq酶0.3 μL(5 U/μL),并用去离子水补至25 μL。PCR扩增条件:95 ℃预变性3 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,35个循环;72 ℃延伸10 min。PCR产物用1.5%琼脂糖凝胶进行凝胶电泳,并对目的条带进行回收,将回收产物分别克隆至pMD18T载体,构建重组质粒,并将重组质粒送往生工生物工程(上海)股份有限公司进行测序,并对测序结果进行比对分析。
1.7 单管多重PCR的优化
为优化多重PCR的最佳反应条件,对引物浓度、模板量、MgCl2浓度和退火温度进行了摸索,引物浓度初步确定(A1:0.3、A2:0.5、A3:1 μmol/L),模板量(B1:0.05、B2:0.5、B3:50 pg)、MgCl2浓度(D1:1、D2:1.5、D3:2 mmol/L)和退火温度(C1:50、C2:55、C3:60 ℃),采取固定其他因子,改变某一因子的方式,设计L9(34)正交试验,确定最佳反应条件,分别对4种鱼肉制品进行检测,正交试验表见表2。多重PCR产物进行1.5%琼脂糖电泳,观察产物条带。

表2 L9(34)正交试验Tab.2 L9 (34) orthogonal test programs
1.8 多重PCR特异性测定和敏感性测定
1.8.1 多重PCR 特异性测定
分别以4种含有不同鱼的目的基因片段的单一质粒为模板,同时加入4对引物进行扩增;另外,将含有不同鱼的目的基因片段的重组质粒进行随机组合,同时加入4对引物进行扩增,验证多重PCR扩增的特异性。
1.8.2 多重PCR敏感性测定
以经过连续稀释(1∶10)含有不同鱼目的基因的质粒为模板,按已优化的多重PCR反应条件分别进行扩增,测定多重PCR的灵敏性及目的基因的最低检测浓度。
1.9 人工模拟样品的检测和市售食品的验证
将4种鱼肉制品制成鱼糜,将其中任意2种、3种或4种混合,制成人工模拟鱼糜混合样品,每种鱼糜成分不低于2%;将市场上采集的不同品种鱼片、鱼丸、鱼糕和鱼排各15份,冷冻鱼10份(共70份),在4 ℃冰箱里贮藏2 d,然后无菌操作取样品各25 g均质成鱼糜样品;将所有的鱼糜样品各取1 g,提取鱼糜样品DNA,进行多重PCR检测,同时用常规方法和单一PCR检测,以验证建立的多重 PCR 检测方法的可行性与准确性。
2 结果
2.1 单一PCR扩增和核苷酸序列分析
用所设计的特异性引物扩增,PCR产物经过凝胶电泳分析得到青鱼、草鱼、鲢和鳙的目的片段,大小分别为298、210、306和639 bp,大小与预期相符。经克隆测序分析,所扩增目的片段与GenBank中相应基因序列同源性为98.1%~99.5%。

图1 单重PCR扩增4种鱼肉制品电泳结果1:青鱼;2:草鱼;3:鲢;4:鳙;M:100 bp DNA ladderFig.1 Electrophoresis results of single PCR for 4 fish products1: M.piceu;2: C. idella;3: H. molitrix;4: H. nobilis;M: 100 bp DNA ladder
2.2 多重PCR的优化结果
经过L9(34)正交试验对引物浓度、模板量、MgCl2浓度和退火温度4个条件进行了摸索,对多重PCR的最佳反应条件进行了优化,结果表明,优化后的反应体系为:在25 μL的反应体系中, MgCl2为 1.5 mmol/L,模板质粒为 4 μL(青鱼、草鱼、鲢和鳙各1 μL),上下游引物3.2 μL(青鱼各0.5μL、草鱼各0.5 μL、鲢各0.3μL和鳙各0.3 μL),dNTPs 2.5 μL(2.5 mmol/L),Taq酶0.5 μL(5 U/μL),10×Taq酶buffer 2.5 μL,PCR退火温度为55 ℃,35个循环。PCR扩增条件:95 ℃预变性3 min;94 ℃变性45 s,55 ℃ 退火45 s,72 ℃延伸45 s,35个循环;72 ℃延伸10 min。
2.3 多重PCR的特异性
当不同组合的4种鱼肉制品进行多重PCR时,都可以扩增出各自的目的基因片段,并且能通过琼脂糖凝胶电泳鉴定区分开来(图2~图5)。阴性对照均无扩增产物。

图2 青鱼单重PCR及多重PCR扩增不同鱼肉组合电泳图1:青鱼;2:草鱼+鳙;3:青鱼+鳙;4:鲢+鳙;M:100 bp DNA ladderFig.2 Electrophoresis results of single PCR for M. piceu and multiple PCR for different fish combined1: M.piceu;2: C. idella+ H. nobilis;3: M.piceu+ H. nobilis;4: H. molitrix+ H. nobilis; M.100 bp DNA ladder
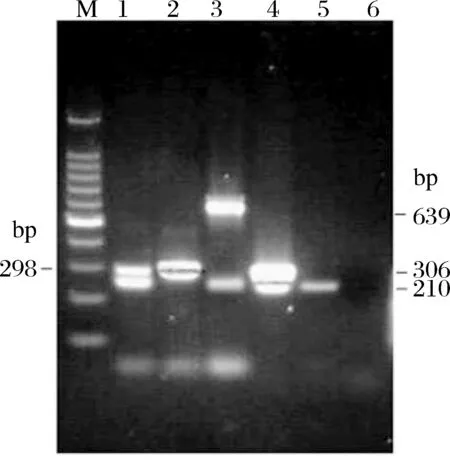
图3 草鱼单重PCR及多重PCR扩增不同鱼肉组合电泳图M:100 bp DNA ladder;1:草鱼+青鱼;2:青鱼+鲢;3:草鱼+鳙;4:草鱼+鲢;5:草鱼;6:阴性对照Fig.3 Electrophoresis results of single PCR for C. idella and multiple PCR for different fish combinedM:100 bp DNA ladder; 1:C.idella+M.piceu;2: M.piceu+H.molitrix;3:C.idella+H.nobilis;4:C.idella+H.molitrix;5: C.idella;6:negative control

图5 多重PCR扩增不同鱼肉组合电泳图1:青鱼+草鱼+鲢+鳙;2:青鱼+草鱼+鳙;3:青鱼+草鱼+鲢;M:100 bp DNA ladderFig.5 Electrophoresis results of multiple PCR for different fish combined1: M.piceu+C. idella+ H. molitrix+ H. nobilis;2: M.piceu+C. idella+ H. nobilis M.piceu;3: M.piceu+C. idella+ H. molitrix
2.4 多重PCR检测灵敏度
对含有目标片段的青鱼、草鱼、鲢和鳙重组质粒的多重PCR检测,灵敏度分别是0.5、50.0、50.0和0.5 pg;而单重PCR检测灵敏度分别是0.5、0.5、0.5和0.05 pg,结果表明多重PCR具有和单重PCR存在部分片段具有相同灵敏度。
2.5 人工模拟试验和市售食品验证结果
运用优化后的多重PCR反应对70份人工模拟样品进行鉴定,都能够扩增出各自相应的特异性条带,无非特异性扩增。表明该方法能够区分出由4种鱼肉随机组合的人工模拟鱼糜样品中所混合的成分,有效地识别鱼糜产品中青鱼、草鱼、鲢和鳙4种鱼肉的组成。
用该方法对随机采集的60份市售鱼肉样品进行检测,结果为22份鲢阳性样品、20份草鱼阳性样品、5份青鱼阳性样品和5份鳙阳性样品,其中5份同时检测出草鱼和白鲢,2份同时检测出青鱼、草鱼和鲢,1份同时检测出鲢和鳙。检测结果与单一PCR和常规方法检测结果一致,3种方法的符合率达100%,表明该多重PCR检测方法结果准确可靠。
3 讨论
3.1 DNA提取方法的选择
DNA的提取主要包括:CTAB法、SDS法、苯酚/氯仿法、试剂盒法及高盐法等[6]。通过所得DNA的浓度和纯度的比较,对各提取方法进行评价,并采用特异性引物扩增检验所得DNA模板质量。结果表明,采用试剂盒法和苯酚/氯仿法提取DNA浓度较高,纯度较好,均能满足PCR鉴别实验。相比而言,试剂盒方法更简便,但是对于大量样品而言,成本较高,而苯酚/氯仿法为经典的提取方法,操作简单,所需仪器设备均为实验室常规设备,便于实验室采用。因此,本实验选择苯酚/氯仿法进行样品DNA提取。
3.2 目的片段的选择
扩增目的基因的选择对PCR的特异性非常重要。实验所需的目的基因既要满足能够鉴定样品中是否含有青鱼、草鱼、鲢和鳙样品,同时还要区分样品中青鱼、草鱼、鲢和鳙4种鱼的成分。所以理想的目的基因是在同种鱼类中相对保守的基因,又可以区分4种鱼的差异基因。线粒体基因一方面保守性高,能够利用通用引物进行大范围扩增;另一方面有足够的变异趋势来区分不同物种DNA序列,从而对不同物种进行鉴定。因此线粒体基因常用来作为鉴定不同物种的有效目的基因。
线粒体DNA是线粒体基质中含有的全部环状DNA分子。线粒体DNA不含间隔区与内含子,无重复序列,无不等交换,无基因重组、倒位和易位等畸变[7]。因此,线粒体DNA在分子进化研究中作为常用的工具,通过比较不同物种相同基因之间的差别,确定这些物种在进化上的亲缘关系。线粒体16SrRNA、12SrRNA、COI、D-LOOP和Cytb基因在鱼类种内具有较高的同源性,而在不同种间的多态性差异比较明显,表明这些基因适于进行鱼类种以上阶元的鉴定[8]。
本研究从实验的准确性和适用性角度出发,在保证方法灵敏度满足检测需要的前提下,进行鉴定方法的选择,确定运用多重PCR检测。在确定使用分子生物学鉴定方法的前提下,通过NCBI上序列比对,避免4种鱼所选基因序列有相同序列,最后选取了线粒体青鱼D-LOOP部分序列、草鱼COI部分序列、鲢16SrRNA部分序列和鳙12SrRNA部分序列。通过比较发现所选4种鱼部分序列无交叉重叠序列,能够进行明确的物种鉴定。
3.3 鉴定方法的优化
本研究尝试运用多重PCR定性检测四大家鱼鱼肉制品中青鱼、草鱼、鲢和鳙的成分,为实现这一目标,首先通过引物优化设计排除PCR扩增时可能发生的错配,避免4对引物间形成黏性末端或部分双链。
另外,考虑到多重PCR的结果受多因素影响,如不同引物之间的竞争、模板和引物的浓度及其相对比例、dNTP浓度、Tm值及Mg2+浓度等[9-10],本实验在验证所设计引物为特异性扩增的基础上,通过正交设计对引物浓度、Tm值、Mg2+浓度和模板量等4个条件的多种组合进行最佳PCR条件的摸索。同时对退火温度PCR反应条件进行梯度优化实验,最终得到鱼糜制品成分检测的最适PCR体系和反应条件。
3.4 合理的引物设计
目前,还没有利用多重PCR方法检测青鱼、草鱼、鲢和鳙4种鱼肉的研究报道。在本实验中,多重PCR可成功检测这4种主要的鱼肉制品。在多重PCR中,合理的引物设计和引物对的适当比例是扩增成功的关键[11]。针对青鱼、草鱼、鲢和鳙的特异性引物,均能扩增出各自的特异性基因片段,而对其他3种鱼类没有扩增出来,表明所设计的引物是特异的。在多重PCR中,同时扩增多个目的片段,1种引物可能优先其他引物而扩增[12-13]。本实验通过调整4种鱼肉制品的引物比例,成功扩增到目的条带。利用多个引物设计的多重PCR方法,存在灵敏度不高的问题。本实验通过优化反应条件,灵敏度明显提高。尽管4对引物被混合在PCR反应中,依然能够通过多重PCR有效地检测出这4种鱼类。在以前报道中,多重PCR的灵敏度与单重PCR相同或低10倍[14]。然而,本研究所建立的多重PCR体系的灵敏度与单重PCR相比,具有相同或低10~100倍灵敏度,这一结果与姜永厚等[15]结果类似,分析原因可能为体系中的引物、模板种类和数量增加,增加了模板和引物结合的概率[16]。本实验对多重PCR作为传统PCR的补充进行了评价。针对上述4种鱼肉制品的110个样本进行了检测,多重PCR与单一PCR检测结果基本一致。目前,很多超市、菜市场或餐厅的鱼肉制品中存在混杂现象,如青鱼鱼丸、鱼糕或鱼排中混有草鱼;鲢或草鱼糕中掺杂其他鱼肉[17];鳙鱼头火锅中掺杂白鲢鱼肉[18]。
多重PCR在检测和确定鱼肉制品具有一种或多种鱼种方面,具有省时、省力、费用低的优点。本实验建立的多重PCR检测方法可用于水产品成分的鉴定。
4 结论
本研究建立了快速检测青鱼、草鱼、鲢和鳙的多重PCR体系,实现了对水产食品中的多种鱼肉制品的鉴别、检测和监控,为4种鱼肉制品检测试剂盒的研发奠定了基础,为鱼糜制品中各种成分的定量检测方法的开发提供了技术支持。旨在定性的同时准确定量,为企业和质检等相关部门提供方法手段,确保广大鱼糜消费者的权益。
