高产胞外多糖海洋芽孢杆菌分离鉴定及其多糖抗肿瘤活性分析
2021-03-05李尚泉陈佳何秀苗
李尚泉 陈佳 何秀苗




摘要:【目的】明確广西北部湾海洋细菌胞外多糖(EPS)独特的抗肿瘤等生物学活性,为北部湾海域细菌EPS活性研究及开发利用提供参考依据。【方法】采集广西钦州茅尾海红树林浅层土壤样品,使用LB-苯胺蓝培养基及苯酚—硫酸法筛选EPS高产海洋细菌,基于16S rRNA序列进行菌株鉴定;通过高效凝胶渗透色谱和红外光谱测定EPS的分子量及其结构,最后使用噻唑蓝(MTT)法测定EPS对Vero细胞的毒性及抑制HeLa细胞增殖的效果。【结果】筛选出1株EPS产量为0.2917 mg/mL的菌株,命名为QLc-04,在LB-苯胺蓝固体培养基上生长形成的菌落呈白色,不透明,中央略微隆起,表面粗糙,为革兰氏阳性杆菌。QLc-04与芽孢杆菌属(Bacillus)菌株的16S rRNA序列相似性在99.45%~99.82%,其中与B. thuringiensis BT62(CP044978)的相似度最高(99.82%),与B. cereus ATCC 14579T(AE016877)和B. mycoides DSM 2048T(ACMU01000002)相似性均为99.81%;在基于16S rRNA序列相似性构建的系统发育进化树上,QLc-04与芽孢杆菌属聚类为同一分支,因此确定QLc-04为芽孢杆菌属。QLc-04-EPS分子量约179.9 kD,属于具有吡喃型结构的多糖;QLc-04-EPS对Vero细胞无直接毒性,在10~300 μg/mL浓度范围内Vero细胞随QLc-04-EPS浓度的增加其增殖能力不断升高,但QLc-04-EPS浓度超过50 μg/mL时对HeLa细胞增殖的抑制作用显著增强(P<0.05)。【结论】海洋芽孢杆菌QLc-04经发酵培养36 h其EPS产量为0.2917 mg/mL;QLc-04-EPS为典型吡喃型多糖,分子量为179.9 kD,具有显著抑制HeLa细胞增殖的作用。
关键词: 海洋芽孢杆菌;胞外多糖(EPS);吡喃型结构;细胞毒性;抗肿瘤
中图分类号: S917.1 文献标志码: A 文章编号:2095-1191(2021)11-3166-08
Isolation and identification of an extracellular polysaccharide high-producing marine Bacillus and the study
on its anti-tumor activity
LI Shang-quan, CHEN Jia, HE Xiu-miao*
(School of Marine Sciences and Biotechnology, Guangxi University for Nationalities/Guangxi Key Laboratory for Polysaccharide Materials and Modifications, Nanning 530006, China)
Abstract:【Objective】The aim of the present study was to determine the biological activities, such as antitumor acti-vity of the extracellular polysaccharide(EPS) from marine bacteria in Beibu Bay, Guangxi,and to provide reference basis for the research,development and application of the biological activity of the EPS secreted by bacteriafrom Beibu Bay. 【Method】The shallow soil samples of Maowei Sea mangrove in Qinzhou, Guangxi were collected. The marine bacteria with high production of EPS were screened by LB-aniline blue culture medium and phenol-sulfuric acid method, and the strains were identified by 16S rRNA sequence. The molecular weight and structure of the EPS were determined by high performance gel permeation chromatography and infrared spectroscopy. Finally, the cytotoxicity of the EPS to Vero cells and the inhibitory effect on the proliferation of HeLa cells were determined by thiazolyl blue(MTT) method. 【Result】The results showed that a strain named QLc-04, with EPS production of 0.2917 mg/mL was screened. The colony of QLc-04 formed on LB-aniline blue solid medium was white, opaque, slightly raised in the center and rough on the surface. QLc-04 was identified to be Gram-positive bacilli. QLc-04 showed 99.45% to 99.82% 16S rRNA sequence similarity to Bacillus,with the highest similarity to B. thuringiensis BT62(CP044978)(99.82%),then 99.81% to B. cereus ATCC 14579T(AE016877) and B. mycoides DSM 2048T(ACMU01000002). In the phylogenetic tree based on 16S rRNA sequence si-milarity, QLc-04 and Bacillus were clustered into the same branch, so that QLc-04 was identified to be Bacillus. The mole-cular weight of QLc-04-EPS was about 179.9 kD and the EPS belonged to a polysaccharide with pyranoid structure. The QLc-04-EPS had no significant cytotoxicity to Vero cells. In the concentration between 10-300 μg/mL, the more QLc-04-EPS was used, the stronger proliferation ability of Vero cell was. However,when the concentration of QLc-04-EPS was more than 50 μg/mL, the inhibitory effect on HeLa cell proliferation was significantly enhanced(P<0.05). 【Conclusion】The production of EPS secreted by marine Bacillus QLc-04 is 0.2917 mg/mL after 36 h fermentation. QLc-04-EPSis a typical pyran polysaccharide with a molecular weight of 179.9 kD, and shows a significantly inhibitory effect on the proliferation of HeLa cells.
Key words: marine Bacillus; extracellular polysaccharides(EPS); pyranoid structure; cytotoxicity; anti-tumor
Foundation item: National Natural Science Foundation of China(32160824);Guangxi Natural Science Foundation(2017GXNSFAA198033); Innovation Project of Guangxi Graduate Education(YCSW2020134)
0 引言
【研究意义】近年来,越来越多研究表明各类多糖具有独特的生物活性,包括抗肿瘤、增强免疫力、抗凝及抗病毒等(Yu et al.,2018;赵爽等,2019;石子林等,2020),其中黄芪多糖和细菌荚膜多糖等已广泛应用于临床治疗血栓、调理免疫力及作为疫苗佐剂等(Yu et al.,2018;陈灿辉等,2019)。微生物种类繁多、数量庞大,相对于植物多糖和动物多糖而言,微生物多糖更易控制、提取及大规模生产。广西北部湾海域独特的气候环境使其极有可能蕴含产生新型生物活性多糖的细菌,因此,分析广西北部湾海洋细菌胞外多糖(Extracellular polysaccharides,EPS)抗肿瘤活性有利于提高对广西北部湾海洋细菌潜在生物活性的认知,对广西北部湾海洋微生物资源的开发与利用具有重要意义。【前人研究进展】至今,国内外学者已针对不同海域的微生物EPS活性进行了大量研究。Wu等(2016)从我国东海海底沉积物中分离出1株斯氏假单胞菌(Pseudomonas stutzeri 273),其EPS能有效抑制铜绿假单胞菌(P. aeruginosa PAO1)的细胞膜形成;Abdelnasser等(2017)从地中海中分离出2株EPS对HepG2肝癌细胞具有抑制作用的芽孢杆菌(Bacillus);Casillo等(2017)研究表明,海洋嗜冷菌Colwellia psychrerythraea 34H的EPS可作为防冻剂;Zhang等(2017)从我国南海海水中分离获得类单胞菌属细菌(Alteromonas sp. JL2810),并证实该菌株所产EPS对重金属具有良好的吸附作用;王菊(2019)从海洋中分离出1株芽孢杆菌,能通过下调细胞粘附分子CD99致使人肝癌细胞Huh7.5粘附能力下降,破坏伪足结构机制而达到抗癌症效果;Sahana和Rekha(2020)研究证实泛生菌属(Pantoea sp.)海洋细菌YU16-S3的EPS能通过Wnt/β-catenin途径促进创伤愈合。可见,海洋细菌EPS具有巨大应用前景。针对广西北部湾海域,王松柏(2005)从北部湾红树林泥样中筛选出270株海洋细菌,发现海洋短小芽孢杆菌(B. pumilus)PLM4株的EPS在125 μg/mL浓度下对Hep-2癌细胞系抑制率高达96.58%;付婷婷(2015)从广西北海海水样品中分离得到18株产EPS微藻,其中1株小球藻(Chlorella)BH95所产EPS初步纯化后(500 μg/mL)对DPPH·清除率为47.40%,1000 μg/mL时对羟基自由基(·OH)清除率为56.09%;郭甜甜(2015)从广西涠洲岛红树林根泥中分离出1株真菌Aspergillus versicolor PJX-9,其EPS清除DPPH·、超氧阴离子自由基(O2-·)和·OH的半有效浓度(EC50)分别为3.39、1.50和1.72 mg/mL;陈博文等(2019)从北部湾筛选出28株EPS具有抗氧化能力的細菌,对DPPH·的清除率为9.43%~71.10%。【本研究切入点】已有研究表明,从广西北部湾海域能分离出各类生产EPS的微生物(王松柏,2005;付婷婷,2015;郭甜甜,2015;陈博文等,2019),但关于该海域细菌EPS抗肿瘤活性的研究鲜有报道。【拟解决的关键问题】从广西北部湾近岸海域相关样品中分离鉴定出EPS高产菌株,并进一步通过噻唑蓝(MTT)法鉴定EPS的抗肿瘤活性,明确广西北部湾海洋细菌EPS独特的抗肿瘤等生物学活性,为北部湾海域细菌EPS活性研究及开发利用提供参考依据。
1 材料与方法
1. 1 试验材料
细菌分离所用泥样取自广西钦州茅尾海红树林(东经108°60′~108°76′,北纬21°61′~21°83′),去除表层泥土后采用无菌打孔器获取50 cm深的泥样,将泥样装入灭菌玻璃瓶中,4 ℃保存备用。LB海水培养基:酵母膏5.0 g,氯化钠5.0 g,蛋白胨10.0 g,琼脂20.0 g,蒸馏水500.0 mL,人工海水500.0 mL,pH 7.4~7.6。LB-苯胺蓝培养基:酵母粉5.0 g,氯化钠5.0 g,蛋白胨10.0 g,琼脂20.0 g,水溶苯胺蓝5.0 g,蒸馏水500.0 mL,人工海水500.0 mL,pH 7.4~7.6。产糖液体培养基:蔗糖4.0 g,酵母粉3.0 g,CaCO3 0.1 g,蒸馏水500.0 mL,人工海水500.0 mL,pH 7.4~7.6(马晶璟,2010)。Lysis Buffer for Microorganism to Direct PCR购自TaKaRa公司,2×Taq Plus Master Mix购自康为世纪生物科技有限公司,DMEM培养液购自美国Gibco公司,改良型RPMI-1640培养液购自美国Thermo公司,胎牛血清购自兰州民海生物工程有限公司,噻唑蓝(MTT)购自美国Amresco公司,二甲基亚砜(DMSO)购自北京索莱宝科技有限公司,HeLa细胞和Vero细胞购自中国科学院上海细胞库,葡萄糖、无水乙醇、氯仿、正丁醇、苯酚及浓硫酸均为国产分析纯。
1. 2 EPS高产菌株筛选
泥样用无菌人工海水混匀,取部分液体进行十倍梯度稀释(10-1~10-6)。各浓度梯度取50.0 μL涂布于LB-苯胺蓝固体培养基上,30 ℃恒温培养48 h。挑选黏稠、体积大、蓝色较深的菌落在LB固体培养基上继续划线纯化,再挑选单菌落转接种至25.0 mL的LB液体培养液中,30 ℃摇床(180 r/min)培养9 h获取种子液。取1.5 mL种子液加入48.5 mL LB液体培养基,27 ℃摇床(180 r/min)振荡培养36 h,然后取10.0 mL发酵液,加入等体积的 2.0 mol/L NaOH,颠倒混匀10次,室温放置20 min后12000 r/min离心30 min,取上清液,以3 mol/L HCl调整pH至6.0,3000 r/min离心30 min,肉眼观察EPS沉淀量,选择沉淀量多的菌株测定EPS含量。以葡萄糖为标准曲线,通过苯酚—硫酸法(杨勤等,2020)测定EPS含量,筛选出EPS产量较高的菌株。
1. 3 细菌种属鉴定
参照Clarke等(2007)的方法设计测序鉴定引物GM5F(5'-CCTACGGGAGGCAGCAG-3')和907R(5'-CCGTCAATTCCTTTGAGTTT-3'),委托北京六合华大基因科技有限公司合成。取适量菌体加入含50.0 μL Lysis Buffer for Microorganism to Direct PCR的1.5 mL EP管中,移液器混匀,80 ℃孵育15 min后8000 r/min离心1 min,取4.0 μL上清液为PCR模板。PCR反应体系25.0 μL:2×Taq Plus Master Mix 12.5 μL,DNA模板4.0 μL,GM5F和907R引物各1.0 μL,灭菌ddH2O 6.5 μL。扩增程序:94 ℃预变性2 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,进行35个循环;72 ℃延伸1 min。经1.0%琼脂糖凝胶电泳鉴定,PCR扩增产物在590 bp附近出现明显的目的条带,送至深圳华大基因股份有限公司测序。通過NCBI数据库进行BLAST比对分析,使用MEGA 6.0的邻接法(Neighbor-joining,NJ)绘制系统发育进化树,Bootstrap设为500次检验其可靠性。
1. 4 EPS提取及纯化
将种子液8000 r/min离心30 min,取上清液,加入4倍体积的95%乙醇,上下颠倒混匀10次,再用摇床振荡2 min,充分混匀,放入4 ℃冰箱过夜,8000 r/min离心15 min,弃上清液,剩余沉淀即为粗多糖。向粗多糖中加入双蒸水,边加入边混匀,直至完全溶解,粗多糖溶液和Sevage试剂(氯仿∶正丁醇=4∶1)按4∶1进行配比,摇床振荡30 min,杂蛋白为凝胶状沉淀,4000 r/min离心20 min后小心吸取上层多糖溶液,重复操作,直至两相之间无乳白色沉淀且分层明显。采用紫外分光光度计对200~400 nm波段进行扫描,观察260和280 nm处的吸收峰以检测EPS纯度,若仍有蛋白继续纯化。纯化的EPS以95%乙醇沉淀,再-20 ℃真空冷冻干燥过夜。
1. 5 EPS分子量及红外光谱分析
选用分子量为4400、9900、21400、43500、124000、196000和277000 Da的标准葡聚糖为标准品,使用色谱柱为Waters Ultrahydrogel Linear 7.8×300的高效凝胶色谱仪进行检测,进样量为30.0 μL,流速为1 mL/min,样品浓度为1%,流动相为三蒸水,绘制标准曲线。将纯化EPS用三蒸水溶解,相同条件下检测其分子量及纯度。称取2.0 mg纯化EPS和200.0 mg溴化钾,分别研磨并混匀压片进行红外扫描检测。
1. 6 EPS细胞毒性检验
纯化EPS配制成高浓度溶液,经0.22 μm过滤器过滤,涂布于LB固体培养基确定无菌后备用。以含10%胎牛血清的DMEM培养基将无菌EPS配制成10、30、50、100、300和500 μg/mL的溶液,使用MTT法检验EPS对Vero细胞是否具有毒性。Vero细胞在96孔细胞培养板中进行培养,每组5个重复孔,确保每孔50.0 μL培养基中含Vero细胞数为5×104个。各试验组每孔加入50.0 μL不同浓度的EPS溶液,空白组则加入50.0 μL培养基。细胞培养板置于37 ℃、5% CO2培养箱中培养48 h,弃培养液,于每孔中加入20.0 μL MTT溶液(5 mg/mL),孵育4 h后每孔加入150.0 μL DMSO,低速振荡10 min,使用酶标仪检测490 nm处的吸光值。
1. 7 EPS对肿瘤细胞增殖的抑制作用
在96 孔细胞培养板中运用MTT法检验EPS对HeLa细胞增殖的抑制作用,每组5个重复孔。用改良RPMI-1640完全培养基在细胞培养瓶中培养HeLa细胞,待细胞铺满后进行细胞消化并稀释,确保每孔50.0 μL培养基中含HeLa细胞数为5×104个。各试验组加入配制好的不同浓度EPS溶液(50.0 μL/孔),空白组则加入50.0 μL培养基。细胞培养板置于37 ℃、5% CO2培养箱中培养48 h,显微镜观察各浓度的细胞状态。参照戴碧涛等(2005)的方法,计算EPS对HeLa细胞的抑制率(%)=[1-(试验组吸光值/空白组吸光值)]×100。
2 结果与分析
2. 1 EPS高产菌株筛选结果
采集的泥样经稀释涂布于LB-苯胺蓝固体培养基上,筛选得到167株产EPS的海洋细菌,将培养基背面观察呈蓝色的菌落接种于发酵培养基上,采用苯酚—硫酸法测定EPS产量,结果得到1株EPS产量较高的菌株,其EPS产量为0.2917 mg/mL,命名为QLc-04。QLc-04在LB-苯胺蓝固体培养基上生长形成的菌落呈白色,不透明,中央略微隆起,表面粗糙(图1-A);从LB-苯胺蓝固体培养基背面观察,其菌落中央呈蓝色或蓝紫色(图1-B);革兰氏染色镜检显示QLc-04为革兰氏阳性杆菌(图1-C)。
2. 2 种属鉴定结果
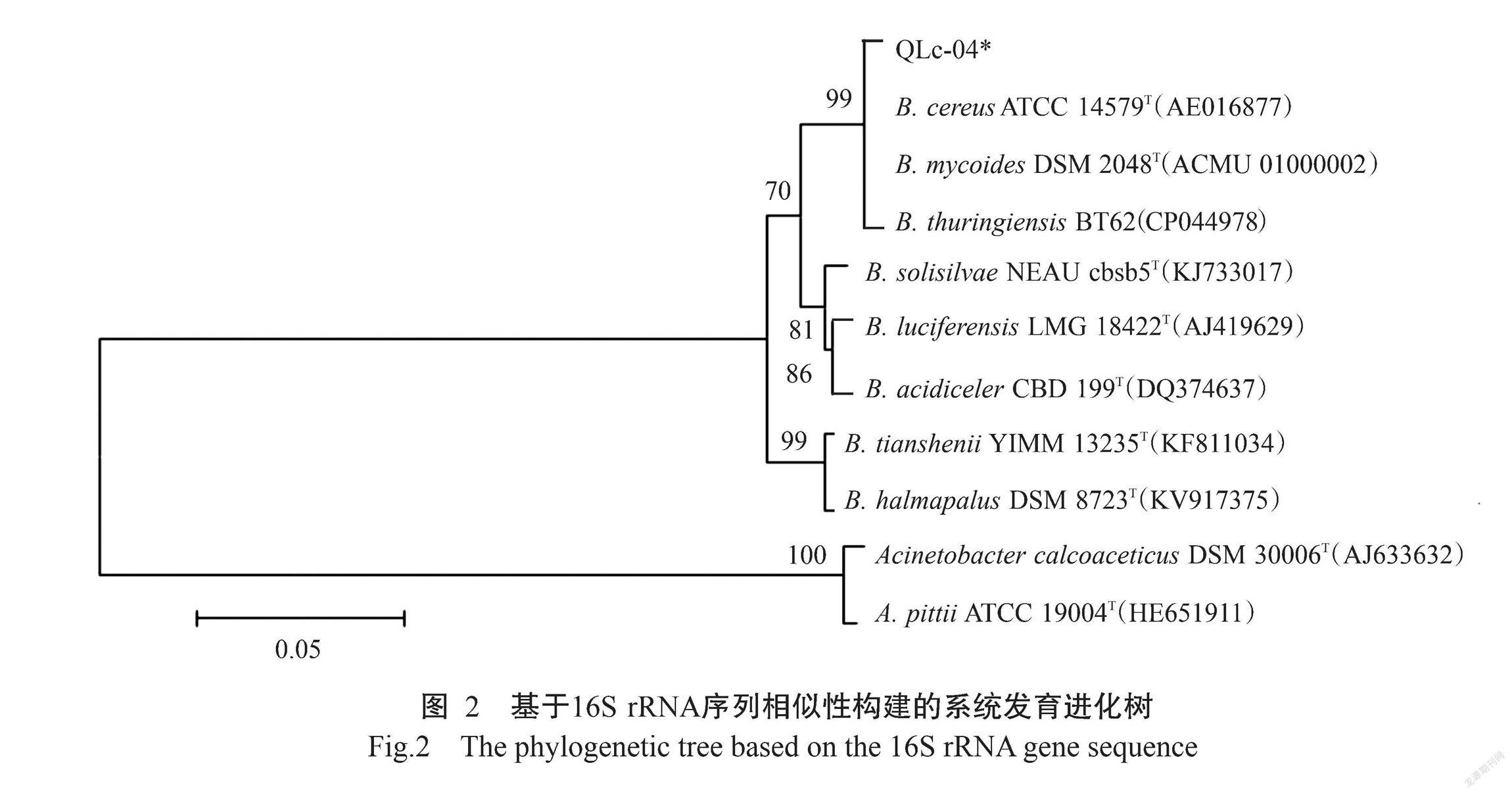
以QLc-04裂解液为模板,扩增其16S rRNA序列,测序后使用NCBI数据库进行BLAST比对分析,结果显示QLc-04与芽孢杆菌属(Bacillus)菌株的相似性在99.45%~99.82%,其中与B. thuringiensis BT62 (CP044978)的相似度最高(99.82%),与B.cereus ATCC 14579T(AE016877)和B. mycoides DSM2048T(ACMU 01000002)相似性均为99.81%。基于16S rRNA序列相似性构建QLc-04与部分芽孢杆菌属模式菌株及其他属菌株的系统发育进化树,结果发现QLc-04与芽孢杆菌属聚类为同一分支(图2),因此可确定QLc-04为芽孢杆菌属。
2. 3 QLc-04-EPS的分子量及红外光谱分析结果
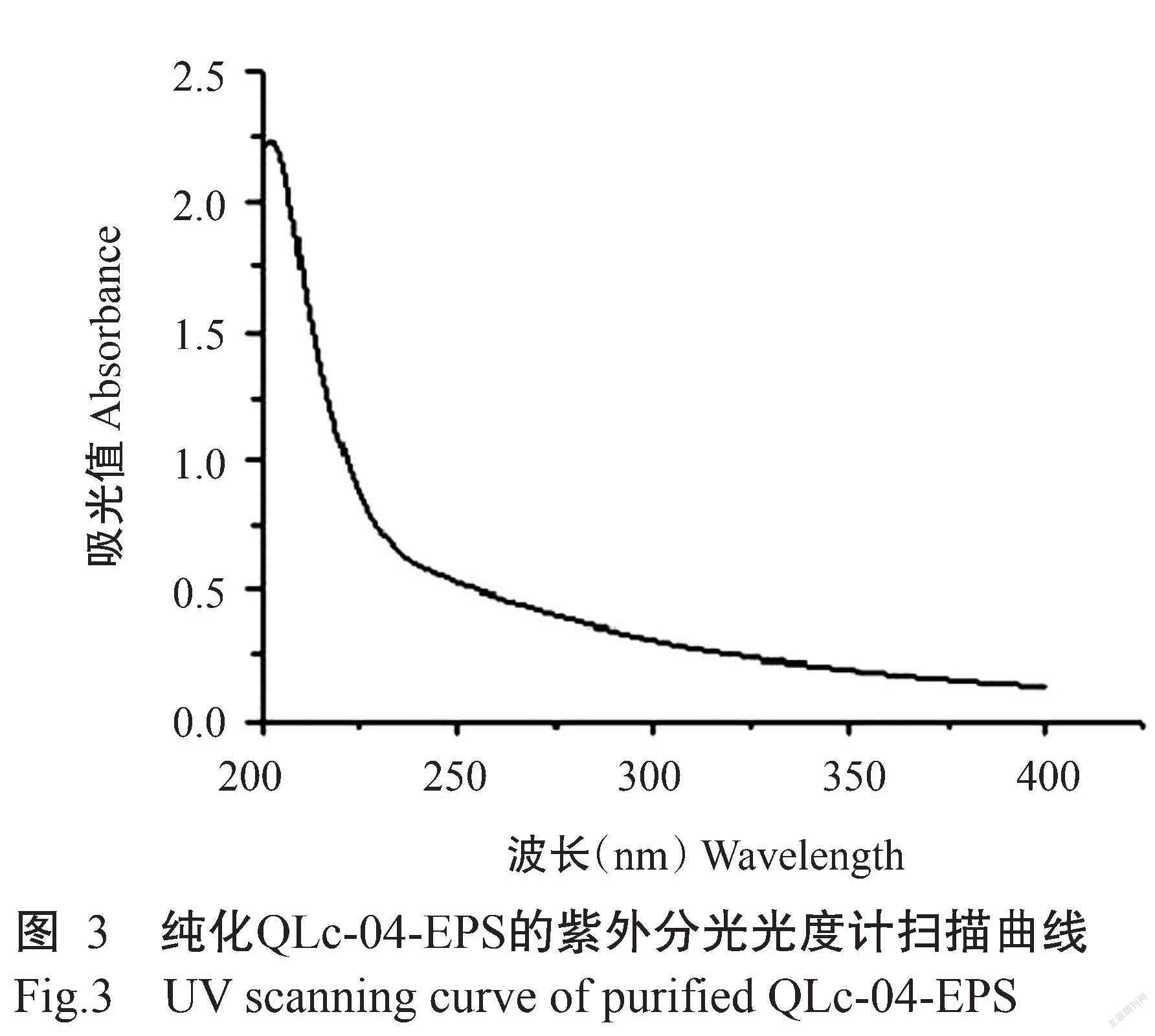
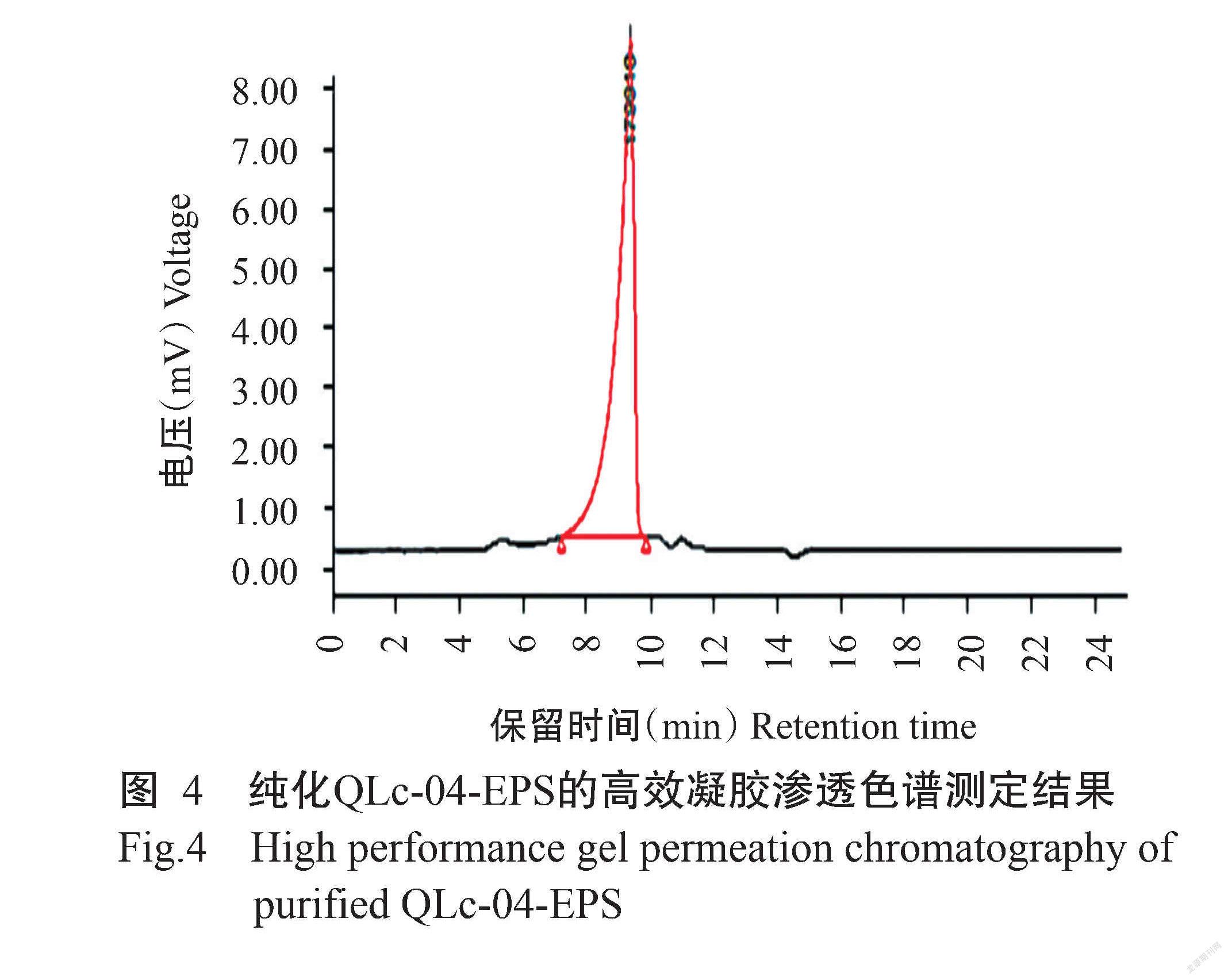
将QLc-04发酵液离心去除菌体后,经95%乙醇沉淀及多次Sevage法除蛋白纯化,紫外分光光度计检测结果显示QLc-04-EPS中的杂蛋白已除去,EPS纯度较高(图3)。获得的纯化QLc-04-EPS通过高效凝胶渗透色谱测定分子量,结果证实QLc-04-EPS的分子量约179.9 kD(图4)。
红外光谱分析结果(图5)显示,3405 cm-1处为糖类多羟基中O-H伸缩振动峰;2942 cm-1处出现弱吸收峰,为C-H伸缩振动峰;1623 cm-1为结晶水中O-H弯曲振动吸收峰或C=O伸缩振动峰;1419 cm-1是C-H变角振动吸收峰;1126 cm-1为吡喃型糖环C-O变角特征振动峰;但未见S=O及C-O-S的吸收峰,表明QLc-04-EPS结构内无硫酸根基团,即QLc-04-EPS为吡喃型典型多糖结构。
2. 4 QLc-04-EPS的细胞毒性检测结果
通过MTT法检测QLc-04-EPS对细胞的毒性作用,结果(表1)表明,在10~500 μg/mL浓度范围内QLc-04-EPS对Vero细胞无直接毒性;在10~300 μg/mL浓度范围内,Vero细胞随QLc-04 EPS浓度的增加其增殖能力不断升高。使用SPSS 22.0进行LSD检验,结果显示各浓度处理间无显著差异(P>0.05)。
2. 5 QLc-04-EPS对肿瘤细胞增殖的抑制作用
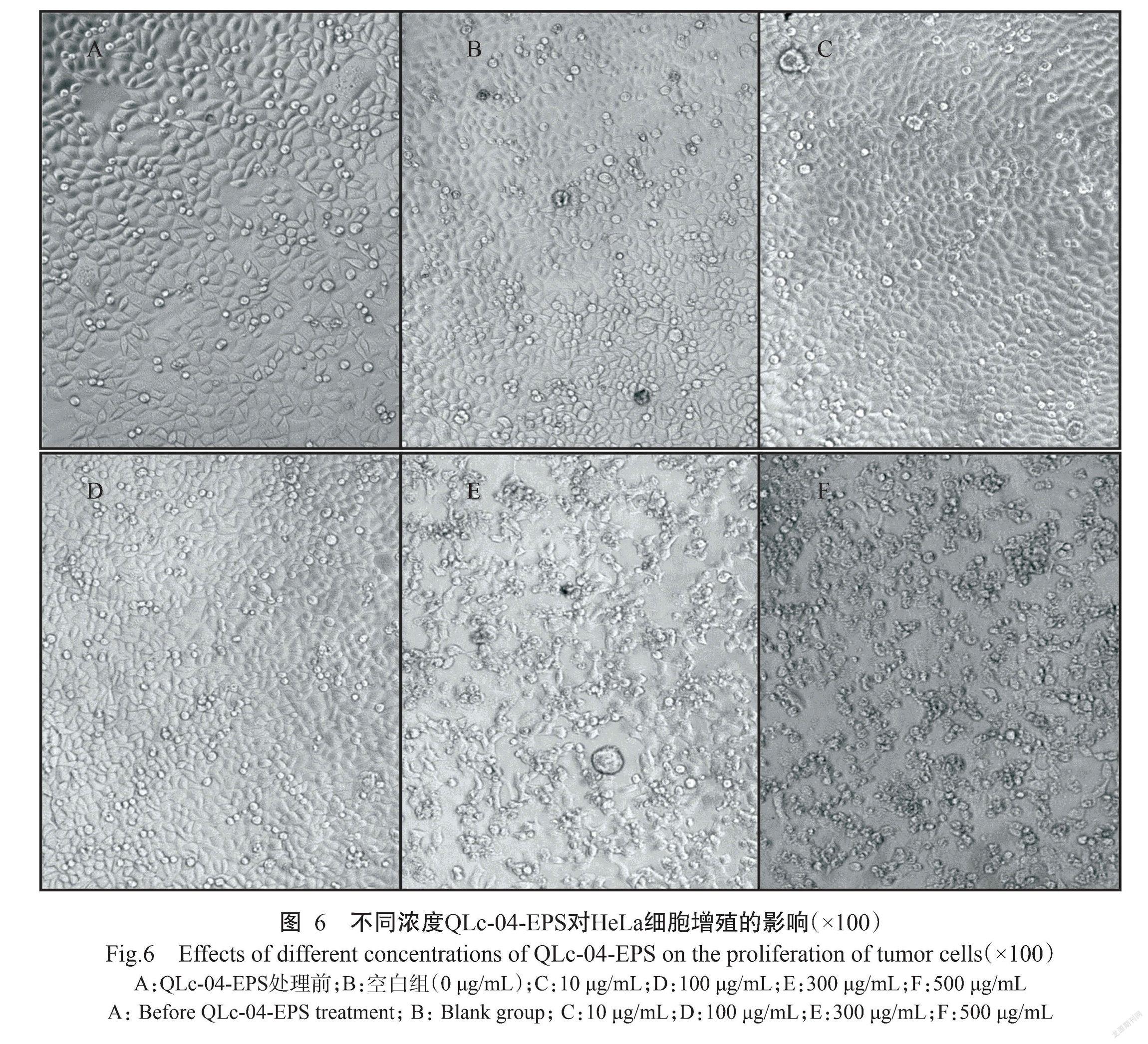
不同浓度的QLc-04-EPS作用于HeLa细胞,通过MTT法检测HeLa细胞增殖情况,如表2所示。当QLc-04-EPS浓度为10~30 μg/mL时,HeLa细胞的增殖情况与空白对照组相似,但QLc-04-EPS浓度超过50 μg/mL时对HeLa细胞增殖的抑制作用显著增强(P<0.05,下同),当QLc-04-EPS浓度达500 μg/mL时,QLc-04-EPS对HeLa细胞增殖的抑制率达62.25%。同时通过细胞形态观察发现,QLc-04-EPS浓度在10~100 μg/mL时HeLa细胞增殖变化不明显;但QLc-04-EPS濃度达300 μg/mL时,可观察到HeLa细胞密度降低、收缩成团,且细胞变得扁长;当QLc-04-EPS浓度达500 μg/mL时,大部分HeLa细胞开始收缩、细胞形态变得不完整并出现死亡现象(图6),与MTT法检测结果基本一致。
3 讨论
EPS对细菌抵抗外源环境压力具有非常重要的生理意义(Limoli et al.,2015)。海洋环境具有高压、低氧、高盐及重金属含量高等特点,细菌为应对这些外部生存压力会通过分泌EPS或形成特殊细胞壁多糖,以保护海洋细菌免受环境伤害,同时赋予海洋细菌产生各类具有特殊生物活性EPS的潜力。本研究从广西钦州茅尾海红树林浅层土壤中筛选出1株高产EPS的芽孢杆菌,命名为QLc-04;该菌株经发酵培养36 h后其EPS产量为0.2917 mg/mL,较房耀维等(2012)筛选获得的海洋细菌B. subtilis OST23a诱变育种后的EPS产量高;QLc-04-EPS的分子量为179.9 kD,红外光谱分析证实其具有典型的吡喃型多糖官能团,对Vero细胞无毒副作用,但具有抑制HeLa细胞增殖的作用。该结论为海洋菌株EPS抗肿瘤活性的进一步研究和利用打下了基础。
有关芽孢杆菌产多糖及其活性分析,Diao等(2014)研究发现,芽孢杆菌属LBP32的EPS通过抑制IκB激酶(IKK)磷酸化,而消除核因子κB(NF-κB)的激活,同时阻碍丝裂素活化蛋白激酶(MAPK)的激活,进而达到抑制LPS诱导促炎性介质的细胞效果;Mahdhi等(2018)在高盐环境分离获得1株芽孢杆菌(Bacillus spp.),并证实其EPS可抑制生物被膜形成,以及减少与细菌黏附和抗菌素耐药性有关的外排泵外排;蔡淼等(2020)从酒曲中分离到的甲基营养型芽孢杆菌GSBm-1,优化后的EPS产量达522.8 mg/L,其EPS不仅具有清除DPPH·和ABTS+自由基的作用,还能通过抑制α-葡萄糖苷酶而发挥降血糖作用。本课题组前期也从广西北部湾海域分离出多株具有抗氧化功能的不同种属海洋细菌EPS(陈博文等,2019),由此说明芽孢杆菌EPS具有抗氧化、抑菌、抗肿瘤及调节免疫等多种活性功能,且不同菌株的EPS生物学活性存在明显差异。
EPS的抗肿瘤活性与其结构密切相关。多糖分子量越大越易溶于水,其抗肿瘤能力越强。Ren等(2012)研究表明具有高活性抗肿瘤的松茸多糖分子量约10.0 kD,但也有研究表明相对分子质量小于 400.0 kD的香菇多糖具有较高的抗肿瘤活性(Zhang et al.,2011)。本研究中,QLc-04-EPS的分子量为179.9 kD,表现出对HeLa细胞增殖有较强的抑制能力。此外,分子量高于90.0 kD的多糖具有较强的免疫学调节活性(Ohno et al.,2001),因此QLc-04-EPS的免疫调节活性有待进一步探究。抗肿瘤多糖大多以葡聚糖为基础结构,但也有研究表明以甘露糖、葡萄糖和半乳糖等吡喃糖为单糖构型的多糖具有明显抗肿瘤活性(Ren et al.,2012;聂少平等,2018;商婷婷等,2019)。海洋短小芽孢杆菌(B. pumilus PLM4)EPS的分子量为116.0 kD,EPS的糖基为D-甘露吡喃糖和D-葡萄吡喃糖构型,同时含有较多己糖醛酸与少量丙酮酸,纯化EPS在125 μg/mL浓度下对Hep-2癌细胞系的抑制率高达96.58%(王松柏,2005)。香菇多糖LNT2的结构仅由D-吡喃葡萄糖组成,在800 μg/mL时对肝癌实体瘤细胞H22的最大抑制率为52.62%(李石军等,2014)。曹若冰(2018)从海洋中筛选出1株芽孢杆菌,EPS分子量为22.3 kD,其构型为杂多糖,含有甘露糖、氨基葡萄糖、鼠李糖、半乳糖醛酸、葡萄糖和木糖吡喃型多糖,对A549、H1299、H460细胞的抑制率分别为80%、67%和47%。本研究中,QLc-04-EPS的结构为典型吡喃型多糖结构,也表现出抗肿瘤活性的潜力,当其浓度达500 mg/mL时对HeLa细胞增殖的抑制率达62.25%,但抑制癌细胞增殖的机制有待进一步探究。
4 结论
海洋芽孢杆菌QLc-04经发酵培养36 h其EPS产量为0.2917 mg/mL;QLc-04-EPS为典型吡喃型多糖,分子量为179.9 kD,具有显著抑制HeLa细胞增殖的作用。
参考文献:
蔡淼,陈超,曹永强,杨贞耐. 2020. 甲基营养型芽孢杆菌产胞外多糖发酵条件及生物活性研究[J]. 食品科学技术学报,38(2):48-58. [Cai M,Chen C,Cao Y Q,Yang Z N. 2020. Research on fermentation conditions and bioactivity of exopolysaccharide produced by Bacillus methylotrophicus[J]. Journal of Food Science and Technology,38(2):48-58.] doi:10.3969/j.issn.2095-6002.2020.02.007.
曹若冰. 2018. 一种海洋芽孢杆菌胞外多糖的纯化鉴定及抗肿瘤机制研究[D]. 青岛:中国科学院大学. [Cao R B. 2018. Purification,identification and antitumor mechanism studies of a marine polysaccharide isolated from a marine bacillus[D]. Qingdao:University of Chinese Academy of Sciences.]
陈博文,成鑫花,廖秋妮,陈艳艳,李尚泉,吴家法,龙寒,禤金彩,刘红全,何秀苗. 2019. 广西北部湾近海产胞外多糖细菌多样性及其抗氧化活性分析[J]. 南方农业学报,50(10):2335-2342. [Chen B W,Cheng X H,Liao Q N,Chen Y Y,Li S Q,Wu J F,Long H,Xuan J C,Liu H Q,He X M. 2019. Diversities and antioxidant activities of exopolysaccharide-producing marine bacteria isolated from Beibu Gulf Coast in Guangxi[J]. Journal of Southern Agriculture,50(10):2335-2342.] doi:10.3969/j.issn.2095-1191.2019.10.26.
陈灿辉,江文韬,林彤,庄玮婧,郑宝东,李舒婷,郑亚凤. 2019. 竹笋多糖的提取、结构鉴定与生理功效研究进展[J]. 江苏农业学报,35(6):1513-1520. [Chen C H,Jiang W T,Lin T,Zhuang W J,Zheng B D,Li S T,Zheng Y F. 2019. Progress in extraction,structural characterization and biological activities of bamboo shoot polysaccharide[J]. Jiangsu Journal of Agricultural Sciences,35(6):1513-1520.] doi:10.3969/j.issn.1000-4440.2019.06.034.
戴碧涛,蒋纪恺,王付丽,张彦,张莉萍. 2005. 苦参碱联合抗肿瘤药抑制K562细胞增殖的研究[J]. 第三军医大学学报,27(5):392-394. [Dai B T,Jiang J K,Wang F L,Zhang Y,Zhang L P. 2005. Inhibitory effect of matrine combined with antineoplastic on proliferation of K562 cells[J]. Acta Academiae Medicinae Militaris Tertiae,27(5):392-394.] doi:10.3321/j.issn:1000-5404.2005.05.006.
房耀维,刘姝,吕明生,焦豫良,陈丽,王淑军. 2012. 产抗氧化胞外多糖海洋细菌Bacillus subtilis OST23a的诱变育种[J]. 食品科学,33(13):187-190. [Fang Y W,Liu S,Lü M S,Jiao Y L,Chen L,Wang S J. 2012. Mutation of marine strain Bacillus subtilis OST23a to obtain a high-yield antioxidant exopolysaccharides-producing strain[J]. Food Science,33(13):187-190.]
付婷婷. 2015. 產多糖海洋微藻筛选、培养及其多糖提取与抗氧化性研究[D]. 南宁:广西大学. [Fu T T. 2015. Screening,cultivation a marine microal and extracting polysaccharide with antioxidant activity[D]. Nanning:Guangxi University.] doi:10.7666/d.Y3087378.
郭甜甜. 2015. 四株海洋来源微生物胞外多糖的结构和抗氧化活性研究[D]. 青岛:中国海洋大学. [Guo T T. 2015. Structural characterizations and antioxidant activities of the extracellular polysaccharides produced by four marine microorganisms[D]. Qingdao:Ocean University of China.]
李石军,王凯平,汪柳,辜明,曾芳,张玉. 2014. 香菇多糖LNT2的提取分离纯化、结构及体外抗肿瘤活性研究[J]. 中草药,45(9):1232-1237. [Li S J,Wang K P,Wang L,Gu M,Zeng F,Zhang Y. 2014. Isolation,purification,structural elucidation,and antitumor activity in vitro of lentinan LNT2[J]. Chinese Traditional and Herbal Drugs,45(9):1232-1237.] doi:10.7501/j.issn.0253-2670.2014. 09.007.
马晶璟. 2010. 产胞外多糖细菌的分离和鉴定[D]. 合肥:安徽大学. [Ma J J. 2010. Isolation and identification of extracellular polysaccharides producing bacteria[D]. Hefei:Anhui University.] doi:10.7666/d.Y2261190.
聂少平,唐炜,殷军艺,谢明勇. 2018. 食源性多糖结构和生理功能研究概述[J]. 中国食品学报,18(12):1-12. [Nie S P,Tang W,Yin J Y,Xie M Y. 2018. Research progress on structure and functional activities of food-derived polysaccharides[J]. Journal of Chinese Institute of Food Science and Technology,18(12):1-12.] doi:10.16429/j. 1009-7848.2018.12.001.
商婷婷,李天凤,周靖,黄雪峰. 2019. 植物多糖的构效关系的研究进展[J]. 广东化工,46(8):99-100. [Shang T T,Li T F,Zhou J,Huang X F. 2019. Advances in research on structure-activity relationship of plant polysaccharides[J]. Guangdong Chemical Industry,46(8):99-100.] doi:10.3969/j.issn.1007-1865.2019.08.039.
石子林,李军乔,王雅琼,董浩,牛永昆,李晨芹. 2020. 蕨麻地上部分多糖提取工艺优化及其抗氧化活性[J]. 江苏农业学报,36(3):720-726. [Shi Z L,Li J Q,Wang Y Q,Dong H,Niu Y K,Li C Q. 2020. Optimization on the extraction process of polysaccharide from the aerial part of Potentilla anserina L. and its antioxidant activity[J]. Jiangsu Journal of Agricultural Sciences,36(3):720-726.] doi:10.3969/j.issn.1000-4440.2020.03.026.
王菊. 2019. 海洋细菌胞外多糖EPS11抗肿瘤转移机制研究[D]. 青岛:中国科学院大学. [Wang J. 2019. Anti-metastasis mechanism study of exopolysaccharides EPS11 from marine bacterium[D]. Qingdao:University of Chinese Aca-demy of Sciences.]
王松柏. 2005. 海洋細菌Bacillus pumilus PLM4抗肿瘤胞外多糖的研究[D]. 南宁:广西大学. [Wang S B. 2005. The primary research of antitumor exopolysaccharide of marine Bacillus pumilus PLM4[D]. Nanning:Guangxi University.] doi:10.7666/d.Y728202.
杨勤,谷文超,周浓,张兰胜,杨德全. 2020. 苯酚—硫酸法与蒽酮—硫酸法测定地参多糖的比较研究[J]. 食品科技,45(1):343-350. [Yang Q,Gu W C,Zhou N,Zhang L S,Yang D Q. 2020. Comparison of phenol-sulfuric acid and anthrone-sulfuric methods for determination of polysaccharide in Lycopus lucidus Tilrcz. var. Hirtus Regel[J]. Food Science and Technology,45(1):343-350.] doi:10.13684/j.cnki.spkj.2020.01.056.
赵爽,高宜,荣成博,苏哲,刘宇,马传贵,袁超,赵仲麟. 2019. 不同蜜环菌属真菌胞外多糖生物功能的研究[J]. 河南农业大学学报,53(2):213-217. [Zhao S,Gao Y,Rong C B,Su Z,Liu Y,Ma C G,Yuan C,Zhao Z L. 2019.Study on bioactivities of extracellular polysaccharides of different genus of Armillaria[J]. Journal of Henan Agricultural University,53(2):213-217.] doi:10.16445/j.cnki. 1000-2340.2019.02.009.
Abdelnasser S M,Yahya S M M,Mohamed W F,Asker M M,Abu Shady H M,Mahmoud M G,Gadallah M A. 2017. Antitumor exopolysaccharides derived from novel marine Bacillus:Isolation,characterization aspect and biological activity[J]. Asian Pacific Journal of Cancer Prevention,18(7):1847-1854. doi:10.22034/APJCP.2017. 18.7.1847.
Casillo A,Parrilli E,Sannino F,Mitchell D E,Gibson M I,Marino G,Lanzetta R,Parrilli M,Cosconati S,Novellino E,Randazzo A,Tutino M L,Corsaro M M. 2017. Structure-activity relationship of the exopolysaccharide from a psychrophilic bacterium:A strategy for cryoprotection[J]. Carbohydrate Polymers,156:364-371. doi:10.1016/j.carbpol.2016.09.037.
Clarke A M,Kirby R,Rose P D. 2007. Molecular microbial ecology of lignocellulose mobilisation as a carbon source in mine drainage wastewater treatment[J]. Water SA,30(5):658-661. doi:10.4314/wsa.v30i5.5179.
Diao Y,Xin Y Q,Zhou Y,Li N,Pan X L,Qi S M,Qi Z L,Xu Y M,Luo L,Wan H G,Lan L,Yin Z M. 2014. Extracellular polysaccharide from Bacillus sp. strain LBP32 prevents LPS-induced inflammation in RAW 264.7 macrophages by inhibiting NF-κB and MAPKs activation and ROS production[J]. International Immunopharmacology,18(1):12-19. doi:10.1016/j.intimp.2013.10.021.
Limoli D H,Jones C J,Wozniak D J. 2015. Bacterial extracellular polysaccharides in biofilm formation and function[J]. Microbiology Spectrum,3(3):10. doi:10.1128/microbiolspec.MB-0011-2014.
Mahdhi A,Leban N,Chakroun I,Bayar S,Mahdouani K,Majdoub H,Kouidhi B. 2018. Use of extracellular polysaccharides, secreted by Lactobacillus plantarum and Bacillus spp., as reducing indole production agents to control biofilm formation and efflux pumps inhibitor in Escherichia coli[J]. Microbial Pathogenesis,125:448-453. doi:10.1016/ j.micpath.2018.10.010.
Ohno N,Miura T,Miura N N,Adachi Y,Yadomae T. 2001. Structure and biological activities of hypochlorite oxidized zymosan[J]. Carbohydrate Polymers,44(4):339-349. doi:10.1016/S0144-8617(00)00250-2.
Ren L,Perera C,Hemar Y. 2012. Antitumor activity of mushroom polysaccharides:A review[J]. Food & Function,3(11):1118-1130. doi:10.1039/c2fo10279j.
Sahana T G,Rekha P D. 2020. A novel exopolysaccharide from marine bacterium Pantoea sp. YU16-S3 accelerates cutaneous wound healing through Wnt/β-catenin pathway[J]. Carbohydrate Polymers,238:116191. doi:10.1016/j.carbpol.2020.116191.
Wu S M,Liu G,Jin W H,Xiu P Y,Sun C M. 2016. Antibiofilm and anti-infection of a marine bacterial exopolysaccharide against Pseudomonas aeruginosa[J]. Frontiers in Microbiology,7:102. doi:10.3389/fmicb.2016.00102.
Yu Y,Shen M Y,Song Q Q,Xie J H. 2018. Biological activities and pharmaceutical applications of polysaccharide from natural resources:A review[J]. Carbohydrate Polymers,183:91-101. doi:10.1016/j.carbpol.2017.12.009.
Zhang Y Y,Li S,Wang X H,Zhang L N,Cheung P C K. 2011. Advances in lentinan:Isolation,structure,chain conformation and bioactivities[J]. Food Hydrocolloids,25(2):196-206. doi:10.1016/j.foodhyd.2010.02.001.
Zhang Z L,Cai R H,Zhang W H,Fu Y N,Jiao N Z. 2017. A novel exopolysaccharide with metal adsorption capacity produced by a marine bacterium Alteromonas sp. JL2810[J]. Marine Drugs,15(6):175. doi:10.3390/md15060175.
收稿日期:2020-08-29
基金項目:国家自然科学基金项目(32160824);广西自然科学基金项目(2017GXNSFAA198033);广西研究生教育创新计划项目(YCSW2020134)
通讯作者:何秀苗(1975-),https://orcid.org/0000-0002-8622-9177,博士,教授,主要从事分子病毒学与免疫学研究工作,E-mail:xiumiaohe0839@sina.com
第一作者:李尚泉(1994-),https://orcid.org/0000-0002-7763-4277,研究方向为分子病毒学,E-mail:1024269140@qq.com
2719501186243
