小白菜AMT1;2基因克隆、组织表达特性检测及功能验证
2021-03-05刘建国郭克婷肖艳辉林浴霞朱云娜
刘建国 郭克婷 肖艳辉 林浴霞 朱云娜

摘要:【目的】克隆小白菜铵转运蛋白基因(BcAMT1;2),检测其组织表达特异性并验证其功能,為深入探究BcAMT1;2基因在小白菜NH4+吸收和转运过程中的作用机制提供理论参考。【方法】以小白菜品种上海青为材料,采用同源克隆方法克隆BcAMT1;2基因,通过对其编码蛋白进行生物信息学分析,采用实时荧光定量PCR检测BcAMT1;2基因组织表达模式,并在拟南芥中超表达该基因以验证其功能。【结果】克隆的BcAMT1;2基因cDNA序列全长为1539 bp,编码512个氨基酸残基,蛋白分子量为54.90 kD,理论等电点(pI)为8.03,无信号肽,有9个跨膜结构域,定位于细胞膜上,为稳定的两性蛋白。BcAMT1;2蛋白归属于AMT1亚家族,具有AMT1的特征结构域(DFAGSGVVHMVGGIAGLWGALIEGPR),与拟南芥AtAMT1;2蛋白的氨基酸序列相似性最高,为91.21%。BcAMT1;2基因在叶片中的表达量显著高于其他组织(P<0.05,下同),根和叶柄次之,而在茎中几乎不表达。在0.25 mmol/L NH4+处理下,超表达BcAMT1;2基因的3个拟南芥株系的生物量(地上部鲜重和地下部鲜重)、主根长度和植株内NH4+-N含量较野生型均显著增加,而在20 mmol/L甲基胺(MeA)下,超表达BcAMT1;2基因的3个株系的株鲜重较野生型显著降低,且表现出植株叶片黄化、根系生长受抑等毒害效应。【结论】BcAMT1;2基因具有明显的组织表达特异性,可调控NH4+及其类似物甲基胺的吸收和转运,表明BcAMT1;2蛋白在小白菜对NH4+的吸收和转运过程中发挥着重要作用。
关键词: 小白菜;铵转运蛋白(AMT);基因克隆;生物信息学分析;功能验证
中图分类号: S634.3 文献标志码: A 文章编号:2095-1191(2021)11-2932-09
Molecular cloning,tissue expression specificity detection and functional analysis of AMT1;2 from Chinese cabbage Pak-Choi
LIU Jian-guo, GUO Ke-ting, XIAO Yan-hui, LIN Yu-xia, ZHU Yun-na*
(Henry Fok College of Biology and Agriculture, Shaoguan University, Shaoguan, Guangdong 512005, China)
Abstract:【Objective】In this paper,an ammonium transporter gene BcAMT1;2 was cloned from Chinese cabbage Pak-Choi,its bioinformatics and tissue expression characteristics were detected, and its function was analyzed, which provi-ded a the oretical basis for further studying the mechanism of BcAMT1;2 gene in NH4+ absorption and transportation in Chinese cabbagePak-Choi.【Method】Homologous cloning method was applied to clone BcAMT1;2 gene from Chinese cabbage Pak-Choi variety Shanghaiqing,then its biological information was carried out on its encoded protein. The expression of BcAMT1;2 gene was detected by real-time fluorescence quantitative PCR in different tissues of Chinese cabbage Pak-Choi,and the function of BcAMT1;2 was verified by overexpression BcAMT1;2 in Arabidopsis thaliana. 【Result】The open reading frame(ORF) of BcAMT1;2 gene was1539 bp,encoding 512 amino acids residues,with molecular weights of 54.90 kD,and theoretical isoelectric points (pI) of 8.03. In addition,BcAMT1;2 protein had no signal peptide,but had 9 transmembrane domains. Stability prediction indicated that BcAMT1;2 was stable amphipathic protein,and the subcellular localization prediction showed BcAMT1;2 might locate in the plasmalemma. Conserved domain analysis suggested that BcAMT1;2 included the motif (DFAGSGVVHMVGGIAGLWGALIEGPR),which was the signature motif of AMT1 subfamily. Moreover,amino acid sequence alignment showed that BcAMT1;2 protein had the highest homology with AtAMT1;2 (91.21%) in A. thaliana,so BcAMT1;2 was one member of AMT1 subfamily. The expression level of BcAMT1;2 in leaf was significantly higher than in other tissues in Pak-Choi(P<0.05, the same below),followed by the ones of root and petiole,but almost no expression in stem. Under the treatment of 0.25 mmol/L NH4+,the biomass(the fresh weight of root and shoot),the length of primary root,and NH4+-N content of the whole plants were significantly increased in three lines of overexpressing BcAMT1;2,compared with the ones of wild type. At 20 mmol/L methylamine(MeA),the biomass of three lines of overexpressing BcAMT1;2 was significantly lower than that of wild type,with yellow leaves,short roots,and other symptoms of ammonia toxicity. 【Conclusion】BcAMT1;2 gene has obvious tissue specificity and can regulate the absorption and transportation of NH4+ and its analog methylamine, indicating that BcAMT1;2 protein may play an important role in the absorption and transport of NH4+ in Pak-Choi.
Key words: Chinese cabbage Pak-Choi; ammonium transporter (AMT); gene cloning; bioinformatics analysis;functional verification
Foundation item: Guangdong Natural Science Foundation(2019A1515011680); Education Department Project of Guangdong(2019KTSCX164); Doctoral Research Startup Project of Shaoguan University (99000613)
0 引言
【研究意义】硝态氮(NO3-)和铵态氮(NH4+)是植物从土壤吸收的主要无机氮源,对作物生长发育和产量构成极为重要,其中,NO3-是旱作土壤中氮的主要形式,NH4+是水淹或酸性土壤中氮的主要形式(李静等,2012)。但在农业生产中,无论是何种土壤类型,施用氮肥均会导致NH4+在短期内成为主要形式(Xu and Takahashi,2020)。由于NH4+在同化和利用过程中消耗能量较NO3-少,故NH4+被认为是优势氮源(Socci and Templer,2011)。但吸收过量NH4+会导致毒害效应,如叶片变黄、生长受抑等。因此,将从土壤吸收的NH4+保持在适宜范围内对植物的生长尤为重要。植物主要通过铵转运蛋白(Ammonium transporter,AMT)吸收和转运NH4+(Yuan et al.,2007;Hao et al.,2020)。因此,克隆AMT基因,分析其生物学功能,对提高小白菜氮素利用率及其分子育种具有重要意义。【前人研究进展】目前,已从水稻(Sonoda et al.,2003)、拟南芥(Loqué et al.,2006)、玉米(Gu et al.,2013)、海棠(Li et al.,2017)、芥蓝(Song et al.,2017)、番茄(Filiz and Akbudak,2020)等多种植物中克隆获得AMT基因。植物AMT蛋白分为AMT1和AMT2两个亚家族。拟南芥的AMT1亚家族有5个成员,AMT2亚家族有1个成员(Yuan et al.,2007)。其中,AMT1亚家族成员具有不同表达特性,如AtAMT1;1、AtAMT1;2、AtAMT1;3和AtAMT1;5蛋白主要负責拟南芥根系对NH4+的吸收(Yuan et al.,2007);AtAMT1;4蛋白主要负责花粉对NH4+的吸收,从而调控花粉的氮营养(Yuan et al.,2009)。AtAMT1;1和AtAMT1;3蛋白对底物亲和性较高,负责吸收60%~70%的NH4+,AtAMT1;5蛋白负责吸收约10%的NH4+(Yuan et al.,2007);AtAMT1;2蛋白对底物亲和性较低,负责吸收18%~26%的NH4+,且将质外体途径中的NH4+跨膜转运至维管束中(Yuan et al.,2007;Straub et al.,2017),也可将氮分配于地上部(Duan et al.,2018)。但八棱海棠中的MrAMT1;2基因在根系中高特异性表达,其编码蛋白对底物的亲和系数较高;MrAMT1;1和MrAMT1;3基因在根、叶等营养器官中均有表达,其编码蛋白对底物的亲和性均低于MrAMT1;2(Li et al.,2017)。可见,不同植物的AMT均对NH4+的吸收和转运发挥重要作用,但不同AMT家族成员的作用存在差异。【本研究切入点】目前鲜见有关小白菜AMT基因克隆及表达分析的研究报道。【拟解决的关键问题】克隆小白菜AMT1;2基因(BcAMT1;2)全长序列,对其生物信息学分析,利用实时荧光定量PCR(qRT-PCR)检测其组织特异性,并进行功能验证,以期解析小白菜NH4+吸收转运过程中的生物学功能,为深入研究小白菜AMT1;2蛋白对NH4+吸收转运的分子调控机制及小白菜氮素营养研究提供理论参考。
1 材料与方法
1. 1 试验材料
供试小白菜(Brassica campestris ssp. chinensis Makino),品种为上海青(由河北省青县纯丰蔬菜良种繁育场繁育),种植于广东省韶关市韶关学院生态园温室。拟南芥Columbia-0(简称Col-0)为野生型。主要试剂:Eastep® Super总RNA提取试剂盒购自普洛麦格(北京)生物技术有限公司;PrimeScriptTM RT reagent Kit with gDNA Eraser、Prime STAR Max DNA Polymerase、TB Green® Premix Ex TaqTM(Tli RNaseH Plus)和pMD20-T载体均购于宝生物工程(大连)有限公司;Clone Express®II One Step Cloning Kit、DNA凝胶回收试剂盒、大肠杆菌DH5α和农杆菌GV3101购于上海唯地生物技术有限公司。超表达载体为pCIAMBIA3301为韶关学院英东生物与农业学院实验室保存。主要仪器设备:GelDoc XR凝胶成像系统(Bio-Rad,美国)、CFX connect TM Real-time PCR Detection System(Bio-Rad,美国)、T100 PCR仪(Bio-Rad,美国)、Nano-300微量分光光度计(杭州奥盛仪器有限公司)。
1. 2 试验方法
1. 2. 1 样品采集 种子用2.5% NaClO消毒10 min,用蒸馏水冲洗4~5次,采用珍珠岩穴盘育苗,播种后15 d移栽,用1/2 Hoagland营养液进行培养25 d后,取根、茎、叶、叶柄等组织,分别用液氮速冻,放在-80 ℃冰箱中保存备用。
1. 2. 2 总RNA提取及cDNA合成 采用Eastep® Super植物总RNA提取试剂盒提取总RNA,利用PrimeScriptTM RT reagent Kit with gDNA Eraser合成cDNA第一链。
1. 2. 3 基因克隆及阳性克隆鉴定 从NCBI数据库搜索白菜AMT基因序列信息,得到注释基因AMT1;2(XM_009113156.3)。根据其核苷酸序列,利用Pri-mer 5.0设计AMT1;2基因的特异引物(表1)。反应体系20.0 μL,2×Prime STAR Max Premix 10.0 μL,cDNA模板1.0 μL,上、下游引物(A12)各1.0 μL,ddH2O补足至20.0 μL。扩增程序:98 ℃预变性3 min,98 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.0 min,进行35个循环,72 ℃ 5 min。扩增产物回收后连接至pMD20-T载体,转化大肠杆菌DH5α感受态细胞,经菌落PCR鉴定后,挑取阳性克隆送广州擎科生物技术有限公司测序。
1. 2. 4 生物信息学分析 将测序结果提交至NCBI数据库,利用BLASTn在线工具进行对核苷酸序列检索比对。利用MEGA 6.0进行多重比对和系统发育进化树构建。利用ProtParam在线预测编码蛋白的理化性质;以ProtScale分析蛋白的亲疏水性;通过SOPMA在线分析蛋白的二级结构,借助Phyre2对蛋白的三级结构进行预测,并以Singal 4.1预测其信号肽;采用Protter进行跨膜结构域预测;采用Wolf Psort进行亚细胞定位;利用WEBLOGO对蛋白的保守结构域进行分析。
1. 2. 5 qRT-PCR检测 参照植物总RNA提取试剂盒说明分别提取小白菜根、茎、叶柄和叶片组织总RNA。参照PrimeScriptTM RT Reagent Kit with gDNA Eraser试剂盒说明去除gDNA并反转录合成cDNA第一链,用RNase-Free ddH2O稀释10倍后作为模板,按照TB Green® Premix Ex TaqTM(Tli RNaseH Plus)试剂盒进行qRT-PCR检测。反应体系为:2×TB Green TaqTM 10.0 μL,10 μmol/L上、下游引物(表1)各1.0 μL,cDNA模板1.0 μL,RNase Free H2O补充至20.0 μL。扩增程序:95 ℃预变性5 min,95 ℃ 5 s,60 ℃ 30 s,进行40个循环。每个样品重复3次。以GADPH和Actin作为内参基因,采用2-∆∆Ct计算基因的相对表达量,統计分析用t检验。
1. 2. 6 功能验证 利用Clone Express®II One Step Cloning Kit将BcAMT1;2基因cDNA序列连接至植物表达载体pCAMBIA3301,转化农杆菌GV3101后,然后浸染拟南芥Col-0的花序,通过转基因筛选获得T2代种子,用于功能验证。拟南芥种子用2.5% NaClO消毒10 min后,用无菌水冲洗5遍,播种于1/2剂量改良Murashige & Skoog培养基上(MS,氮源为4 mmol/L NaNO3,pH 6.0)进行预培养。生长环境条件:光照条件下25 ℃/黑暗条件下23 ℃;光周期为光照16 h/黑暗8 h。预培养4 d后,挑选整齐一致幼苗移至含不同N源[0.25 mmol/L NH4+、20 mmol/L甲基胺(MeA)]的方形培养皿(长×宽×高为10 cm×10 cm×1.5 cm)中生长,移植后10~14 d观察拟南芥野生型(WT)和转基因植株的表型和生长情况,测定其生物量、主根长和植株内NH4+-N含量等指标。
1. 3 统计分析
利用Excel 2010进行数据整理,利用SPSS 19.0进行Duncan’s显著性分析,利用SigmaPlot 11.0进行作图。
2 结果与分析
2. 1 基因克隆及序列分析结果
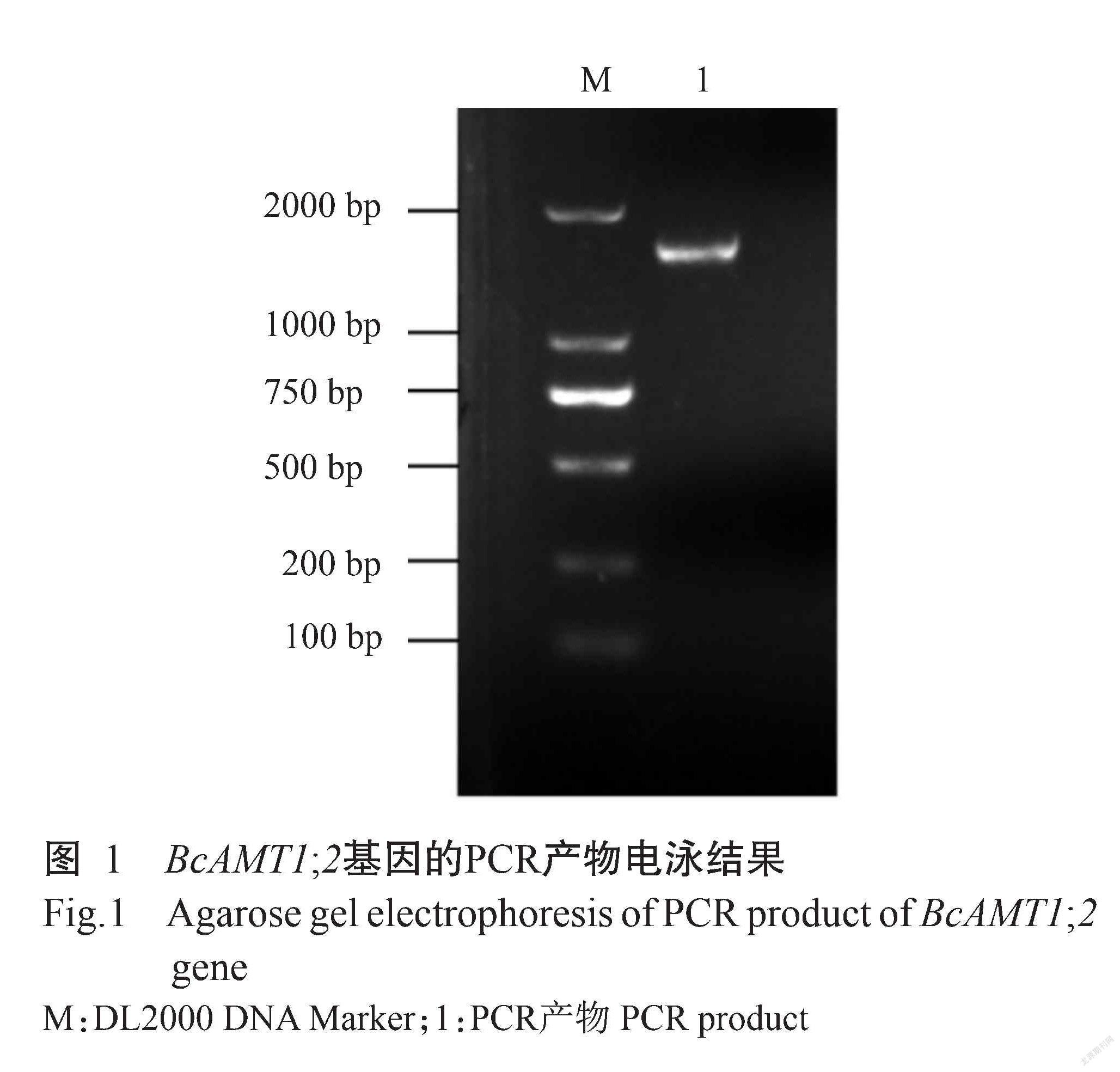
利用同源克隆方法,以小白菜cDNA为模板进行扩增,获得一条约1500 bp的条带(图1)。测序结果显示,该片段长度为1539 bp,将其提交至NCBI数据库进行比对分析,结果显示该片段与拟南芥AtAMT1;2基因的相似性为85.85%,与油菜BnAMT1;2的相似性达99.61%,表明该片段为小白菜的AMT1;2基因,缩写为BcAMT1;2。
2. 2 理化性质预测结果
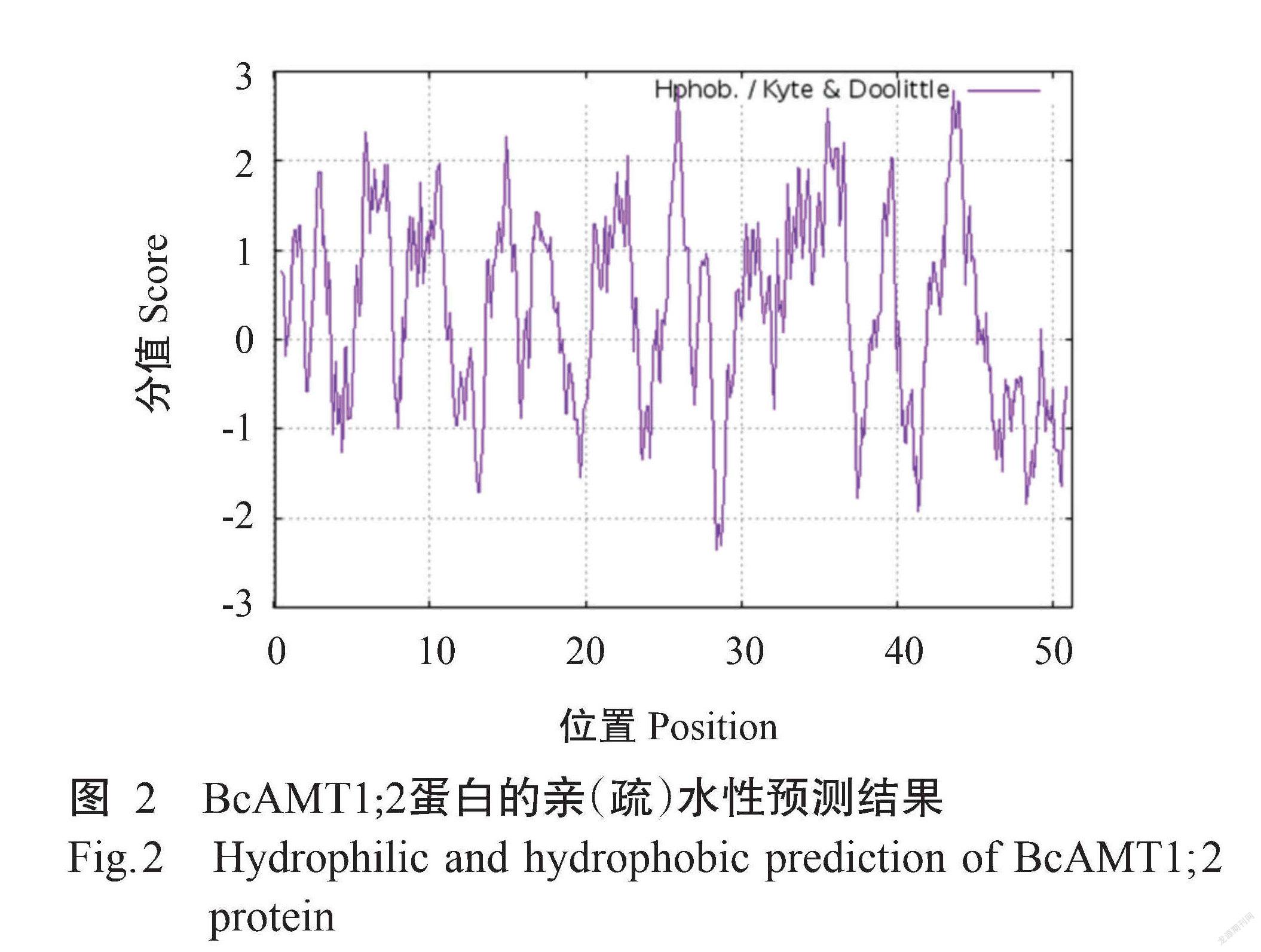
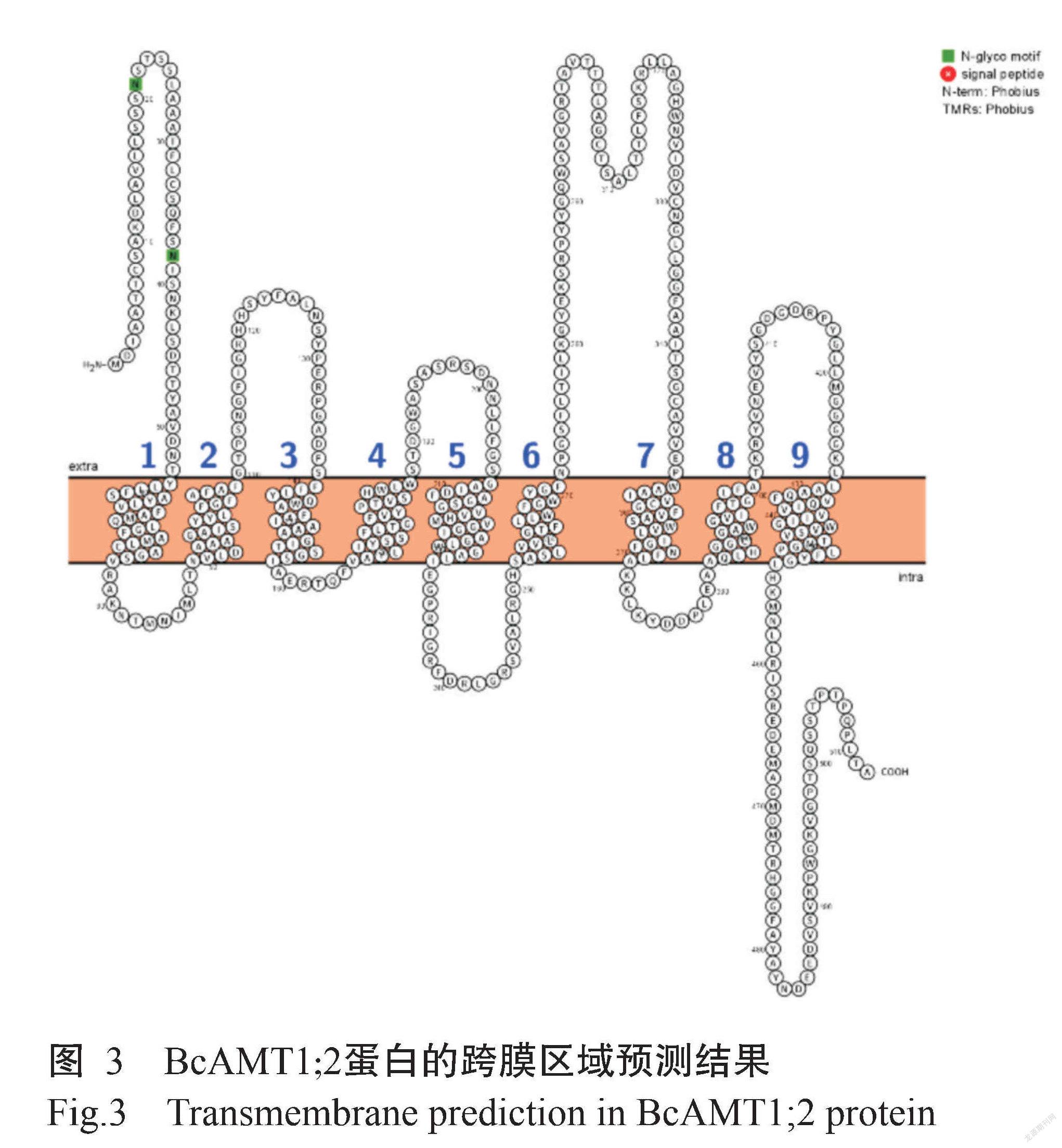
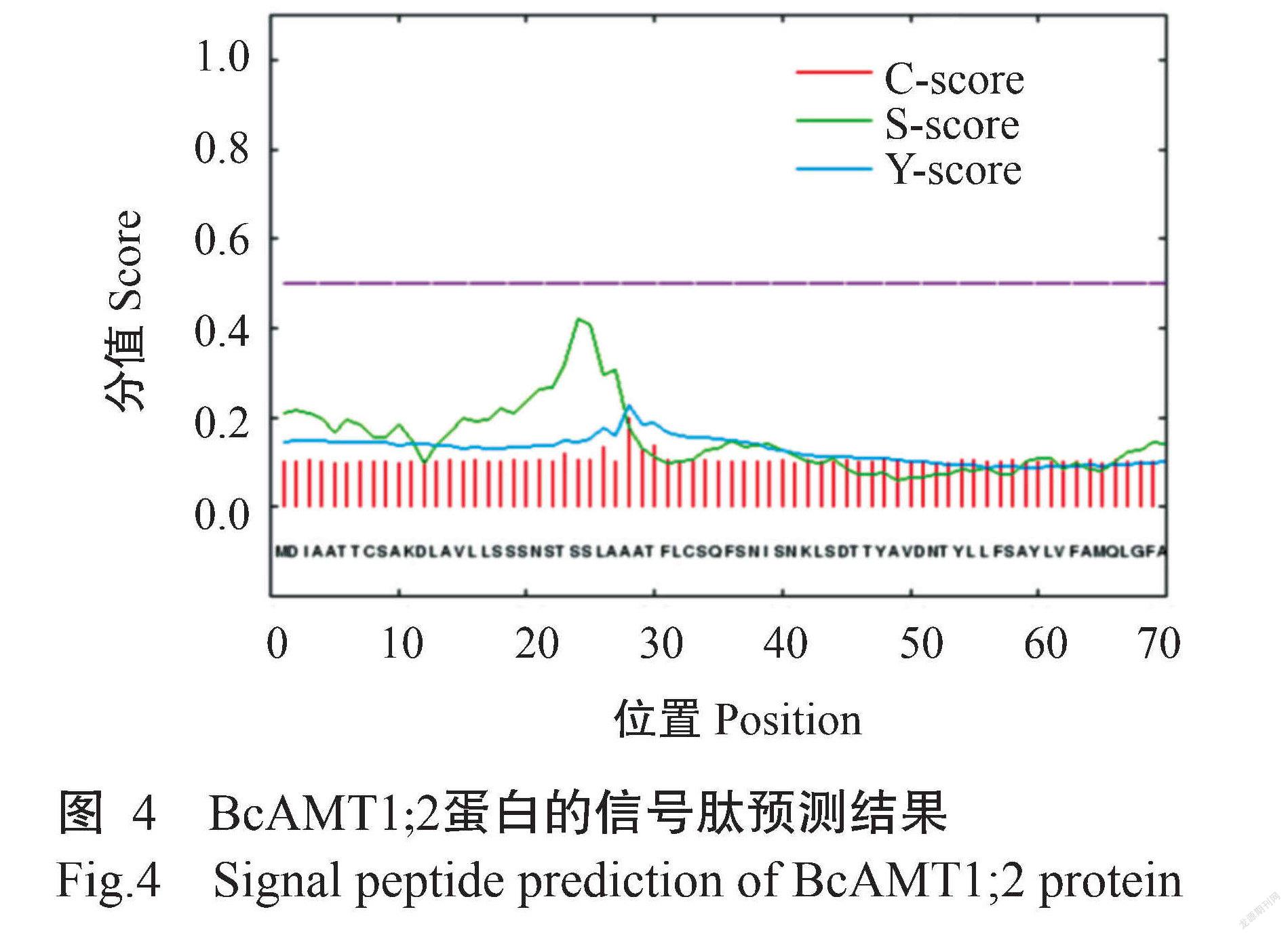
ProtParam预测结果显示,BcAMT1;2基因编码512个氨基酸残基,由20种氨基酸组成,其中甘氨酸(Gly)含量最高(占11.5%),半胱氨酸(Cys)含量最低(占1.6%);带正电氨基酸残基数为32个,带负电氨基酸残基数为30个;BcAMT1;2蛋白的分子量为54.90 kD,理论等电点(pI)为8.03,原子组成为C2518H3792N640O702S20。BcAMT1;2蛋白的不稳定系数为24.28,为稳定蛋白。ProtScale预测结果(图2)显示, BcAMT1;2蛋白既有疏水区,也有亲水区,为两性蛋白。Protter预测结果(图3)显示,BcAMT1;2蛋白为跨膜蛋白,共有9个跨膜区,其中,N端位于细胞膜外侧,而C端位于细胞膜内侧,为跨膜蛋白。Wolf Psort预测结果显示,BcAMT1;2蛋白定位于细胞膜上。通过SignalP 4.0预测分析,发现BcAMT1;2蛋白无信号肽序列(图4),说明该蛋白为非分泌型蛋白。
2. 3 二、三级结构预测结果
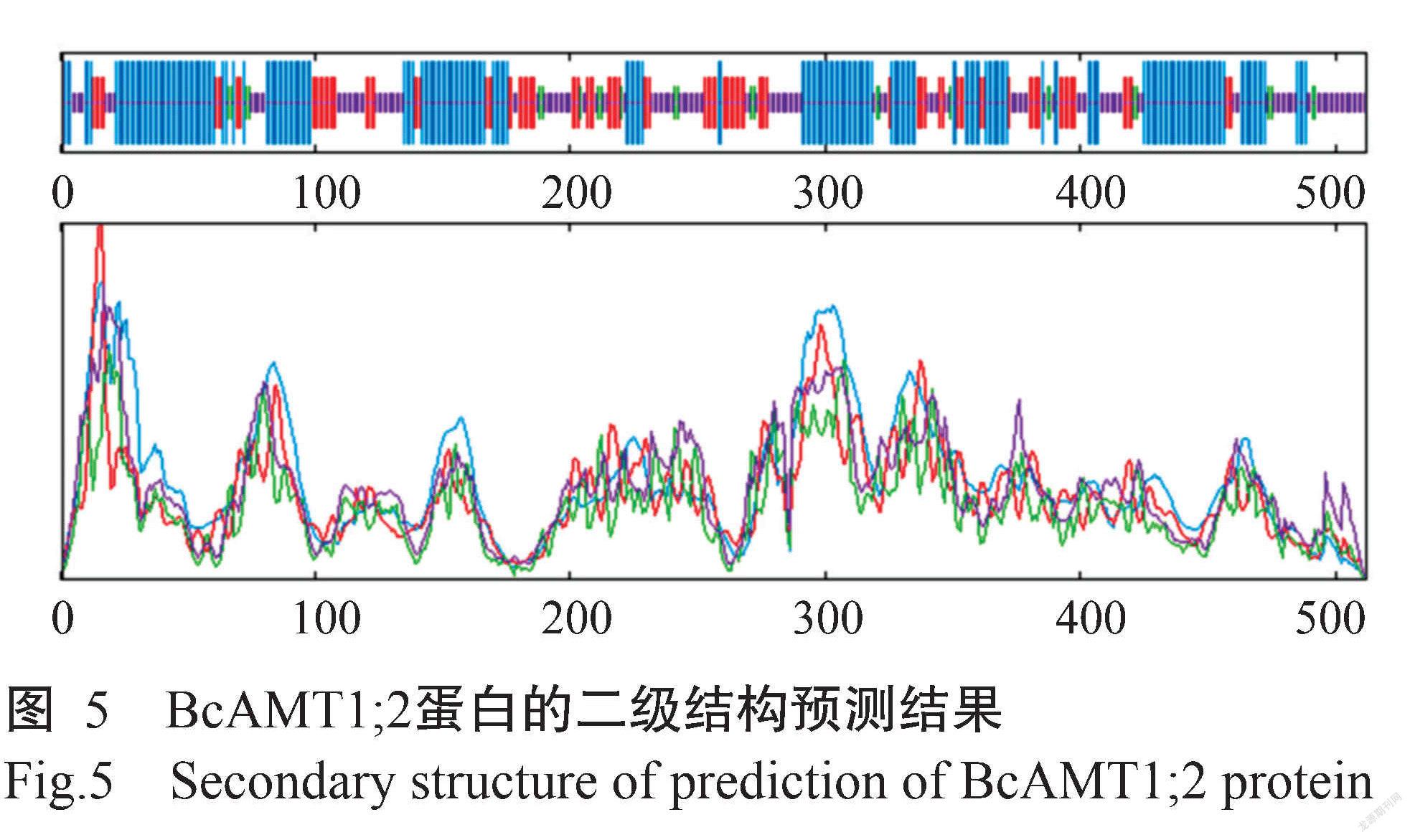
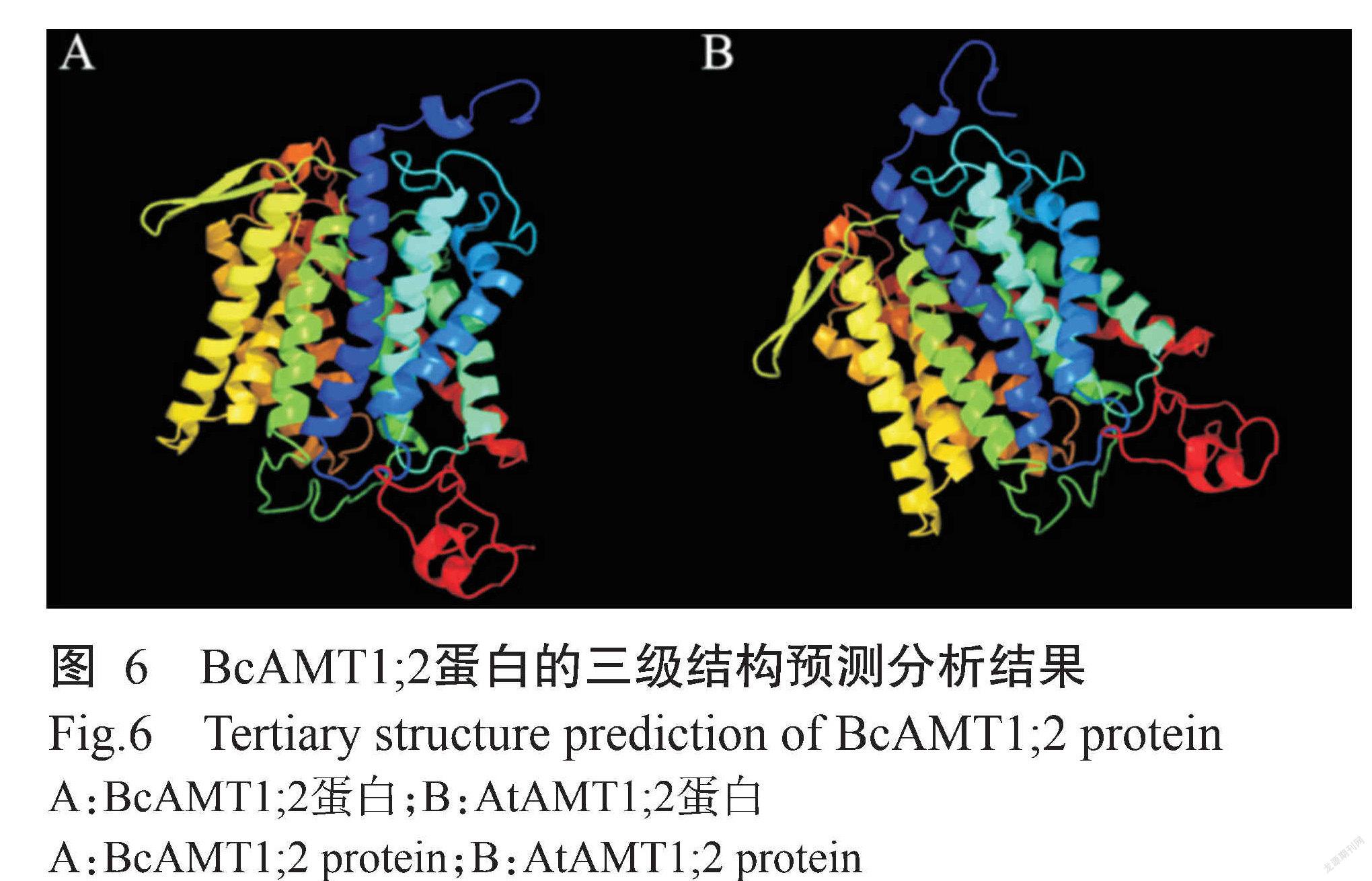
SOPMA预测结果(图5)显示,BcAMT1;2蛋白的二级结构由42.97%的α-螺旋(Alpha helix)、20.51%的β-折叠(Extended strand)、4.88%的β-转角(Beta turn)和31.64%的随机卷曲(Random coil)组成。Phyre2对蛋白三级结构的预测结果(图6)显示,BcAMT1;2蛋白主要部分为α-螺旋,与二级结构的预测结果一致。此外, BcAMT1;2与拟南芥AtAMT1;2的三级结构也较相似(图6),推测两者具有相似的生物学功能。
2. 4 多重比对和系统进化分析
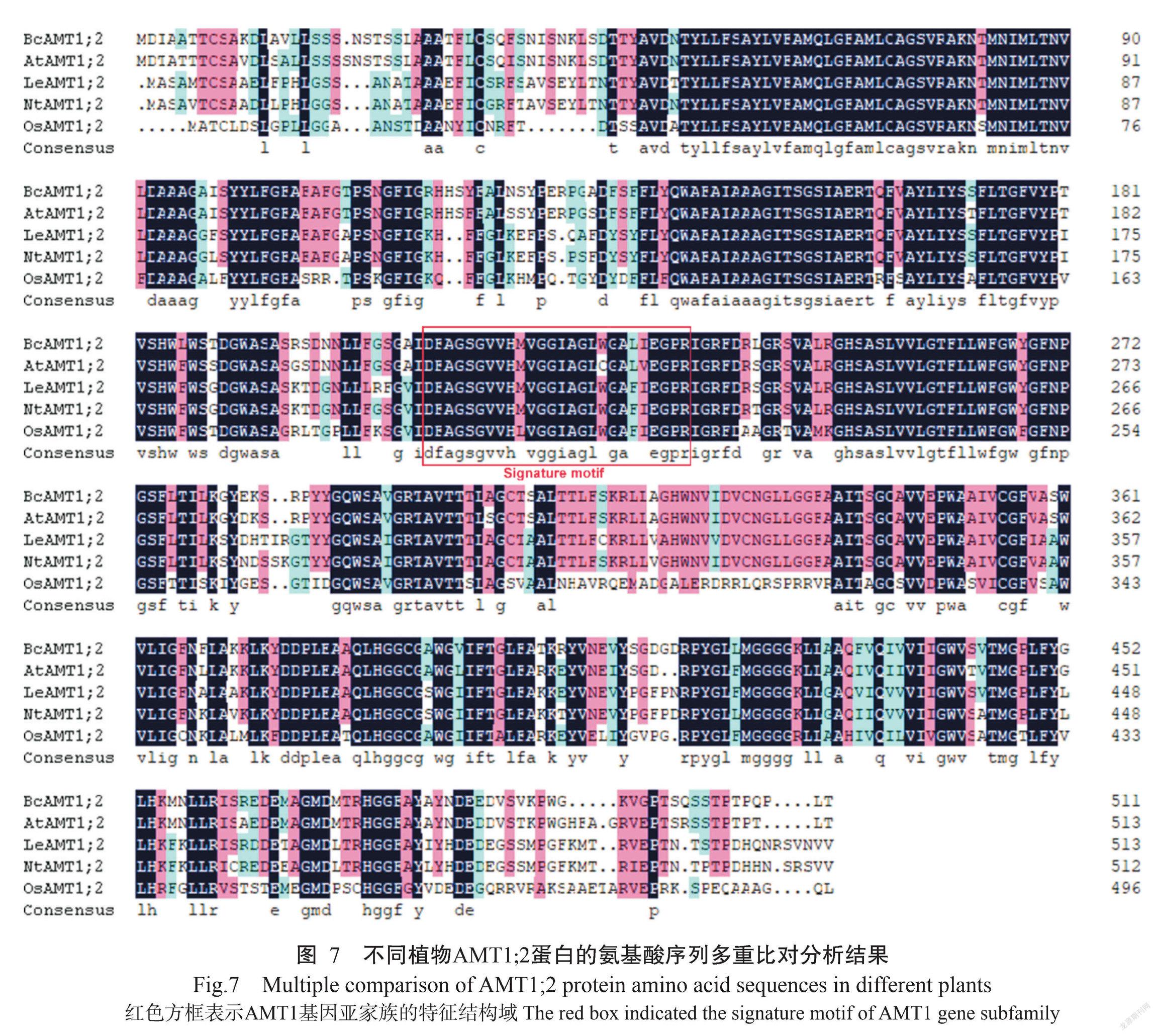
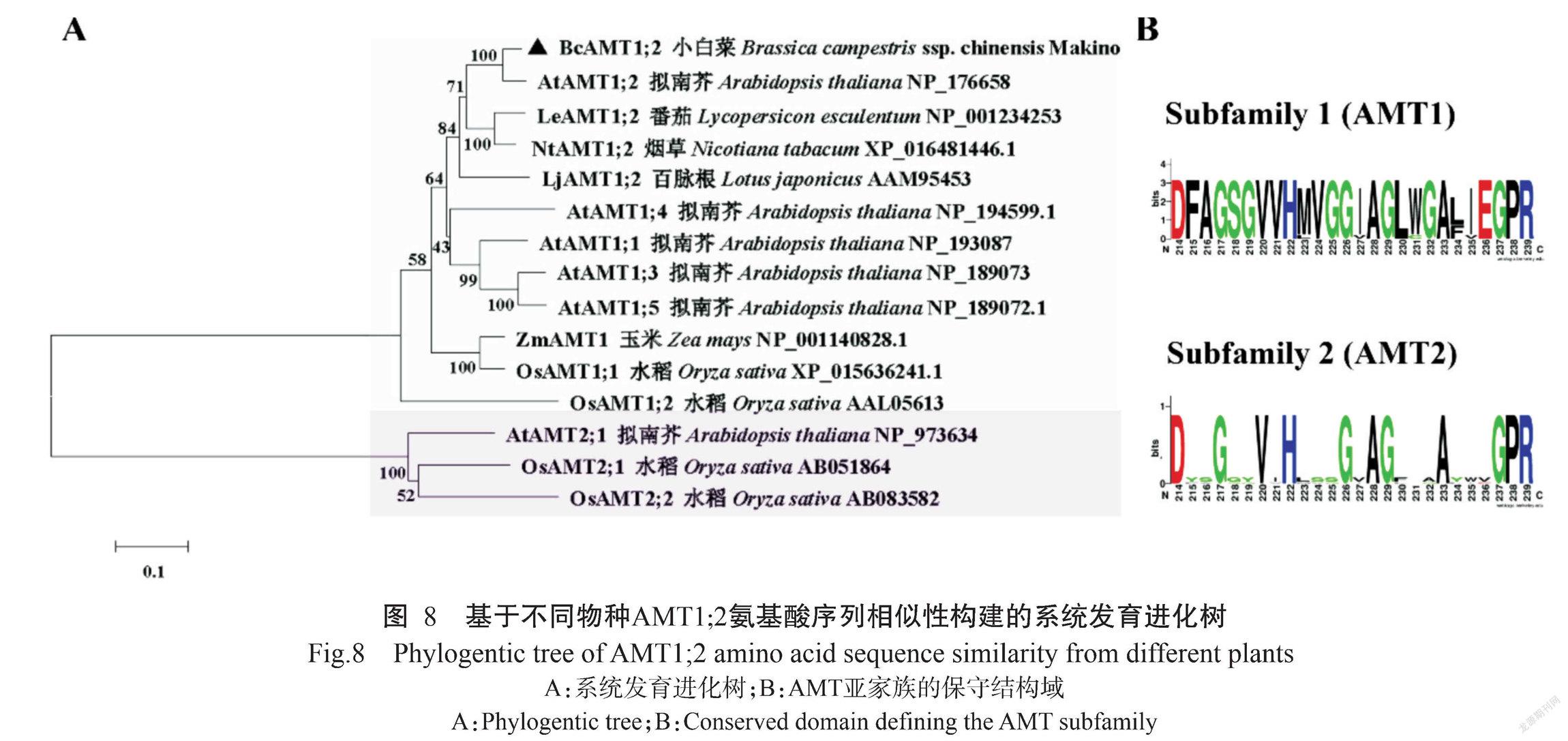
将BcAMT1;2、拟南芥AtAMT1;2、番茄LeAMT1;2、烟草NtAMT1;2和水稻OsAMT1;2进行氨基酸序列多重比对分析,结果如图7所示。BcAMT1;2蛋白与其他植物AMT1;2蛋白均含有保守结构域。基于不同植物AMT1;2氨基酸序列的相似性构建系统发育进化树,结果(图8-A)显示,植物AMT蛋白可分为兩大基因亚家族,即AMT1和AMT2;各类群物种的AMT1或AMT2间的蛋白亲缘关系较近,其中,BcAMT1;2蛋白与同为十字花科植物的拟南芥AtAMT1;2蛋白的亲缘关系最近,二者氨基酸序列的相似性为91.21%。
利用WEBLOGO分别对AMT1和AMT2亚家族成员的氨基酸序列进行分析,结果表明AMT1成员中包含1个保守结构域(D214-F-A-G-S-G-V-V-H-M(L)-V-G-G-I(V)-A-G-L-W(G)-G-A-L(F)-I(V)-E-G-P-R239)、AMT2成员包含另一个保守结构域(D214-Y(F)-S(A/G)-G-G-Y-V-I-H-L(V)-S-S(A)-G-V(I)-A-G-F(L/V)-T(V)-A(T)-A-Y-W-V-G-P-R239)(图8-B),均为AMT特征结构域。
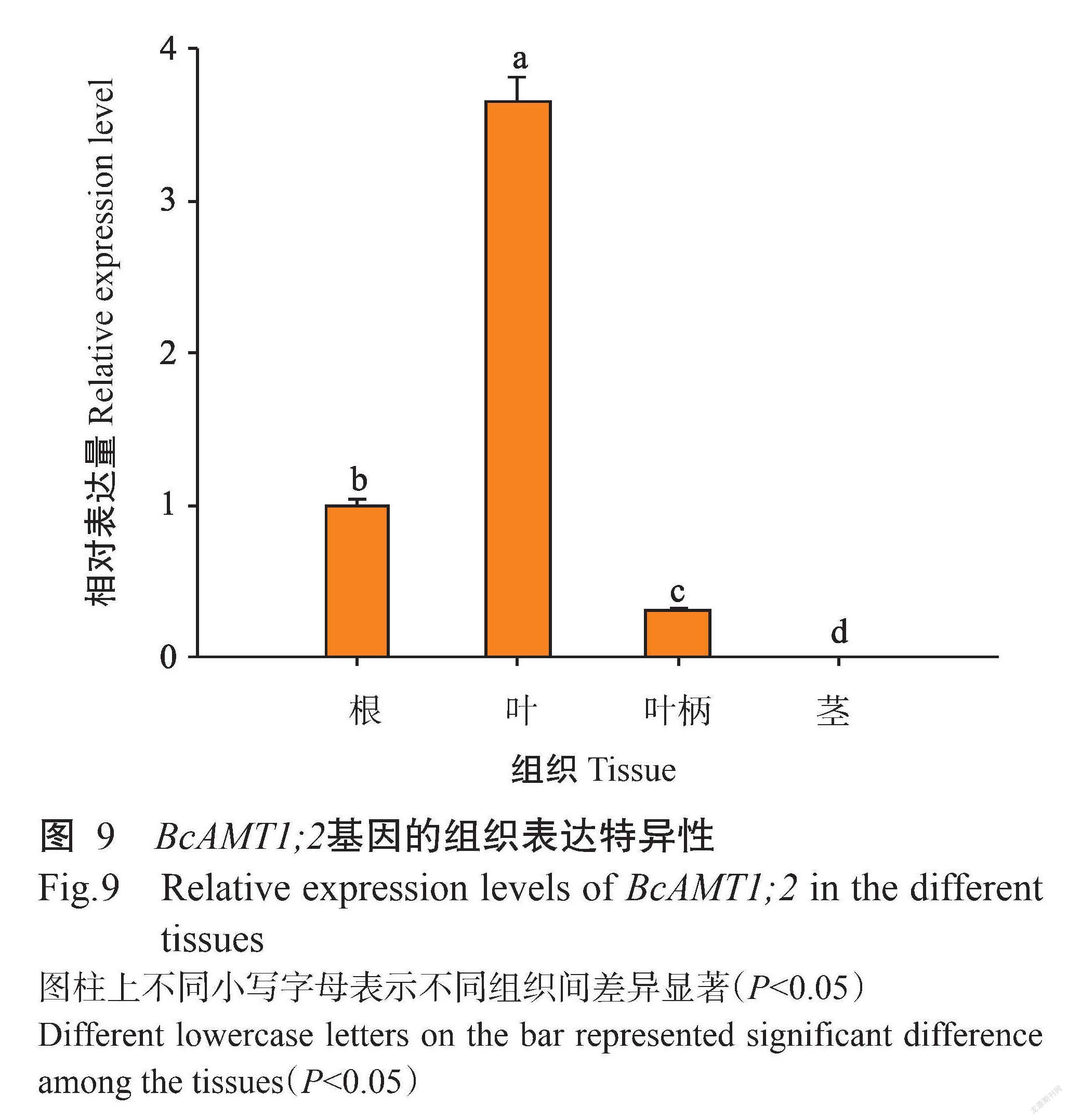
2. 5 BcAMT1;2基因在小白菜不同组织特异性分析
由图9可知,BcAMT1;2基因在小白菜不同组织中均有表达,但其表达水平存在明显差异。BcAMT1;2基因在小白菜叶片中的相对表达量显著高于其他组织(P<0.05,下同),在根中的相对表达量次之,而在茎中几乎不表达,表明BcAMT1;2基因表达具有明显的组织特异性。
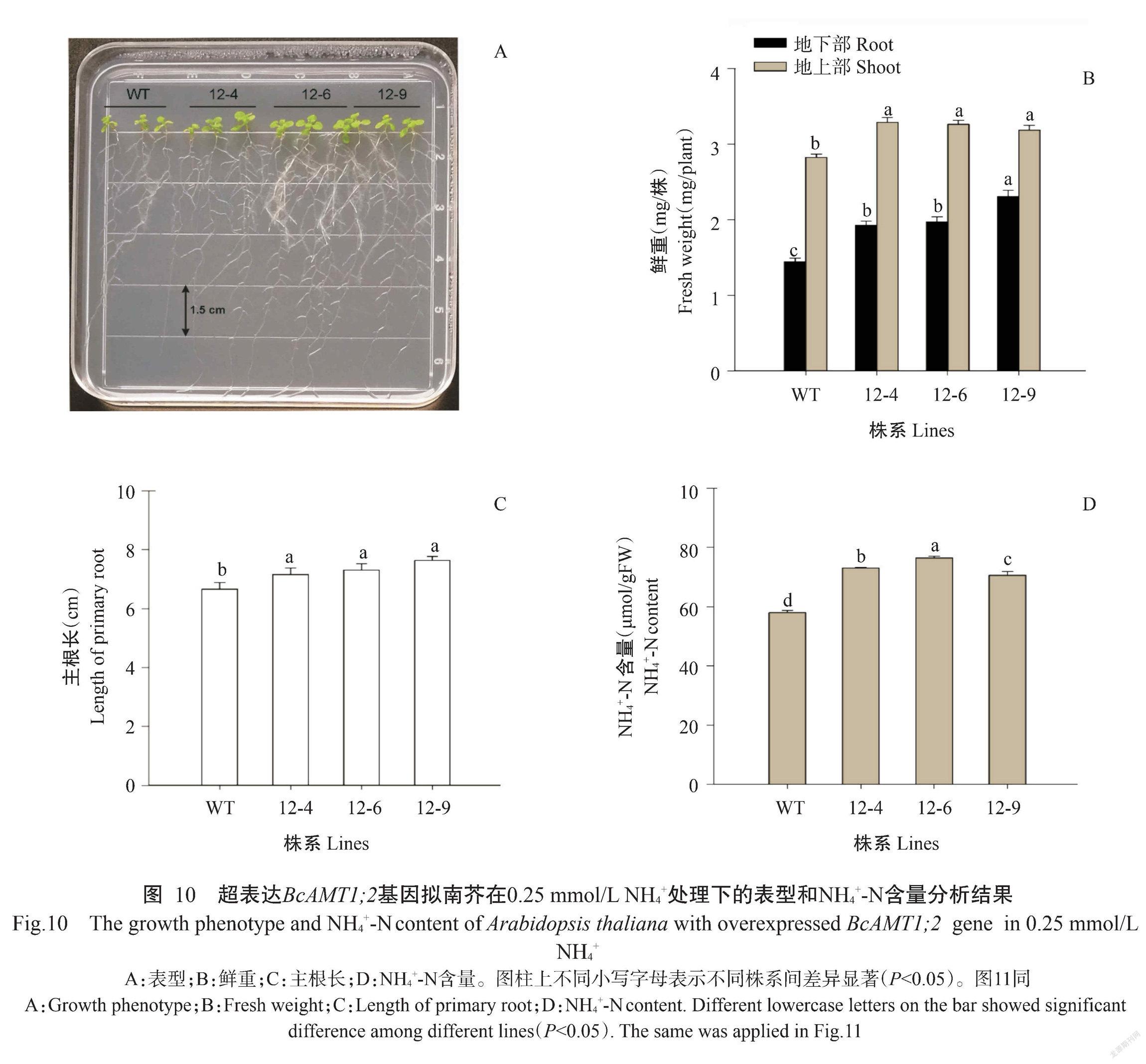
2. 6 BcAMT1;2基因功能验证结果
将BcAMT1;2基因导入农杆菌GV3101后,侵染拟南芥花序,通过筛选获得T2代超表达BcAMT1;2基因拟南芥植株。从图10-A可看出,与野生型(WT)相比,超表达BcAMT1;2基因的3个株系12-4、12-6和12-9的地上部鲜重和地下部鲜重均显著增加,增幅分别为11.3%~16.5%和33.3%~37.3%(图10-A和图10-B),且主根长度和植株内NH4+-N含量也显著增加,增幅分别为7.5%~12.8%和17.9%~32.0%(图10-C和图10-D)。
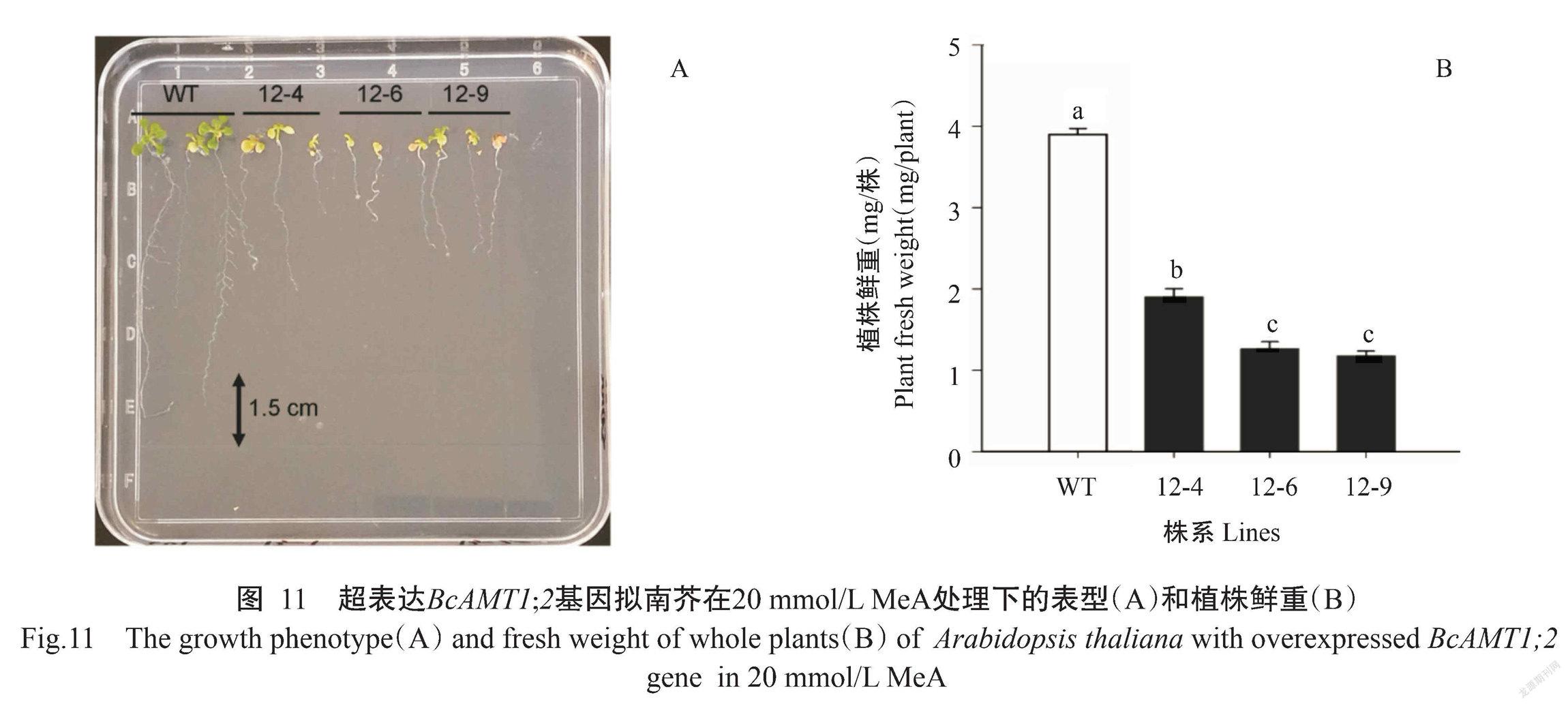
MeA为NH4+的有毒化学类似物,过量吸收可造成细胞死亡(丛郁等,2013)。通过MeA敏感性试验发现,与野生型相比,超表达BcAMT1;2基因的3个株系植株鲜重显著降低(图11-A和图11-B),植株叶片黄化、根系生长受抑等毒害效应,表明超表达BcAMT1;2基因可促进拟南芥对MeA的吸收。
终上所述,拟南芥中超表达BcAMT1;2基因可增加植株体内NH4+-N含量,推测BcAMT1;2与拟南芥AtAMT1;2蛋白在NH4+的吸收和转运过程中具有相似生物学功能(Yuan et al.,2007)。
3 讨论
本研究利用同源克隆方法从小白菜中获得BcAMT1;2基因,cDNA全长序列1539 bp,编码512个氨基酸残基,定位于细胞膜上,符合植物铵转运蛋白为膜蛋白的基本特征(Loqué and Von Wirén,2004;Mcdonald et al.,2012)。BcAMT1;2蛋白具有9个跨膜结构域,与Ye等(2016)报道的AMT蛋白一般包含9~12个跨膜结构域的结论基本一致。AMT1和AMT2基因亚家族分别含有各自的保守结构域,位于第5个或第6个跨膜区上(Saier,1998),保守的特征结构域可用于鉴别其他植物AMT亚家族成员(Couturier et al.,2007),而BcAMT1;2在第5个跨膜区包含“DFAGSGVVHMVGGIAGLWGALIEGPR”,具有植物AMT1亚家族的特征结构域,表明BcAMT1;2属于AMT1亚家族。此外,BcAMT1;2蛋白与拟南芥AtAMT1;2的氨基酸序列相似性最高,为91.21%,且二者具有相似的三级结构,推测BcAMT1;2具有与拟南芥AtAMT1;2蛋白相似的生物学功能。
不同植物AMTs基因在不同组织部位的表达模式不同。拟南芥AtAMT1;2基因在根和叶中均有表达,而AtAMT1;3基因在根系特异表达(Yuan et al.,2007);在八棱海棠中,MrAMT1;1和MrAMT1;3基因在根和叶中均有表达,而MrAMT1;2基因在根系特异表达(Li et al.,2017);CsAMT1;2基因在茶树根部特异表达而在叶片几乎不表达(张文婧等,2020)。本研究结果显示,BcAMT1;2基因在叶片中表达最强,在根中表达次之,而在茎和叶柄中表达微弱。这与番茄(von Wirén et al.,2000)、油菜(Pearson et al.,2002)、拟南芥(Yuan et al.,2007)中的结果相似,推测AMT在叶片中高表达可能与植物氮素循环再利用有关,但与八棱海棠MrAMT1;2基因(Li et al.,2017)、茶树CsAMT1;2基因(张文婧等,2020)的表达特性不同。可见,不同物种AMT同源基因表达特性也存在差异,可能与不同物种的同源基因在适应环境时进化出的不同生理功能有关(Li et al.,2017)。
为进一步验证BcAMT1;2基因的功能,本研究在拟南芥中超表达该基因。在0.25 mmol/L NH4+处理下,与野生型相比,超表达BcAMT1;2基因显著提高拟南芥植株体内NH4+-N含量,且增加主根长度和植株生物量;与野生型相比,超表达BcAMT1;2基因促进拟南芥对铵类似物MeA的吸收。由此可见,本研究克隆的BcAMT1;2基因编码蛋白具有转铵功能。这与Yuan等(2007)、Duan等(2018)的研究结果一致。除NH4+是AMT的转运底物外,NH3也是其转运底物。Neuhäuser和Ludewig(2014)利用电化学技术证明拟南芥AtAMT1;2还具有NH3/H+共转运功能,通过改变NH3和H+转运耦合而影响NH3的转运,在不同H+耦合比例下,AMT/Rh蛋白可能具有通用的NH3转运机制。今后还需通过构建BcAMT1;2超表达或基因敲除的小白菜转基因植株,进一步研究AMT在NH4+/NH3的吸收和转运过程中的作用及分子机制,为研究植物对NH4+/NH3的吸收和转运的调控提供理论参考。
4 結论
BcAMT1;2基因具有明显的组织表达特异性,可调控NH4+及其类似物甲基胺的吸收和转运,表明BcAMT1;2在NH4+的吸收和转运过程中发挥着重要作用。
参考文献:
丛郁,杨顺瑛,金曼,郝东利,苏彦华. 2013. 豆梨铵转运蛋白基因PcAMT1-1和PcAMT1-2的克隆与功能鉴定[J]. 园艺学报,40(11):2115-2126. [Cong Y,Yang S Y,Jin M,Hao D L,Su Y H. 2013. Molecular cloning and function analyses of two ammonium transporter protein genes from Pyrus calleryana[J]. Acta Horticulturae Sinica,40(11):2115-2126.] doi:10.3969/j.issn.0513-353X.2013. 11.002.
李静,张冰玉,苏晓华,沈应柏. 2012. 植物中的铵根及硝酸根转运蛋白研究进展[J]. 南京林业大学学报(自然科学版),36(4):133-139. [Li J,Zhang B Y,Su X H,Shen Y B. 2012. Research progress of ammonium and nitrate transporters in plants[J]. Journal of Nanjing Forestry University(Natural Science Edition),36(4):133-139.]doi:10.3969/j.issn.1000-2006.2012.04.028.
张文婧,林琳,孙威江. 2020. 茶树铵转运蛋白AMT研究进展[J/OL]. 分子植物育种:1-15. http://kns.cnki.net/kcms/detail/46.1068.S.20201203.1024.004.html. [Zhang W J,Lin L,Sun W J. 2020. Advances of ammonium transporter in tea plant(Camellia sinensis (L.) O. Ktze.)[J/OL]. Molecular Plant Breeding:1-15. http://kns.cnki.net/kcms/detail/46.1068.S.20201203.1024.004.html.]
Couturier J,Montanini B,Martin F,Brun A,Blaudez D,Chalot M. 2007. The expanded family of ammonium transporters in the perennial poplar plant[J]. New Phytologist,174(1):137-150. doi:10.1111/j.1469-8137.2007.019 92.x
Duan F Y,Giehl R F,Geldner N,Salt D E,von Wirén N. 2018. Root zone-specific localization of AMTs determines ammonium transport pathways,and nitrogen allocation to shoots[J]. PLoS Biology,16:e2006024. doi:10. 1371/journal.pbio.2006024.
Filiz E,Akbudak M A. 2020. Ammonium transporter 1 (AMT1) gene family in tomato(Solanum lycopersicum L.):Bioinformatics,physiological and expression analyses under drought and salt stresses[J]. Genomics,112(5):3773-3782. doi:10.1016/j.ygeno.2020.04.009.
Gu R L,Duan F Y,An X,Zhang F S,von Wirén N,Yuan L X. 2013. Characterization of AMT-mediated high-affinity ammonium uptake in roots of maize(Zea mays L.)[J]. Plant and Cell Physiology,54(9):1515-1524. doi:10. 1093/pcp/pct099.
Hao D L,Zhou J Y,Yang S Y,Qi W,Yang K J,Su Y H. 2020. Function and regulation of ammonium transporters in plants[J]. International Journal of Molecular Sciences,21(10):3557. doi:10.3390/ijms21103557.
Li H, Yang Q S,Liu W,Lin J,Chang Y H. 2017. The AMT1 family genes from Malus robusta display differential transcription features and ammonium transport abilities[J]. Molecular Biology Reports,44(5):379-390. doi:10.1007/s11033-017-4119-y.
Loqué D,von Wirén N. 2004. Regulatory levels for the transport of ammonium in plant roots[J]. Journal of Experimental Botany,55(401):1293-1305. doi:10.1093/jxb/erh147.
Loqué D,Yuan L,Kojima S,Gojon A,Wirth J,Gazzarrini S,Ishiyama K,Takahashi H,von Wirén N. 2006. Additive contribution of AMT1;1 and AMT1;3 to high-affinity ammonium uptake across the plasma membrane of nitrogen-deficient Arabidopsis roots[J]. Plant Journal,48(4):522-534. doi:10.1111/j.1365-313X.2006.02887.x.
Mcdonald T R,Dietrich F S,Lutzoni F. 2012. Multiple horizontal gene transfers of ammonium transporters/ammonia permeases from prokaryotes to eukaryotes:Toward a new functional and evolutionary classification[J]. Molecular Biology and Evolution,29(1):51-60. doi:org/10.1093/molbev/msr123.
Neuhäuser B,Ludewig U. 2014. Uncoupling of ionic currents from substrate transport in the plant ammonium transpor-ter AtAMT1;2[J]. The Journal of Biological Chemiswtry,289(17):11650-11655. doi:10.1074/jbc.c114.552802.
Pearson J N,Finnemann J,Schjoerring J K. 2002. Regulation of the high-affinity ammonium transporter(BnAMT1;2) in the leaves of Brassica napus by nitrogen status[J]. Plant Molecular Biology,49(5):483-490. doi:10.1023/A:1015549115471.
Saier M H. 1999. Genome archeology leading to the characterization and classification of transport proteins[J]. Current Opinion in Microbiology,2(5):555-561. doi:10.1016/ S1369-5274(99)00016-8.
Socci A M,Templer P H. 2011. Temporal patterns of inorganic nitrogen uptake by mature sugar maple(Acer saccharum Marsh.) and red spruce(Picea rubens Sarg.) trees using two common approaches[J]. Plant Ecology and Diversity,4(2):141-152. doi:10.1080/17550874.2011.624 557.
Song S W,He Z H,Huang X M,Zhong L H,Liu H C,Sun G W,Chen R Y. 2017. Cloning and characterization of the ammonium transporter genes BaAMT1;1 and BaAMT1;3 from Chinese kale[J]. Horticulture,Environment,and Biotechnology,58(2):178-186. doi:10.1007/s13580-017-0168-3.
Sonoda Y,Ikeda A,Saiki S,von Wirén N,Yamaya T,Yamaguchi J. 2003. Distinct expression and function of three ammonium transporter genes(OsAMT1;1-1;3) in rice[J]. Plant and Cell Physiology,44(7):726-734. doi:10.1093/pcp/pcg083.
Straub T,Ludewig U,Neuhäuser B. 2017. The kinase CIPK23 inhibits ammonium transport in Arabidopsis thaliana[J]. The Plant Cell,29(2):409-422. doi:10.1105/tpc.16.00806.
von Wirén N,Lauter F R,Ninnemann O,Gillissen B,Walch-Liu P,Engels C,Jost W,Frommer W B. 2000. Differential regulation of three functional ammonium transporter genes by nitrogen in root hairs and by light in leaves of tomato[J]. Plant Journal,21(2):167-175. doi:10.1046/j. 1365-313x.2000.00665.x.
Xu G H,Takahashi H. 2020. Improving nitrogen use efficiency:From cells to plant systems[J]. Journal of Experimental Botany,71(15):4359-4364. doi:10.1093/jxb/eraa309.
Ye X X,Sun Y J,Liu P P,Lee I. 2016. Evolutionary analysis of AMT(ammonium transporters) family in Arabidopsis thaliana and Oryza sativa[J]. Molecular Soil Biology,7(11):1-7. doi:10.5376/msb.2016.07.0011
Yuan L,Graff L,Loqué D,Kojima S,Tsuchiya Y N,Takahashi H,von Wirén N. 2009. AtAMT1;4,a pollen-speci-fic high-affinity ammonium transporter of the plasma membrane in Arabidopsis[J]. Plant and Cell Physiology,50(1):13-25. doi:10.1093/pcp/pcn186.
Yuan L,Loqué D,Kojima S,Rauch S,Ishiyama K,Inoue E,Takahashi H,von Wirén N. 2007. The organization of high-affinity ammonium uptake in Arabidopsis roots depends on the spatial arrangement and biochemical properties of AMT1-type transporters[J]. The Plant Cell,19(8):2636-2652. doi:10.1105/tpc.107.052134.
收稿日期:2021-02-02
基金项目:广东省自然科学基金项目(2019A1515011680);广东省教育厅项目(2019KTSCX164);韶关学院博士科研启动项目(99000613)
通讯作者:朱云娜(1982-),https://orcid.org/0000-0001-5849-3598,博士,主要從事蔬菜生理与分子生物学研究工作,E-mail:zhuyn326@126.com
第一作者:刘建国(1981-),https://orcid.org/0000-0001-5095-6412,主要从事园艺生理生态研究工作,E-mail:jgliu@sgu.edu.cn
