蓝莓果渣花色苷大孔树脂纯化工艺研究
2021-03-04周剑丽罗配琴邱树毅余晓斌
栾 浩,周剑丽,2,屈 午,邓 丹,罗配琴,邱树毅,余晓斌*
(1.江南大学生物工程学院,江苏 无锡 214122;2.贵州理工学院食品药品制造工程学院,贵州 贵阳 550007;3.贵州茅台(集团)生态农业产业发展有限公司,贵州 丹寨 557500;4.贵州大学酿酒与食品工程学院,贵州 贵阳 550003)
蓝莓是杜鹃花科(Ericaceae)越橘属(Vaccinium)多年生落叶或常绿灌木植物[1],含有极其丰富的天然水溶性色素花色苷[2]。蓝莓不仅可以鲜食,还可以被加工成饮料、果干、果脯、果酒等,生产加工过程中会产生大量的果渣,然而果渣中的花色苷含量很高[3]。花色苷是一种很好的功能性保健物质,具有预防心脏病、抗氧化活性、清除自由基、延缓衰老、抑制癌细胞和抑菌等活性[4-8]。
溶剂法提取蓝莓果渣中花色苷含有糖类、蛋白质、淀粉、有机酸和脂肪等杂质,粗提物保存时间短、纯度低[9],需要对粗提物进一步的纯化。大孔树脂是一类不含交换基团且有大孔结构的高分子吸附树脂[10],具有稳定性强、成本低、操作简单和效率高等优点。因此,本实验选用D101型大孔树脂和AB-8型大孔树脂对蓝莓果渣进行分离纯化,考察了静态试验中吸附时间,样液pH、解吸时间、解吸液pH和乙醇体积分数等和动态试验中上样浓度、上样流速和洗脱流速等对蓝莓果渣花色苷分离纯化效果的影响,从而确定大孔树脂分离纯化蓝莓果渣花色苷的最优工艺条件,为蓝莓果渣花色苷的进一步开发利用提供基础。
1 材料与方法
1.1 材料与试剂
蓝莓果渣:由贵州茅台(集团)生态农业产业发展有限公司提供,经解冻、干燥,粉碎过60目筛处理;D101型大孔树脂、AB-8型大孔树脂:无锡特达生物公司;无水乙醇、磷酸氢二钠、柠檬酸、氢氧化钠、盐酸、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、苯酚、酒石酸钾钠四水合物等(均为分析纯):国药集团化学试剂有限公司;试验用水为蒸馏水。
1.2 仪器与设备
PHS-3C pH计:梅特勒-托利多国际股份有限公司;U-3900紫外可见光分光光度计:日本日立株式会社;CP2102电子天平:奥豪斯仪器有限公司;SHZ-D(Ⅲ)循环水式真空泵:上海东玺制冷仪器设备有限公司;旋转蒸发器RE-52AA:上海亚荣生化仪器厂;BSZ-100自动部分收集器:上海金鹏分析仪器有限公司;synergy H4酶标仪:美国BioTek公司;J-20×PI超高速冷冻离心机:美国Thermo Fisher Scientific公司;Agilent-1260高效液相色谱仪(high performance liquid chromatography,HPLC):美国安捷伦公司
1.3 试验方法
1.3.1 蓝莓果渣花色苷粗提液的制备[11]
蓝莓果渣用体积分数60%的乙醇(盐酸调pH至3)溶解,以料液比1∶15(g/mL)进行提取,放在磁力搅拌器上1000r/min搅拌30 min,然后4 000×g离心10 min,取上清抽滤,45 ℃、100 r/min旋转蒸发除去乙醇得到蓝莓果渣花色苷粗提浓缩液。
1.3.2 大孔树脂的预处理
将两种大孔树脂分别放入烧杯中,加入无水乙醇没过大孔树脂浸泡24 h,使其充分溶胀。将大孔树脂湿法装柱,用蒸馏水冲洗至流出液澄清、无白色浑浊,继续用蒸馏水冲洗至流出液无醇味;将冲洗好的大孔树脂倒入烧杯,加入体积分数4%的盐酸溶液浸泡4 h,装柱用水冲洗至中性;再加入50 g/L氢氧化钠浸泡4 h,装柱用水冲洗至中性;处理好的树脂加水浸泡,备用[12]。
1.3.3 大孔树脂的筛选
分别准确称取2 g大孔树脂AB-8和D101于锥形瓶中,向其中加入50 mL稀释后的蓝莓果渣花色苷提取液,波长520 nm处测定其吸光度值A0,30 ℃条件下振荡吸附24 h,待树脂吸附完全后,过滤,测定其吸光度值A1,计算吸附率[13];向吸附完全的大孔树脂中加入50 mL体积分数60%的乙醇溶液(pH3),30 ℃条件下振荡解吸24 h,过滤,测定其吸光度值A2,计算解吸率[13]。吸附率、解吸率计算公式如下:

1.3.4 大孔树脂纯化条件研究
(1)静态吸附和解吸实验
静态吸附平衡时间的测定:准确称取预处理过的2 g大孔树脂AB-8于锥形瓶中,然后加入50 mL一定质量浓度的蓝莓果渣花色苷提取液,在30 ℃条件下振荡吸附,每隔30 min取1 mL上清液于波长520 nm处测定其吸光度值,绘制静态吸附曲线。
静态解吸平衡时间的测定:准确称取吸附饱和的2 g大孔树脂AB-8于锥形瓶中,然后加入50 mL体积分数60%的乙醇溶液(pH3),在30 ℃条件下振荡解吸,每隔30 min取1 mL上清液于波长520 nm处测定其吸光度值,绘制静态解吸曲线。
蓝莓果渣花色苷提取液pH值对大孔树脂吸附率的影响:用磷酸氢二钠-柠檬酸缓冲液分别配制pH为1、2、3、4、5的蓝莓果渣花色苷提取液,然后分别取50 mL加入盛有2 g大孔树脂AB-8的锥形瓶中,将锥形瓶放在30 ℃条件下振荡吸附6 h,分别取1 mL上清液于波长520 nm处测定其吸光度值,计算吸附率。
解吸液的pH值对大孔树脂解吸率的影响:用磷酸氢二钠-柠檬酸缓冲液分别配制pH为1、2、3、4、5的体积分数60%的乙醇溶液,然后分别取50 mL加入盛有2 g大孔树脂AB-8的锥形瓶中,将锥形瓶放在30 ℃条件下振荡解吸6 h,分别取1 mL上清液于波长520 nm处测定其吸光度值,计算解吸率。
乙醇体积分数对大孔树脂解吸率的影响:准确称取吸附饱和的2 g大孔树脂AB-8于锥形瓶中,向其中分别加入50 mL不同体积分数的乙醇溶液(pH3),在30 ℃条件下振荡解吸6 h,分别取样1 mL上清液于波长520 nm处测定其吸光度值,计算解吸率。
(2)动态吸附和解吸实验
上样浓度对大孔树脂吸附率的影响:称取预处理过的10 g大孔树脂AB-8,湿法装入层析柱中,分别加入质量浓度为0.5 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL、2.5 mg/mL、3.0 mg/mL的花色苷提取液(pH3),测定初始吸光度值A0。将不同浓度的花色苷提取液以1.0 mL/min的流速流过树脂,测定流出液的吸光度值A1,计算吸附率。
上样流速对大孔树脂吸附率的影响:称取预处理过的10 g大孔树脂AB-8,湿法装入层析柱中,取1 mg/mL的花色苷提取液(pH3),测定初始吸光度值A0。分别以0.5 mL/min、1.0 mL/min、1.5 mL/min、2.0 mL/min、3.0 mL/min流速流过树脂,测定流出溶液的吸光度值A1,计算吸附率。
泄露曲线的测定:称取预处理过的10 g大孔树脂AB-8,湿法装入层析柱中,加入1 mg/mL的花色苷提取液(pH3)200 mL,以1 mL/min流过树脂,每10 mL收集一次流出液测定吸光度值,当流出液吸光度值达到上样溶液的1/10时认为花色苷溶液开始透出[14],停止上样,绘制泄露曲线。
洗脱流速对大孔树脂解吸率的影响:称取预处理过的10 g大孔树脂AB-8,湿法装入层析柱中,加入1 mg/mL的花色苷提取液(pH3),以1 mL/min流过树脂,使树脂吸附饱和。吸附饱和后的树脂用蒸馏水清洗[15],然后加入体积分数60%的乙醇溶液(pH3),以0.5 mL/min、1.0 mL/min、1.5 mL/min、2.0 mL/min、3.0 mL/min流速流过树脂进行解吸,测定流出液的吸光度值,计算解吸率。
解吸曲线的测定:称取预处理过的10 g大孔树脂AB-8,湿法装入层析柱中,加入1 mg/mL花色苷提取液(pH3),以1 mL/min流过树脂,使树脂吸附饱和。吸附饱和后的树脂用蒸馏水清洗残留的杂质,然后加入体积分数60%的乙醇溶液(pH3)200 mL,以1 mL/min流过树脂进行解吸,每5 mL收集一次流出液测定吸光度值,绘制解吸曲线。
1.3.5 分析检测
(1)色价的测定
根据国标GB 25536—2010《食品添加剂萝卜红》[16]略作改动测定花色苷的色价。称取0.5 g试样(精确至0.000 1 g),用柠檬酸-磷酸氢二钠缓冲液(pH3)溶解,转移至100 mL容量瓶中,加入柠檬酸-磷酸氢二钠缓冲液(pH3)定容至刻度,摇匀,取样品溶液于1 cm比色皿中在波长520 nm处测定吸光度值并计算色价,其计算公式如下:

式中:A为试样溶液的吸光度值;c为被测样品溶液质量浓度(g/mL);100为质量浓度换算系数(对应色价规定换算成试样质量浓度为1 g/100 mL)。
(2)花色苷的测定
样品处理:分别称取纯化前后花色苷冻干粉1 mg溶于磷酸氢二钠-柠檬酸缓冲液中,过0.45 μm微孔滤膜进行HPLC检测。检测条件[17]:Agilent 20RBAX-SB C18液相柱(4.6 mm×150 mm×5 μm),检测波长520 nm,流速0.9 mL/min,进样体积10 μL,柱温25 ℃。流动相A为甲醇,流动相B为3%甲酸溶液。梯度洗脱程序如下:0~15 min,5%→25%A;15~25 min,25%→32%A;25~35 min,32%→60%A;35~45 min,60%→80%A;45~55 min,80%→100%A。根据样品的出峰时间定性,并计算峰面积。
(3)糖和蛋白质含量的测定
可溶性糖含量的测定[18-19]:采用3,5-二硝基水杨酸法(DNS)测定;蛋白质含量的测定[20]:考马斯亮蓝G-250法。
1.3.6 数据处理
试验数据采用SPSS 26.0进行处理,实验重复测定3次,结果以“平均值±标准差”表示;采用Origin 2018进行绘图。
2 结果与分析
2.1 大孔树脂的筛选
花色苷含有较多酚羟基和糖苷链,有一定的极性和亲水性,易被极性和弱极性的树脂吸附,同时树脂的吸附能力在平均孔径相差不大的情况下,比表面积越大吸附能力越强[21-22]。由表1可知,AB-8型大孔树脂吸附率和解吸率分别为88.5%、64.7%,稍优于D101型大孔树脂。所以选取AB-8型大孔树脂进行下一步研究。

表1 不同大孔树脂的吸附率和解吸率Table 1 Adsorption and desorption rates of different macroporous resins
2.2 静态吸附和解吸实验
2.2.1 吸附平衡时间的确定
由图1可知,AB-8型大孔树脂对蓝莓果渣花色苷粗提取液的吸附率随时间延长迅速增加,在4h时吸附率基本达到最大,吸附时间继续延长,大孔树脂对蓝莓果渣提取液的吸附基本饱和,处于动态平衡。所以,静态吸附的饱和时间为4 h。

图1 蓝莓果渣花色苷静态吸附平衡曲线Fig. 1 Static adsorption equilibrium curve of anthocyanins from blueberry pomace
2.2.2 解吸平衡时间的确定
由图2可知,AB-8型大孔树脂对蓝莓果渣花色苷提取液的解吸率随时间延长迅速增加,在4 h时解吸率基本达到最大(59%),随着时间的延长,解吸率维持动态平衡,基本稳定。在4 h和6 h的解吸率相差不大。所以,静态解吸的时间为4 h。

图2 蓝莓果渣花色苷静态解吸平衡曲线Fig. 2 Static desorption equilibrium curve of anthocyanins from blueberry pomace
2.2.3 蓝莓果渣花色苷提取液pH值对大孔树脂吸附率的影响
由图3可知,大孔树脂的吸附率随着蓝莓果渣花色苷提取液pH的升高而降低,这可能是因为花色苷在不同pH下存在的4种结构形式比例不相同所导致的[23]。在pH1、pH2和pH3时花色苷提取液吸附率相差不大,而pH1和pH2时花色苷的糖基容易水解,造成花色苷稳定性降低[24]。当pH为3时,样品吸附率为83.6%。所以,选择花色苷提取液pH为3。

图3 蓝莓果渣花色苷提取液pH对大孔树脂吸附率的影响Fig. 3 Effects of pH of anthocyanins extracts from blueberry pomace on the adsorption rate of macroporous resin
2.2.4 解吸液的pH值对大孔树脂解吸率的影响
由图4可知,解吸液的pH值对花色苷溶液的解吸影响较大,随着pH的升高,花色苷的解吸率降低。pH1、pH2和pH3时,花色苷提取液解吸率差异不显著(P>0.05),而pH1和pH2时,花色苷的糖基容易水解,造成花色苷稳定性降低[24]。所以,选择解吸液pH为3。

图4 解吸液pH对大孔树脂解吸率的影响Fig. 4 Effects of pH of desorption solution on desorption rate of macroporous resin
2.2.5 乙醇体积分数对大孔树脂解吸率的影响
由图5可知,大孔树脂对花色苷提取液的解吸能力随着乙醇体积分数的增大,解吸率先增加后减少,乙醇体积分数为60%时解吸率最高(72.6%)。如果乙醇体积分数≤60%,树脂中的花色苷则不能被完全洗脱出来;如果乙醇体积分数>60%,不仅造成浪费而且会有更多的杂质被洗脱下来,影响花色苷的纯度[25-26]。所以,选择乙醇体积分数为60%。

图5 乙醇体积分数对大孔树脂解吸率的影响Fig. 5 Effects of ethanol volume fraction on desorption rate of macroporous resin
2.3 动态吸附和解吸实验
2.3.1 上样质量浓度对大孔树脂吸附率的影响
由图6可知,随着花色苷浓度的增大,AB-8型大孔树脂的吸附率先增加后减小,当上样质量浓度为1 mg/mL时,吸附率达到最大(82.3%)。当花色苷浓度较低时,大孔树脂吸附时间增加,从而降低纯化效率;而花色苷浓度过高时,会增加杂质的吸附率,导致样液过早泄露,降低大孔树脂的吸附效果。所以,选择最佳上样质量浓度为1 mg/mL。

图6 上样质量浓度对大孔树脂吸附率的影响Fig. 6 Effects of loading mass concentration on adsorption rate of macroporous resin
2.3.2 上样流速对大孔树脂吸附率的影响由图7可知,随着上样流速的增大,花色苷的吸附率先增加后减小,在上样流速为1 mL/min时,花色苷的吸附率

图7 上样流速对大孔树脂吸附率的影响Fig.7 Effects of loading flow rate on adsorption rate of macroporous resin
达到最大(83%)。当上样流速过快时,缩短了花色苷溶液与大孔树脂表面的接触时间,不能充分的进行吸附;上样流速过慢时,增加了吸附时间,降低吸附效率[21]。所以,选择最佳上样流速为1 mL/min。
2.3.3 泄露曲线的测定
由图8可知,初始流出液中不含花色苷,随着上样体积的不断增加,吸光度值也不断增大,大孔树脂慢慢吸附饱和,流出液中花色苷含量增加。一般认为当流出液的吸光度值达到或超过上样溶液吸光度值的1/10时,即认为大孔树脂吸附饱和,发生泄露。蓝莓果渣提取液吸光度值为3.80,当蓝莓果渣提取液上样体积达到140 mL时,流出液的吸光度值为0.38,流出液的吸光度值达到了上样溶液吸光度值的1/10,上样体积应不超过140 mL为宜。
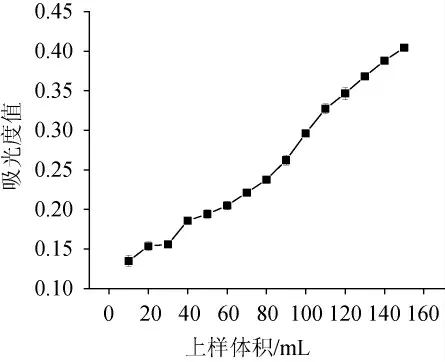
图8 吸附泄露曲线Fig. 8 Adsorption leakage curve
2.3.4 洗脱流速对大孔树脂解吸率的影响
由图9可知,随着洗脱流速的增加,花色苷的解吸率减少。洗脱流速越快,解吸液与大孔树脂接触的时间越短,不能充分的洗脱下来,解吸效果不好;在低流速时,解吸液与大孔树脂充分接触,使花色苷从树脂中洗脱出来,所以解吸率比较高[21]。在0.5 mL/min和1.0 mL/min流速下,解吸率变化不明显。所以,选择最佳洗脱流速为1.0 mL/min。

图9 洗脱流速对大孔树脂解吸率的影响Fig. 9 Effect of elution flow rate on desorption rate of macroporous resin
2.3.5 解吸曲线的测定
由图10可知,随着解吸液体积的不断增加,流出液吸光度值迅速升高然后慢慢降低。当解吸液体积达到5 mL时,流出液吸光度值慢慢增大,花色苷开始逐渐从树脂中洗脱下来;当解吸液体积达到10 mL时,达到洗脱高峰,继续增加解吸液体积,流出液吸光度值逐渐降低,流出液中花色苷含量降低。解吸液体积60 mL时,流出液中几乎不含花色苷。所以,选择解吸液体积为60 mL。

图10 蓝莓果渣花色苷提取液动态解吸曲线Fig.10 Dynamic desorption curve of anthocyanins from blueberry pomace
2.4 纯化前后色价比较
经过大孔树脂纯化后的蓝莓果渣花色苷色价为31.18,约为原蓝莓果渣花色苷色价(10.5)的3倍;溶液颜色由纯化前的红色变成纯化后的紫黑色;冻干后的粉末由最初的粘稠状黑色固体变成了纯化后的紫黑色粉末。说明AB-8型大孔树脂对蓝莓果渣花色苷纯化效果明显。
2.5 HPLC分析纯化前后蓝莓果渣花色苷提取物
由图11及表3可知,相同干质量的纯化前和纯化后的蓝莓果渣花色苷粉末相比,纯化前后蓝莓果渣花色苷都检测出13个峰,与孙倩怡等[27]利用HPLC检测出纯化前后蓝莓花青素有13个峰的研究结果一致。纯化后花色苷样品中代表不同花色苷的各个峰的峰面积较纯化前有大幅增加,约为纯化前的3倍,而总峰面积为纯化前的3.15倍。说明经大孔树脂纯化后花色苷的纯度有较大的提升。
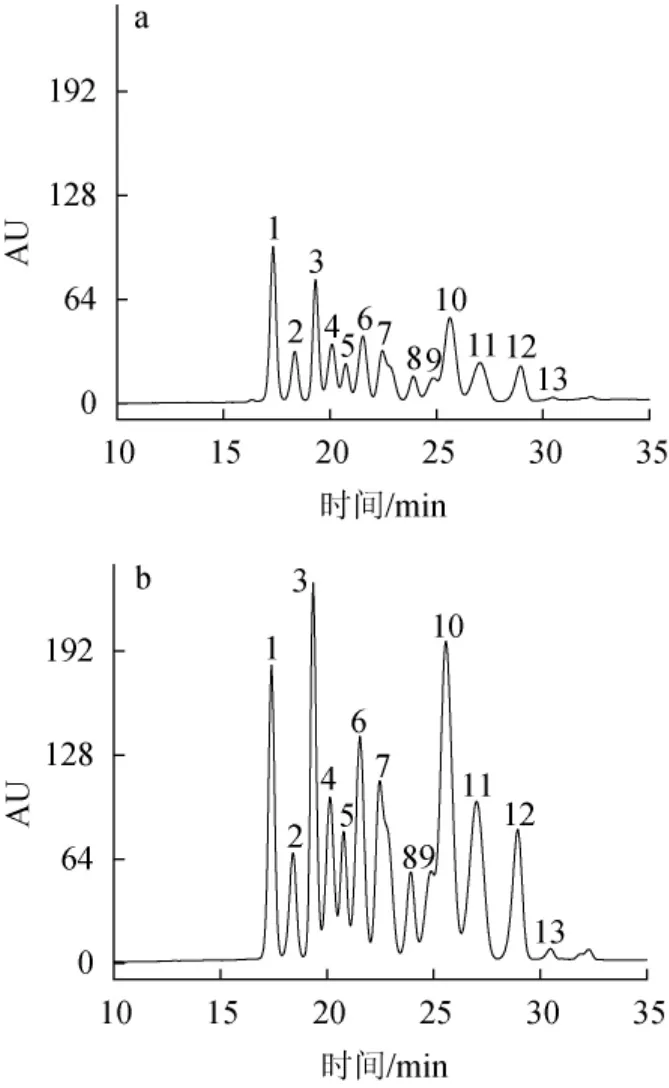
图11 纯化前(a)、后(b)蓝莓果渣花色苷HPLC图Fig. 11 HPLC chromatogram of anthocyanins from blueberry pomace before (a) and after (b) purification
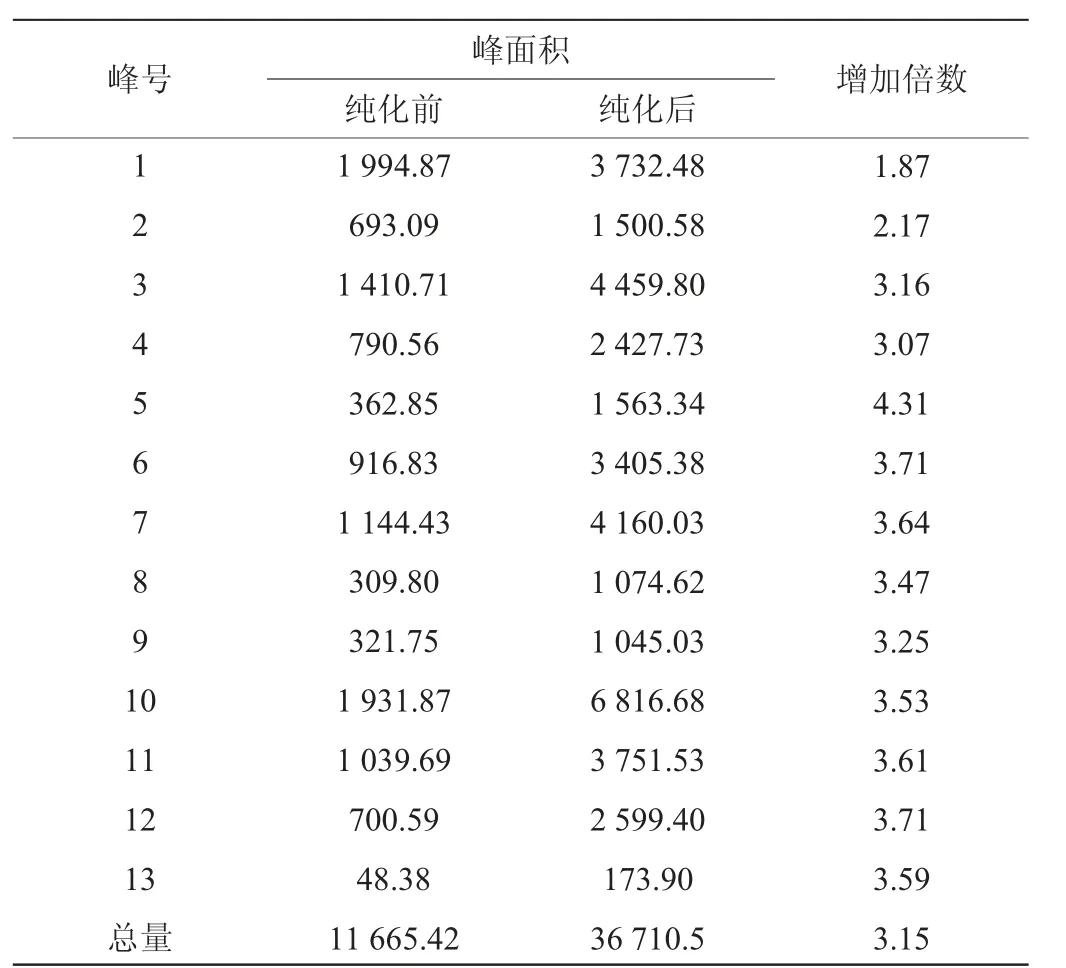
表3 蓝莓果渣花色苷HPLC图分析结果Table 3 HPLC chromatogram analysis results of anthocyanins from blueberry pomace
2.6 大孔树脂纯化前后糖和蛋白含量的测定
蓝莓果渣经酸化乙醇提取后,提取液中不仅有花色苷,还有一些糖类和蛋白质等也被提取出来,这些物质影响花色苷的进一步利用[15]。经过大孔树脂纯化后,纯化前,可溶性糖和蛋白质含量分别为0.28 mg/mL、1.66 mg/mL,纯化后,可溶性糖和蛋白质含量分别为0.19 mg/mL、1.58 mg/mL。这在一定程度上能降低纯化后花色苷粉末的吸湿性,利于储存。
3 结论
通过对两种不同类型大孔树脂的吸附和解吸效果试验,结果表明,AB-8型大孔树脂吸附率和解吸率都优于D101型大孔树脂,该树脂适用于蓝莓果渣花色苷的分离纯化。通过静态吸附和解吸试验确定的最优条件:吸附平衡时间4 h,解吸平衡时间4 h,花色苷溶液pH 3.0,解吸液pH 3.0,解吸液乙醇体积分数60%;动态吸附和解吸试验确定最优条件:上样质量浓度1 mg/mL,上样流速1 mL/min,洗脱流速1 mL/min。纯化后蓝莓果渣花色苷的色价约为纯化前的3倍,糖和蛋白质含量比纯化前都有减少,花色苷冷冻干燥粉末由纯化前黑色粘稠状固体变成纯化后紫黑色粉末,纯化效果明显,为蓝莓果渣花色苷后续产品开发提供依据。
