果蔬酵素中优良酵母菌的分离、鉴定及耐受性研究
2021-03-04韦玉梅张文倩朱闪闪雷勇辉孙燕飞
韦玉梅,张文倩,朱闪闪,李 杨,雷勇辉,孙燕飞*
(1.石河子大学生命科学学院,新疆 石河子 832003;2.石河子大学农学院,新疆 石河子 832003)
果蔬酵素是以水果和蔬菜为原料,经过酵母菌、乳酸菌等多种有益菌发酵制得的含有特定生物活性成分食用的酵素产品[1-2]。酵母菌的营养价值很高,含有较多的蛋白质、B族维生素和矿物质,其在酵素发酵过程中不仅能够改善原料基质原有的一些不良风味,而且可以产生一些酚酸、抗氧化物质和次生代谢产物等有益成分,以增加酵素产品的功能性[3-4]。近年来,为了提高发酵效率,从果蔬自然发酵液中分离优势菌种成为了研究热点。
优势菌株的获取手段主要为自然筛选、诱变育种、紫外线诱变、自然驯化和基因工程育种[5]。其中自然筛选法最常用,因为筛选环境与酵素发酵的环境类似,筛选出的酵母菌往往性能较好,符合发酵的一些特性[6]。刘贞等[7]从传统发酵的米糕中筛选出具有高发酵性能的1株酵母菌和1株乳酸菌;管庆林等[8]研究发现,从番茄发酵液中分离的3株库德毕赤酵母(Pichia kudriavzevii)中,菌株TY-1和TY-3对葡萄糖和酒精具有一定的耐受性,且这些菌株对番茄酵素的口感和质量提升有重要的作用;沙如意等[9]从葡萄酵素、青梅酵素、火龙果酵素中分离到3种优势酵母菌,且均具有耐低pH和耐高糖特性;肖梦月等[10]从自然发酵拐枣果蔬酵素中筛选出1株酿酒酵母(Saccharomyces cerevisiae)和1株植物乳杆菌(Lactobacillus plantarum),并将其应用于拐枣复合酵素,结果表明,该菌株可以去除拐枣的涩味,增加其酸甜感,提高多酚和黄酮类物质含量。
天然果蔬酵素优势菌株的筛选对于发酵工艺优化、功能成分代谢和产品质量等方面具有重要意义。因此,本研究采用传统培养分离技术从自然发酵的果蔬酵素中分离酵母菌,通过高糖、乙醇耐受性研究从中筛选优良酵母菌,通过形态观察、生理生化及分子生物学技术对其进行菌种鉴定,并对其低pH、高糖、乙醇和温度耐受性进行分析,为酵素发酵过程的探索和工业生产提供高质量的菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
新鲜无病害且果实饱满、色泽均匀的土豆、豆芽、香蕉和胡萝卜:石河子市金马市场;白砂糖(食品级):南宁市碧盈食品厂。
1.1.2 试剂
Tris-HCl(1 mol/L):上海申能博彩生物科技有限公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(分析纯):国药集团化学试剂有限公司;Tris平衡酚(纯度98%)、蛋白酶K(33.5 U/mg):德国默克公司;氯仿(纯度99%):天津市化学试剂厂;异戊醇(纯度98.5%):天津市化学试剂厂;十二烷基硫酸钠(sodium dodecyl sulfate,SDS):美国sigma公司;NaCl(分析纯):天津博迪化工股份有限公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、DL2000脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:天根生物化学科技有限公司;引物ITS1、ITS4:上海生工生物技术有限公司;琼脂糖(生化试剂):北京欣兴唐生物科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基[11]:将土豆去皮切块,称取200 g煮10~20 min,用干净纱布过滤,随后加入葡萄糖20 g,琼脂20 g,蒸馏水定容至1 L,pH自然。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[12]:葡萄糖20 g,酵母膏10 g,蛋白胨20 g,蒸馏水定容至1 L,pH 6.0。固体培养基添加20 g琼脂粉。
WL营养琼脂培养基[13]:葡萄糖50 g,琼脂20 g,酵母浸粉4 g,蛋白胨5 g,磷酸二氢钾0.55 g,氯化钾0.425 g,硫酸镁0.125 g,氯化钙0.125 g,溴甲酚绿0.022 g,氯化铁0.002 5 g,硫酸锰0.002 5 g,蒸馏水定容至1 L,pH 6.5。
以上培养基均在115 ℃灭菌30 min。
1.2 仪器与设备
SW-CJ型超净工作台:苏州净化设备有限公司;DNP-9272电热恒温培养箱:上海精宏实验设备有限公司;ZHWY-100B摇床:上海智城分析仪器制造有限公司;M1-L213B白色微波炉:广东美的厨房电器制造有限公司;V8旋涡混匀器:美国Essenscien公司;SMZ800N体视显微镜:尼康映像仪器销售(中国)有限公司;Imager.M2荧光显微镜:卡尔·蔡司股份公司;ProFlexTM3×32-well PCP System仪:美国Thermo Fisher公司。
1.3 方法
1.3.1 果蔬酵素的制备
采用新鲜土豆、豆芽、香蕉、胡萝卜为原料,果蔬、白砂糖、水按质量比3∶1∶10混合后置于1 000 mL已灭菌的玻璃瓶中,室温发酵28 d,每天早晚各搅拌通风一次[8,14-15]。
1.3.2 酵母菌的分离
取果蔬酵素,经10倍梯度稀释,取稀释度为10-3的稀释液100 μL涂布于PDA培养基上,于28 ℃培养2~4 d;挑取不同形态的单菌落,在PDA培养基平板上划线分离纯化,重复3次,挑取单菌落进行镜检,将纯化好的菌株放于4 ℃下保存备用。
1.3.3 优良酵母菌的筛选
高糖耐受性:将纯化好的各菌株分别接种于含不同质量浓度葡萄糖(200 g/L、350 g/L、500 g/L、650 g/L、800 g/L)、不同体积分数乙醇(6%、9%、12%、15%、18%)的YPD培养基中,于28 ℃恒温培养箱中培养,一周后观察菌落生长情况并进行统计,每株菌重复接种3次,以酵母菌在YPD培养基上的生长情况反映其对高糖和乙醇的耐受性,筛选耐受性较好的优良菌株。
1.3.4 酵母菌的鉴定
形态观察:观察分离菌株的菌落形态及细胞形态特征[16]。
生理生化试验:参考文献[9,17-19]进行糖发酵试验、碳源同化试验、氮源同化试验、最高生长温度试验、无维生素培养基上的生长试验。
分子生物学鉴定:采用十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)法提取酵母菌菌株基因组DNA[20]。利用真菌通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对酵母5.8S-ITS序列进行PCR扩增[21-22]。PCR扩增体系:DNA模板1 μL、ITS1和ITS4各1 μL、2×TaqPCR Master Mix 10 μL、双蒸水(ddH2O)补充至25 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,循环30次;72 ℃再延伸10 min,4 ℃保存。将PCR扩增产物委托生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索,选取同源性较高的模式菌株的5.8S-ITS序列,通过MEGA6.0软件中的邻接(Neighbor-Joining,NJ)法构建系统进化树。
1.3.5 优良酵母菌的耐受性试验
种子液的制备:将筛选得到的优良酵母菌划线接种于PDA固体培养基,28 ℃条件下活化培养24 h后,挑取单菌落接种于YPD液体培养基中,28 ℃、150 r/min条件下摇床培养24 h作为种子液,备用。
低pH耐受性:按3%(V/V)的接种量将种子液接种于pH值分别为1.5、2.0、2.5、3.0、3.5的YPD液体培养基中,28 ℃、150 r/min条件下培养120 h,每隔12 h 取一次样,在波长600 nm处测定吸光度值(OD600nm值),以培养时间(x)为横坐标,OD600nm值(y)为纵坐标,绘制菌株的生长曲线[9,16]。
葡萄糖耐受性:将活化好的菌液按3%(V/V)的接种量,接种于葡萄糖含量分别为300 g/L、450 g/L、600 g/L、750 g/L、900 g/L的YPD液体培养基(pH 5.0),28 ℃、150 r/min条件下培养120 h,每隔12 h取一次样,在波长600 nm处测定吸光度值(OD600nm值),绘制菌株的生长曲线。
乙醇耐受性试验:采用杜氏管发酵法测定[7]。高压灭菌后含有杜氏小管的试管中加入YPD液体培养基,再按8%、10%、12%、14%和16%的体积分数加入无水乙醇,把活化后的酵母菌接入试管内,一定时间内观察菌株的产气速度和产气量。
温度耐受性试验:通过菌落生长观察法测定[23]。将酵母菌接种于YPD固体培养基,于不同的温度(20 ℃、25 ℃、30 ℃、35 ℃、37 ℃和42 ℃)条件下培养5 d,观察菌落生长情况。
1.3.6 数据处理
采用Excel 2016、Origin 9.0软件进行数据处理分析,采用SPSS 25.0软件对数据进行单因素方差分析,采用MEGA 6.0软件构建系统发育树,每组试验重复3次。
2 结果与分析
2.1 自然发酵果蔬酵素中酵母菌的分离纯化
采用传统培养分离技术从自然发酵的果蔬酵素中共分离到6株酵母菌。
2.2 优良酵母菌的筛选
2.2.1 高糖耐受性
6株酵母菌的高糖耐受性见表1。由表1可知,6株酵母菌均能在葡萄糖质量浓度为200~650 g/L的YPD培养基上生长。除菌株5-1-1和2-1-2外,其余菌株均能在葡萄糖质量浓度为800 g/L的YPD培养基上生长,且菌株7-1-1生长明显,高糖耐受性较好。
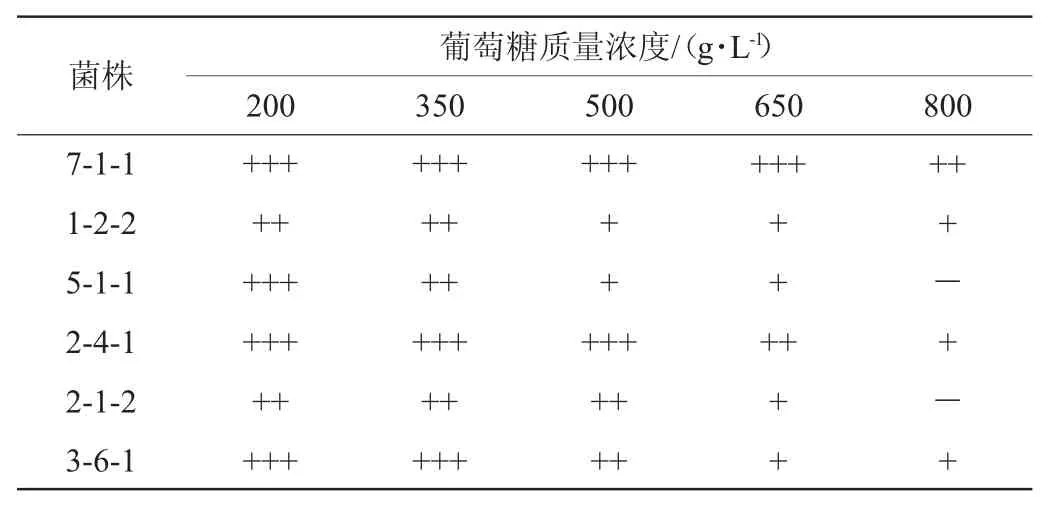
表1 6株酵母菌的高糖耐受性试验结果Table 1 Results of high sugar tolerance tests of 6 yeast strains
2.2.2 乙醇耐受性
6株酵母菌的乙醇耐受性见表2。由表2可知,6株酵母菌均能在含体积分数为6%的乙醇的YPD培养基上生长,其中,菌株7-1-1和2-4-1可以在含体积分数为12%的乙醇的YPD培养基上明显生长。综上,选择菌株7-1-1为优良菌株。
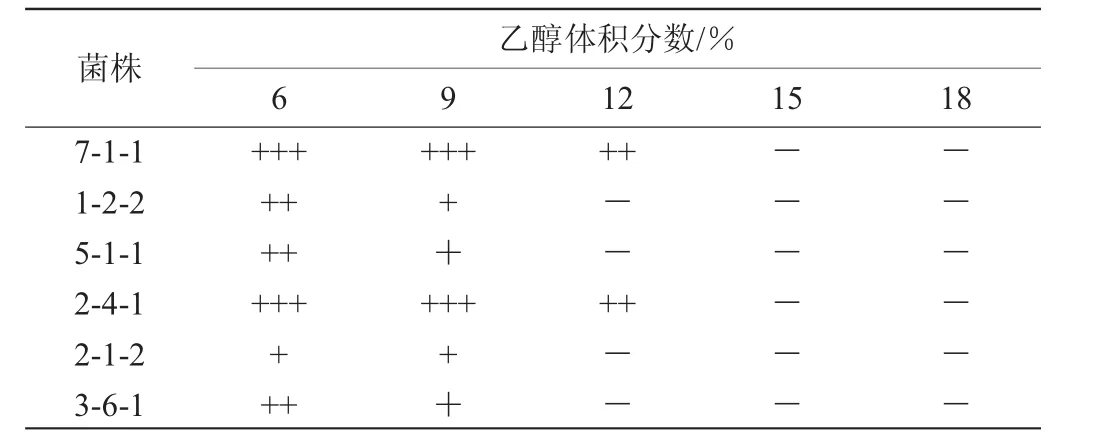
表2 6株酵母菌的乙醇耐受性试验结果Table 2 Results of ethanol tolerance tests of 6 yeast strains
2.3 酵母菌7-1-1的鉴定
2.3.1 形态特征
菌株7-1-1的菌落及细胞形态见图1。由图1可知,菌株7-1-1在WL营养琼脂培养基上的菌落为圆形,白色不透明,菌落扁平,表面有褶皱,边缘不整齐,易挑起,并散发清淡的香味。光学显微镜下,细胞呈椭圆形,繁殖方式为单端芽殖或多端芽殖。

图1 菌株7-1-1在WL营养琼脂培养基上的菌落(a)及细胞(b)形态Fig.1 Colony(a)and cell(b)morphology of strain 7-1-1 on WL medium
2.3.2 生理生化试验
菌株7-1-1的生理生化特征见表3。由表3可知,菌株7-1-1能够发酵葡萄糖、半乳糖、蔗糖、麦芽糖和棉子糖,但不能发酵乳糖和海藻糖;能够同化葡萄糖、蔗糖、松三糖、甲基-吡喃葡萄糖、纤维二糖、水杨苷、乙醇、甘油、赤藓糖醇、D-山梨醇、D-甘露醇、50%葡萄糖、可溶性淀粉,但不能同化L-鼠李糖、L-山梨糖、菊糖、蜜二糖、甲醇、半乳糖醇;能同化硝酸钠和亚硝酸钠。此外,菌株7-1-1能够在无维生素环境下生长。对照《酵母菌的特征与鉴定手册》检索表[17]和最新的酵母分类系统[18-19],初步鉴定菌株7-1-1为威克汉姆酵母属(Wickerhamomyces)。

表3 菌株7-1-1的生理生化试验结果Table 3 Physiological and biochemical tests results of strain 7-1-1

续表
2.3.3 分子生物学鉴定
对菌株7-1-1的5.8S-ITS区序列进行PCR扩增,PCR扩增产物经过1%琼脂糖凝胶电泳检测,结果见图2。由图2可知,PCR扩增产物目的条带清晰,碱基长度约为600 bp,与预期结果相符。

图2 菌株7-1-1 PCR扩增产物的琼脂糖凝胶电泳结果Fig. 2 Agarose electrophoresis result of PCR product of strain 7-1-1
PCR扩增产物经测序后,构建菌株7-1-1的系统发育树,结果见图3。由图3可知,菌株7-1-1与异常威克汉姆酵母(Wickerhamomyces anomalus)(以前为Pichia anomala)聚于同一分支,亲缘关系最近,因此结合形态学及生理生化,鉴定菌株7-1-1为异常威克汉姆酵母(Wickerhamomyces anomalus),该菌株的登录号为GenBank MZ420152。

图3 基于5.8S-ITS基因序列菌株7-1-1的系统进化树Fig. 3 Phylogenetic tree of strain 7-1-1 based on 5.8S-ITS gene sequences
2.4 菌株7-1-1的耐受性试验结果
2.4.1 低pH耐受性
pH对酵母菌的生长代谢有较大影响,能影响细胞间的代谢传递及酶活性,在较低或较高的pH下可使酵母菌死亡[24]。不同低pH值下,菌株7-1-1的生长曲线见图4。由图4可知,随着培养基初始pH值的降低,菌株7-1-1的生长变缓慢。当培养基的初始pH为3.5时,菌株7-1-1的OD600nm值最大,生长情况最好;当培养基的初始pH为1.5时,菌株仍可生长,说明该菌株可耐低pH。李棒等[12]从蓝莓果皮及特香型白酒酒醅中分离的一株异常威克汉逊酵母在培养基起始pH为2.5、3.0、3.5时可以生长;史雁飞[25]从白酒大曲及酒醅分离的一株异常威克汉逊酵母在pH为3.6时生长得最好,说明W.anomalus的生长受pH影响较小,有较强的耐酸性。相较于之前的研究报道,菌株7-1-1的耐酸性较为突出,达到了pH 1.5。
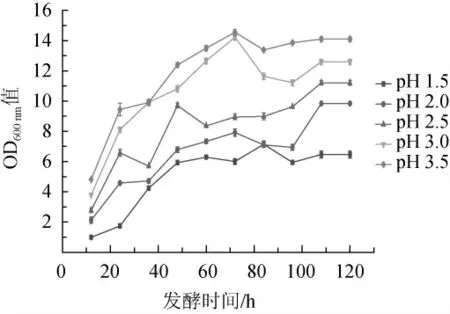
图4 不同pH下菌株7-1-1的生长曲线Fig. 4 Growth curve of strain 7-1-1 at different pH
2.4.2 葡萄糖耐受性
添加一定浓度的糖可以为酵母菌的生长提供必需的碳源,但在较高浓度下会改变酵母菌细胞膜的渗透压从而抑制其生长[11,26]。不同葡萄糖质量浓度下,菌株7-1-1的生长曲线见图5。由图5可知,葡萄糖质量浓度增加到一定值后,菌株7-1-1生长会受到抑制,其延滞期会延长。当初始葡萄糖质量浓度为300 g/L、450 g/L、600 g/L、750 g/L、900 g/L时,菌株7-1-1的延滞期分别为12 h、12 h、12 h、12 h、36 h;当初始葡萄糖质量浓度为450 g/L时,菌株7-1-1生长情况最好;当初始葡萄糖质量浓度为900 g/L时,菌株7-1-1仍能够缓慢生长,说明该菌株7-1-1有较好的高糖耐受性。李棒等[12]研究表明,在蔗糖含量<70%时,异常威克汉逊酵母受到的抑制较小,但当蔗糖含量>70%时,菌株生长会随着蔗糖浓度的升高,抑制作用逐渐增强。这可能是发酵底物不同,使得异常威克汉逊酵母对糖的耐受性不同。本试验从自然发酵果蔬酵素中分离得到耐高糖能力达到900 g/L的异常威克汉逊酵母,这为耐高渗果蔬发酵剂的使用提供理论依据。

图5 不同葡萄糖质量浓度下菌株7-1-1的生长曲线Fig.5 Growth curve of strain 7-1-1 at different glucose mass concentration
2.4.3 乙醇耐受性
酵母菌对乙醇的耐受性会影响发酵效率[23]。菌株7-1-1对乙醇的耐受性试验结果见表4。由表4可知,该菌株能够在乙醇体积分数为8%、10%和12%的YPD培养基中生长,并且杜氏小管在48 h内充满气体,说明菌株7-1-1的发酵能力较强;当乙醇体积分数为14%时,菌株7-1-1仍可生长,且在48 h内杜氏小管中的气体达到1/2,表明发酵能力有所减弱;当乙醇体积分数为16%时,菌株7-1-1在杜氏小管中只有微量气体,说明在此条件下该菌株不适宜发酵。史雁飞等[25]研究表明,异常威克汉逊酵母可在酒精度为12%vol的条件下生长,研究中菌株7-1-1可耐受乙醇体积分数14%,说明菌株7-1-1对乙醇具有较好的耐受性,能够在发酵中保持良好的存活率,促进改善风味,增加酵素产品的功能性,满足果蔬酵素发酵的需求。

表4 菌株7-1-1的乙醇耐受性试验结果Table 4 Ethanol tolerance test results of strain 7-1-1
2.4.4 温度耐受性
温度是影响酵母菌生长的重要因素,会影响酵母菌的酶活和对营养物质的吸收利用,而不同的酵母菌对温度的耐受性也不同[8]。菌株7-1-1对温度的耐受性试验结果见表5。由表5可知,菌株7-1-1在25~35 ℃条件下能够生长,在37 ℃条件下生长缓慢,在42 ℃条件下不生长。边明鸿等[27]从发酵的桑葚果酒中筛选的异常威克汉逊酵母可以在温度为36 ℃环境下生长;张玉然等[28]从白酒酒醅中分离的异常威克汉逊酵母在38 ℃条件下可以生长,在42 ℃高温下生长受到强烈抑制。这与本研究结果一致。说明菌株7-1-1对温度有较好的耐受性,可以37 ℃条件下生长,可提高在酵素发酵中酵母菌的酶活,促进产物的合成,增加酵素的产品质量。

表5 菌株7-1-1的温度耐受性试验结果Table 5 Temperature tolerance test results of strain 7-1-1
3 结论
本研究从自然发酵果蔬酵素中分离出一株耐高糖、乙醇的优良酵母菌,编号为7-1-1,通过形态观察、生理生化试验及分子生物学技术鉴定该菌株为异常威克汉姆酵母(Wickerhamomyces anomalus)。该菌株能够耐受低pH值1.5、葡萄糖质量浓度900 g/L、乙醇体积分数14%和温度37 ℃,具有较好的耐受性,对功能微生物酵素产品的研究开发和工业化生产具有一定的意义。
