转化山楂黄酮的食用真菌筛选及其发酵工艺优化
2021-03-04程水明潘惠雯韩寒冰
程水明,潘惠雯,韩寒冰
(广东石油化工学院生物与食品工程学院,广东 茂名 525000)
山楂(Crataegus pinnatifidaBunge)为蔷薇科山楂属落叶灌木果实,是最早被列为食药兼用的水果之一。山楂在我国分布广泛,产量丰富,主要分布在中国中部与南部地区,是重要经济作物[1]。山楂主要活性成分为黄酮、异黄酮类和有机酸类(山楂酸、酒石酸、柠檬酸等)[2]。山楂中黄酮类化合物的提取、活性评价(防心血管病、降血脂、消炎抗菌及抗肿瘤等)与发掘已成研究热点[3-7]。目前有关山楂果实、叶、核(籽)中黄酮类化合物的提取与分离纯化已有较多报道[8-11],大部分是通过物理或化学手段从植物中直接提取,但该方法存在提取工艺复杂、产率低、大规模制备受限等问题。如何提高植物中黄酮的利用率,一直是科学家们探索的一个热点。黄酮类化合物的生物合成途径较短,在微生物中合成有很大优势,近年来,随代谢工程以及合成生物学技术的迅速发展,以生长快速、遗传背景简单、易于操作的模式微生物作为细胞工厂合成天然活性产物(如黄酮类化合物)成为研究热点[12]。
利用微生物发酵中药在千余年前就有应用,如淡豆豉、六神曲、豆黄等[13]。现代发酵中药研究始于20世纪80年代,主要集中在一些真菌的纯种发酵,如冬虫夏草、槐耳、灵芝等[13],而利用食用真菌发酵山楂则鲜有报道;目前已发表的关于山楂总黄酮含量的测定方法主要为高效液相色谱法和可见分光光度法[17]。与高效液相色谱法相比,可见分光光度法具有适用性较广、操作简单、测试时间短、精密度高和准确度好等特点,基于此,本研究利用初筛出的20种食用真菌来发酵山楂,采用可见分光光度法测定总黄酮含量,以期筛选出适于发酵山楂的食用真菌,并优化其发酵工艺,为黄酮类化合物资源开发及山楂资源深度利用提供科学依据。
1 材料与方法
1.1 材料与试剂
山楂:2020年10月采摘于广东信宜成熟的大果山楂鲜果。
芦丁标准品(含量>98%):南京都莱生物技术有限公司;硝酸铝(分析纯):上海阿拉丁有限公司;乙醇(分析纯):西陇科学有限公司;硫酸镁(分析纯):上海麦克林生化科技有限公司;亚硝酸钠、氢氧化钠(均为分析纯):罗恩试剂有限公司;试验用水为实验室自制超纯水。
20种食用真菌(桑黄(Fleckedflesh polypore)、长根菇(Pleurotus nebrodensis)、黑平菇(Pleurotus ostreatus)、绣球菌(Sparassis crispa)、蛹虫草(Cordyceps militaris)、灰褐香蘑(Lepista panaeola)、茯苓(Wolfiporia cocos)、玉覃离褶伞(Lyophyllum shimeji)、金针菇(Flammulina velutipes)、香菇(Lentinula edodes)、野蘑菇(Agaricus arvensis)、白小圈齿麟伞(Pholiota albocrenulata)、毛栓菌(Trametes hirsuta)、裂褶菌(Schizophyllum commune)、滑菇(Pleurotus ostreatus)、毛柄库恩菇(Kuehneromyces mutabilis)、黄伞(Pholiota adiposa)、蜜环菌(Armillaria mellea)、猴头菇(Hericium erinaceus)、阿魏菇(Pleurotus ferulae)):中国农业科学院菌种保藏中心。
液体培养基:马铃薯汁20%,葡萄糖2%,蛋白胨0.2%,磷酸二氢钾0.3%,硫酸镁0.15%,pH自然。121 ℃灭菌20 min。
1.2 仪器与设备
FA2104电子分析天平:上海良平仪器仪表有限公司;DF-15高速万能粉碎机:浙江温岭市林大机械有限公司;DHG-9073BS-Ⅲ电热鼓风干燥箱:上海新苗医疗器械有限公司;CR-080S超声波清洗器:深圳市春霖清洗设备有限公司;V-5000型722分光光度计:上海元析仪器有限公司;RE-2000A旋转蒸发仪:上海亚荣生化仪器厂;SPX-250B人工智能生化培养箱:天津市泰斯特仪器有限公司;L5S紫外可见分光光度计:上海仪电科学仪器股份有限公司;TG16A-WS台式高速微量离心机:上海卢湘仪离心机仪器有限公司;NRY-1102立式恒温摇床:上海南荣实验室设备有限公司。
1.3 方法
1.3.1 发酵液制备
将供试食用真菌接种于液体培养基,25 ℃、100 r/min摇床培养3 d得种子液;将山楂除杂,于50 ℃条件下烘干,粉碎过100目筛,以4%添加量加入液体培养基中,灭菌后按接种量5%(V/V)接入培养基,得山楂发酵液。
1.3.2 食用真菌发酵山楂工艺优化
菌株选取:按照1.3.1进行山楂发酵液制备,以总黄酮含量为考察指标,选取发酵液中总黄酮含量最高的食用真菌作为后续发酵工艺条件优化用菌株。
单因素试验:在培养基和其他条件不变情况下分别考察发酵温度(20.0 ℃、22.5 ℃、25.0 ℃、27.5 ℃、30.0 ℃、32.5 ℃);发酵时间(3 d、5 d、7 d、9 d、11 d、13 d);料液比(1∶20、1∶25、1∶30、1∶35、1∶40、1∶45(g∶mL));接种量(1.5%、3.0%、4.5%、6.0%、7.5%、9.0%)对发酵液总黄酮含量的影响。
响应面试验:在单因素试验的基础上,选取发酵时间(A)、发酵温度(B)、接种量(C)和料液比(D)4个因素作为自变量,以发酵液总黄酮含量(Y)为响应值,进行4因素3水平的响应面分析,响应面试验因素与水平见表1。
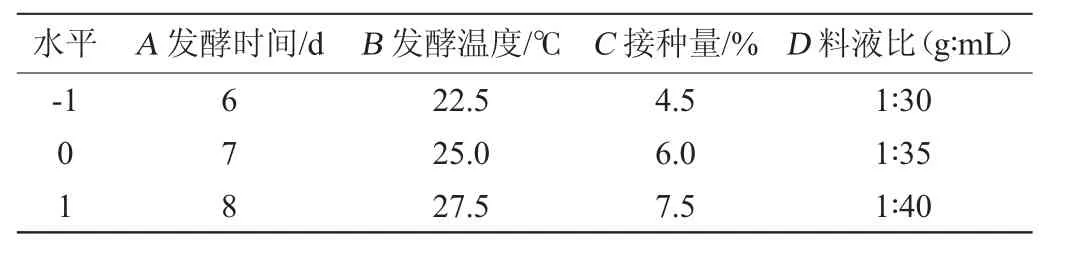
表1 食用真菌发酵山楂工艺优化Box-Behnken试验因素与水平Table 1 Factors and levels of Box-Behnken experiments for hawthorn fermentation process optimization by edible fungi
1.3.3 总黄酮含量测定[18]
标准曲线绘制:精密称取5.00 mg芦丁对照品,用体积分数30%的乙醇定容至25 mL,得0.20 mg/mL芦丁标准品溶液。依次取0、0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL芦丁标准品溶液,分别加入0.3 mL 5%NaNO2静置5 min,加0.3 mL 10%Al(NO3)3静置6 min,2 mL 4%NaOH,体积分数60%乙醇定容至10 mL,放置15 min后于波长510 nm处测吸光度值;以芦丁含量(x)为横坐标,OD510nm值(y)为纵坐标绘制标准曲线,求回归方程,确定相关系数。

1.3.4 试验数据处理
采用Excel 2010对试验数据进行收集整理;用Origin 9.0对菌种筛选、单因素试验数据进行绘图;用Design Expert 12.0中的Box-Behnken进行方差和响应面优化分析。
2 结果与分析
2.1 食用真菌发酵菌种筛选结果分析
20种食用真菌在相同条件下与山楂液体培养基进行共发酵,以总黄酮含量为考察指标,筛选转化效率最高的食用真菌,结果见图1。
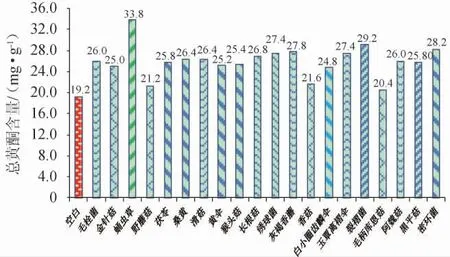
图1 20种食用真菌发酵山楂总黄酮含量比较Fig. 1 Comparison of total flavonoids contents of fermented hawthorn by 20 edible fungi
由图1可知,山楂经食用真菌发酵后总黄酮含量均比未经发酵时有所增加,表明经食用真菌发酵可有效促进山楂中总黄酮类化合物的形成和释放。其中经蛹虫草发酵后的发酵液中总黄酮含量最高,为33.8 mg/g,是空白对照(19.2 mg/g)的176%。因此后续试验中选用蛹虫草作为试验用菌种。
2.2 蛹虫草发酵山楂单因素试验结果
2.2.1 发酵温度对山楂基发酵液总黄酮含量的影响
由图2可知,发酵温度为20.0~22.5 ℃时,山楂基发酵液中总黄酮含量缓慢增加,25 ℃时达最高值36.0 mg/g,随后趋于稳定。原因是温度低时酶活性低,真菌生长及代谢慢;随温度升高,微生物生化反应速率和生长速率加快,对基质的吸收和分解增加;因黄酮不耐高温,高温会引起分解或结构变化,导致总黄酮含量略有降低。因此选择最佳发酵温度为25 ℃。
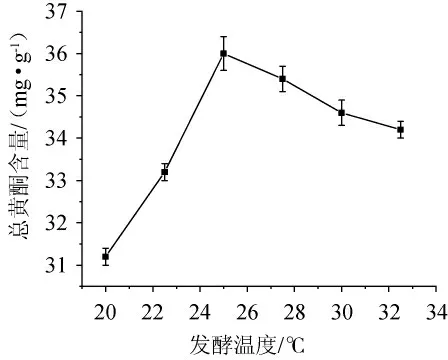
图2 发酵温度对山楂基发酵液中总黄酮含量的影响Fig. 2 Effect of fermentation temperature on total flavonoids contents in hawthorn fermentation broth
2.2.2 发酵时间对山楂基发酵液总黄酮含量的影响
由图3可知,随发酵时间延长,总黄酮含量逐步增加,发酵第7天时达最高值35.2 mg/g,随后略有下降但总体趋于稳定。可能是因为3~5 d内真菌群体数量少,生长缓慢且以菌体生长为主,代谢产物积累少,转化的总黄酮量也相对较少;5~7 d内真菌生长进入快速生长期,代谢旺盛,转化山楂中总黄酮速度加快,总黄酮含量增长快,7 d后达峰值。因此选择最佳发酵时间为7 d。
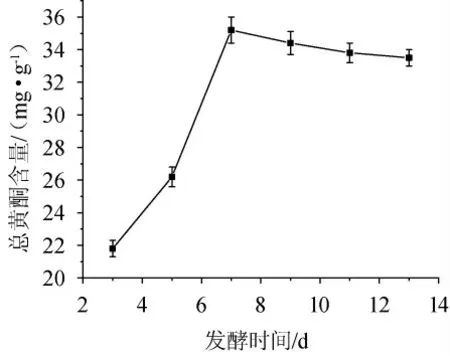
图3 发酵时间对山楂基发酵液中总黄酮含量的影响Fig. 3 Effect of fermentation time on total flavonoids contents in hawthorn fermentation broth
2.2.3 料液比对山楂基发酵液总黄酮含量的影响
由图4可知,随着料液比的变化,山楂基发酵液中总黄酮含量不断增加,在料液比为1∶35(g∶mL)之前增长较快,随后虽仍在上升但增加缓慢,这是因为随发酵液体积增加,山楂粉与发酵液接触面积增加,加快了黄酮类化合物溶出,但发酵液用量过大,后续步骤耗能亦会相应增加。因此选择最佳料液比为1∶35(g∶mL)。

图4 料液比对山楂基发酵液中总黄酮含量的影响Fig. 4 Effect of solid-liquid ratio on total flavonoids contents in hawthorn fermentation broth
2.2.4 接种量对山楂基发酵液总黄酮含量的影响
由图5可知,随接种量在1.5%~6.0%范围内的增加,山楂基发酵液总黄酮含量呈增加趋势,接种量为6.0%时达最高值39.6 mg/g,随后趋于稳定;接种量>6.0%时,菌体群体过大,生长限制因子不足,导致真菌菌体自身衰老或发生自溶等,从而影响后续黄酮的分离。因此选择最佳接种量为6.0%。
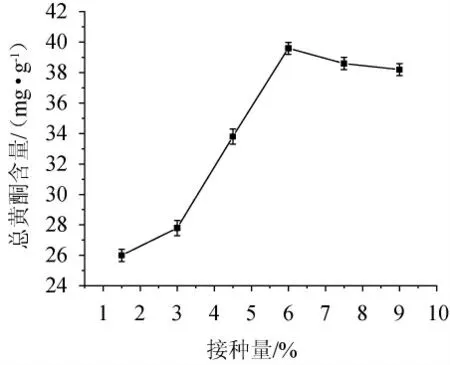
图5 接种量对山楂基发酵液中总黄酮含量的影响Fig. 5 Effect of inoculum on total flavonoids contents in hawthorn fermentation broth
2.3 响应面法优化蛹虫草发酵山楂工艺条件
2.3.1 响应面试验设计及结果
在单因素试验基础上,以总黄酮含量(Y)为响应值,选取发酵时间(A)、发酵温度(B)、接种量(C)和料液比(D)4个因素进行响应面试验,响应面试验设计与结果见表2,回归模型方差分析见表3。
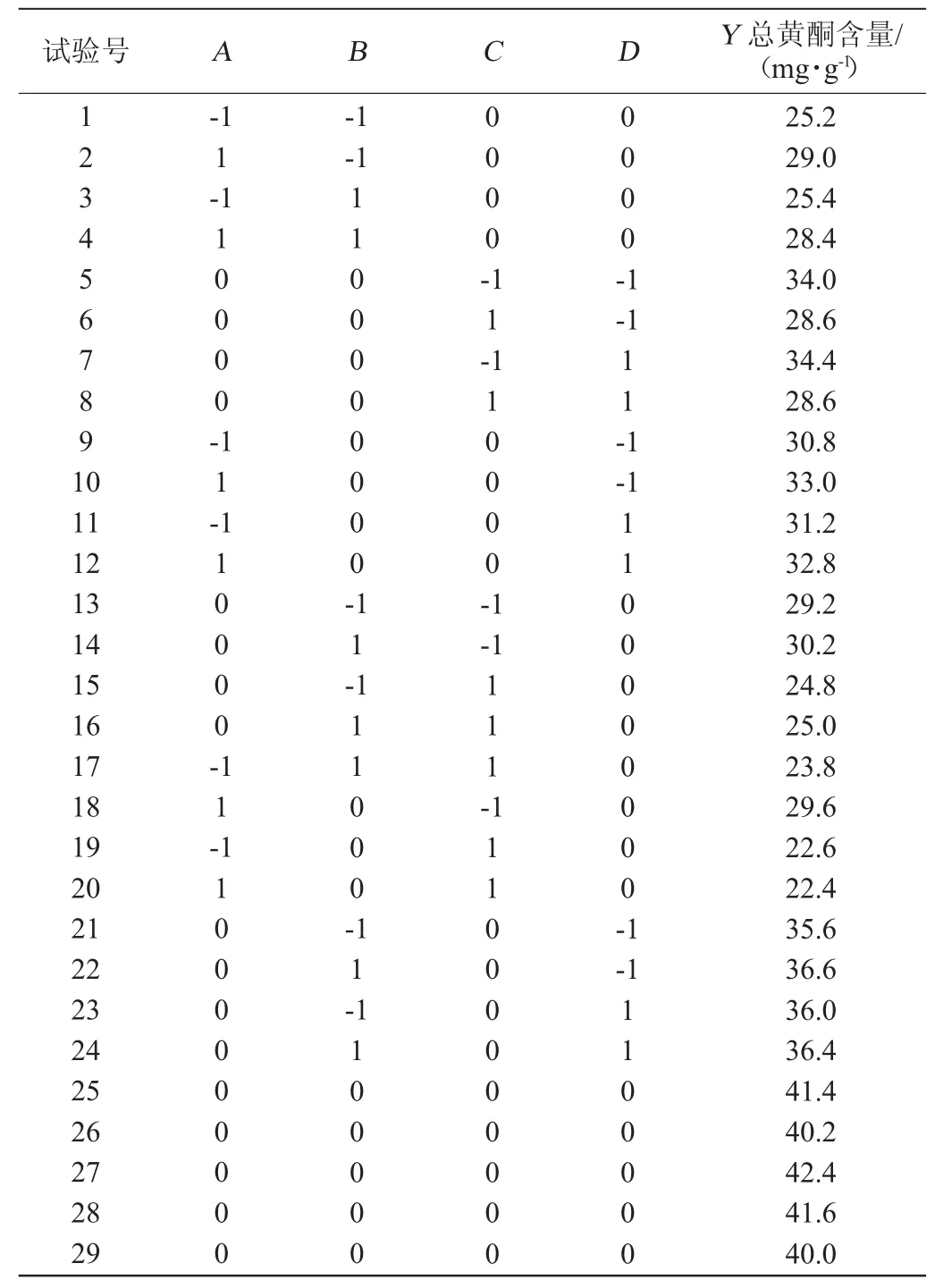
表2 蛹虫草发酵山楂工艺优化响应面试验设计与结果Table 2 Design and results of response surface experiments for hawthorn fermentation process optimization by Cordyceps militaris
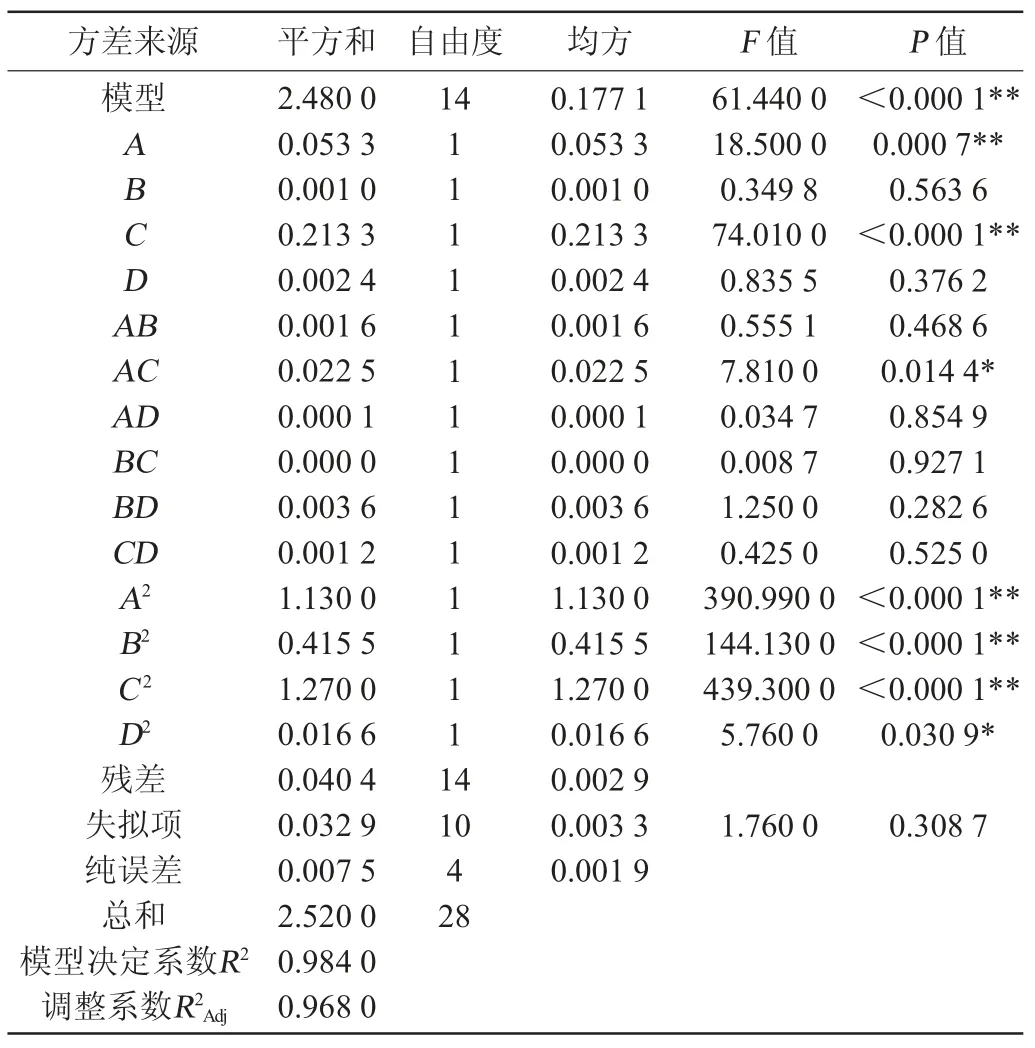
表3 回归模型方差分析结果Table 3 Results of variance analysis of regression model
利用Design Expert 12.0对响应面试验结果(表2)进行多元回归拟合,得到发酵时间、发酵温度、接种量、料液比对山楂发酵液总黄酮含量影响的二次多项式回归模型:Y=2.60+0.066 7A+0.009 2B-0.133 3C+0.014 2D+0.020 0AB-0.075 0AC+0.005 0AD-0.002 5BC-0.030 0BD+0.017 5CD-0.416 8A2-0.253 1B2-0.441 8C2-0.050 6D2。
2.3.2 响应面显著性及方差分析
模型方差分析结果(表3)表明,回归模型P<0.000 1,极显著,模型的实际值与预测值线性拟合决定系数为0.984,说明模型能解释98.4%的响应值变化,误差小,模型F=61.44、调整决定系数R2Adj=0.968,变异系数3.40%,表明试验精确度良好,方程模型拟合度较好。一次项A、C,二次项A2、B2、C2对结果影响极显著(P<0.01),交互项AC,二次项D2对结果影响显著(P<0.05),一次项B、D,交互项AB、AD、BC、BD、CD对结果影响不显著(P>0.05)。4个因素对结果影响主次排序为C>A>D>B,即接种量>发酵时间>料液比>发酵温度。
2.3.3 响应曲面图交互分析结果
响应曲面图中曲线走势越陡,表明该因素影响越显著;反之,走势平滑则表明该因素影响较小[21-22]。等高线为椭圆形表明两因素的交互作用显著,圆形则代表交互作用不显著。由图6可知,发酵时间(A)与接种量(C)的等高线呈椭圆形,表明A与C交互作用明显。在发酵时间6~8 d,总黄酮含量随发酵时间增加呈先升后降趋势,上升较快,下降缓慢;接种量对发酵液中总黄酮含量的影响同样呈先增后减趋势。但A因子的曲面倾斜度小于C因子,即曲面更加陡峭,说明发酵时间较接种量对总黄酮含量影响更大。与表3方差分析中AC交互项的P=0.014 4<0.05,A与C交互作用显著的结果相一致。
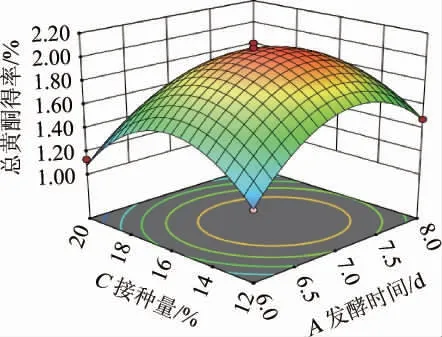
图6 发酵时间与接种量交互作用对山楂发酵液中总黄酮得率影响的响应曲面及等高线Fig. 6 Response surface plots and contour lines of effect of interaction between fermentation time and inoculum on total flavonoids yields in hawthorn fermentation broth
2.3.4 验证试验结果
通过Design-Expert 12.0拟合得到山楂发酵的最佳工艺参数为发酵时间7.095 d、发酵温度25.040 ℃、接种量5.77%和料液比1∶35.556(g∶mL),在此条件下总黄酮含量预测值为41.5 mg/g。为实际操作方便,修正工艺参数为发酵时间7 d、发酵温度25 ℃、接种量6.0%和料液比1∶35(g∶mL),在此优化条件下进行5次验证试验,山楂发酵液中总黄酮含量平均值为42.8 mg/g,与预测值41.5 mg/g误差很小,表明优化发酵工艺稳定,重复性好。
2.4 讨论
微生物转化是增加天然产物多效性有效方法之一,已广泛应用于食品、工业、医药等多个领域[23],但在山楂中应用甚少,付莉莉等[24]采用5种食用真菌通过正交设计试验与山楂共发酵,结果为冬虫夏草发酵效果最好,结论为利用食用真菌发酵山楂总黄酮含量明显高于传统提取方法,且条件温和可保留其有效成分不被高温分解,但存在供试菌种少、代表性不全面,所采用的正交试验方法无法在试验范围内确定影响因素的最佳组合和响应值的最优值等不足。为系统、全面探究食用真菌发酵山楂的发酵工艺,本研究选取了20种食用真菌与山楂共发酵,以总黄酮的含量为考察指标,得出生长率、转化率最高的食用真菌。结果显示,经蛹虫草与山楂共发酵后发酵液中总黄酮含量最高,为空白对照的1.76倍;通过响应面试验优化发酵工艺,因为响应面法既能提供各影响因子的交互作用,又能确保试验值与理论值相差较小,具有精确度高的特点[25-26]。
3 结论
通过响应面优化分析得到总黄酮发酵最佳工艺条件:发酵时间7 d、发酵温度25 ℃、接种量6.0%、料液比为1∶35(g∶mL)。在此条件下,山楂发酵液中总黄酮含量为42.8 mg/g,进一步证明通过微生物辅助发酵是可以有效提高山楂发酵液中总黄酮的含量,其原因可能与微生物中某种酶催化了某些总黄酮类化合物前体及酶还原某些总黄酮类化合物的衍生物有关,但中药发酵过程复杂,总黄酮含量增加的机制是什么,还有没有其他微生物可更大幅度提高总黄酮含量,这些问题尚需进一步研究。微生物辅助发酵可有效提高山楂中总黄酮的含量,响应面优化得到的共发酵工艺具有总黄酮含量高、精度高、工艺稳定的优点,可在生产中应用并推广。
