儿童重症医学科金黄色葡萄球菌抗生素耐药性与分子遗传背景特征分析*
2021-03-03张森雄傅锦坚梁卓信
肖 萍,张森雄,傅锦坚,梁卓信△
(柳州市妇幼保健院 1.药学部;2.重症医学科;3.检验科,柳州 545001)
金黄色葡萄球菌(staphylococcus aureus,SA)是导致儿童皮肤和软组织感染(skin and soft tissue in‐fection,SSTI)以及某些侵入性感染(如骨髓炎和败血性关节炎)的最常见病原体之一[1]。同时,SA 也是健康儿童或医疗机构相关的致病病原体之一[2]。SA广泛存在于社区和医疗机构相关环境,与其超强的毒力和耐药基因传播能力高度相关。据报道,不同的分子背景如携带的耐药基因、毒力基因不同,其致病能力不一致,如在我国儿童医院分离出来的常见克隆菌株ST59-SCCmecIV/V菌株,其大多呈现多重耐药状态,且杀白细胞素(Panton-Valentine leu‐kocidin,pvl)基因在甲氧西林耐药性SA(methicillinresistantStaphylococcus aureus,MRSA)的携带率显著高于甲氧西林敏感性SA(methicillin-sensitiveStaphylococcus aureus,MSSA)[3]。在儿童重症监护室(pediatric intensive care unit,PICU),SA 仍是引起PICU 婴幼儿和儿童发生感染最常见的病原体之一[4-5]。但分离自该群体的SA 菌株的抗生素药物耐药性与分子遗传背景的相关性分析较少,本研究旨在分析柳州地区PICU 儿童感染的SA 菌株抗生素药物耐药性与菌株的分子特征,现将结果报道如下。
1 资料与方法
1.1 研究人群和样本收集 收集2018 年1 月至2019年12月在柳州市妇幼保健院PICU住院的婴幼儿,在使用抗生素前采集临床常见的感染性样本如血液、脑脊液、深部痰液、肺泡灌洗液、脓液等标本送至医学检验科进行细菌的培养和鉴定。本研究获得柳州市妇幼保健院医学伦理委员会的批准,批文为(20180013)。
1.2 SA 的分离鉴定 临床非无菌体液样本如深部痰液、肺泡灌洗液、脓液,接种于含5%羊血的哥伦比亚琼脂平板、嗜血巧克力和麦康凯平板,5%CO2、37 ℃培养18~24 h,挑选可疑阳性菌落进行革兰染色、形态学等鉴定、纯化,上机鉴定相关病原体。采集血液和脑脊液等无菌体液样本放入血培养瓶或脑脊液孵育瓶上机孵育,待报警后进行涂片、革兰染色、形态学等鉴定、增菌,再将单菌落上机鉴定相关病原体,确定分离株为SA。仪器选择生物梅里埃的VITEK 2 COMPACT,鉴定卡片为AST-GP卡。
1.3 抗生素药物敏感试验和耐药基因检测 使用微量肉汤稀释法进行抗生素药物敏感试验,检验结果的读取基于美国临床与实验室标准化委员会提出的标准执行。仪器选择生物梅里埃的VITEK 2 COMPACT,药敏卡片为AST-GP67 卡。多重耐药的判定标准为菌株对≥3 种不同型别的抗生素产生耐药。此外,采用聚合酶链反应(polymerase chain reaction,PCR)方法检测四环素耐药基因(tetM和tetK)、大环内酯类耐药基因(ermA和ermC)[6]。
1.4 SA 的分子特征分析 采用多序列基因分型(multilocus sequence typing,MLST)方法对SA 的7个管家基因进行测序后,将测序结果通过MLST 的数据库(http://eburst.mlst.net)查询得出序列分型(ST)和等位基因。使用网站自带程序eBURST 确定特定ST 的克隆复合体(clonal complex,CC),单ST 指未能聚集成CC 的ST。使用PCR 方法检测SA携带的甲氧西林耐药性基因mecA,具体的mecA 基因分型参照文献[7]执行。使用PCR 法对SA 菌株的10 种毒素基因、pvl、免疫逃逸簇基因(immune eva‐sion cluster,IEC)(scn,chp,sak)和中毒性休克综合征毒素-1(toxic shock syndrome toxin 1,tsst-1)进行检测[8]。
1.5 统计学方法 采用SPSS 23.0 软件对数据进行分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以百分率(%)表示,组间比较采用χ2验验或Fisher's 精确检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 儿童SA 感染的临床特征分析 共检出57 例SA,其中MRSA 14 例,MSSA 43 例。住院前1 周内有抗生素使用史的患儿MRSA 检出率明显高于MSSA患儿(P=0.005),见表1。
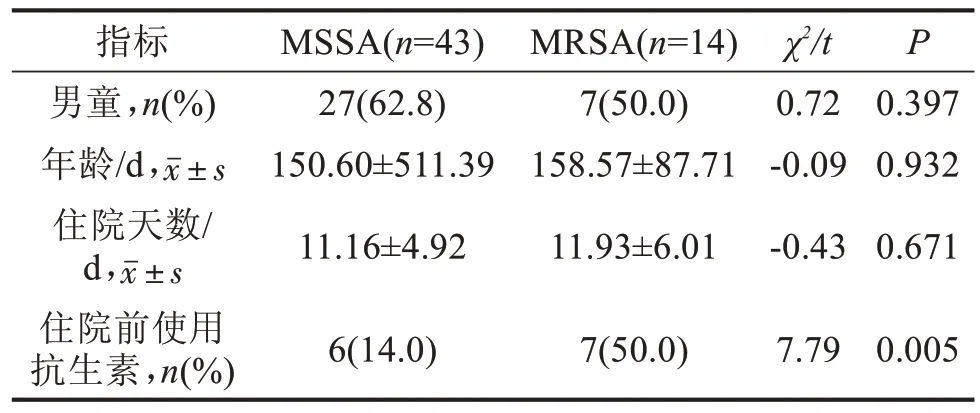
表1 儿童SA感染的特征分析
2.2 SA 菌株抗生素耐药谱分析 所有的SA 菌株均对万古霉素、利奈唑胺和左氧氟沙星敏感,MRSA菌株对氨苄西林、红霉素、克林霉素和多重耐药率显著高于MSSA(均P<0.05),见表2。
2.3 SA 菌株耐药基因与毒力基因特征分析 四环素耐药基因和大环内酯类耐药基因和pvl、IEC 和tsst-1基因在MRSA与MSSA菌株间的分布比较,差异无统计学意义(P>0.05),见表3。

表2 SA菌株抗生素耐药性分析 n(%)

表3 SA菌株耐药基因和毒力基因的特征分析
2.4 脓液与非脓液样本分离的SA 菌株毒力基因比较 共从脓液样本中检出7 株SA,其携带的pvl基因和tsst-1基因显著高于非脓液SA 菌株(P=0.003,P=0.021),见表4。
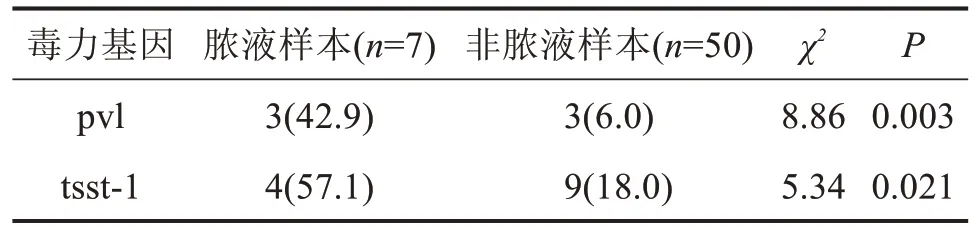
表4 脓液SA菌株毒力基因的特征分析
2.5 SA 菌株克隆型、耐药基因和毒力基因的特征分析 57 株SA 菌株中共检测出25 种ST,其中CC188、CC7、CC6 和CC5 是PICU 最常见的克隆株,共占总SA 菌株的47.4%。所有的14 株MRSA 菌株中,有10 株为SCCmecIV,4 株为SCCmecV,按照社区获得性MRSA(Community-associated methicillinresistantS.aureus,CA-MRSA)的定义,均属于CAMRSA。其中携带的SCCmecIVa元件的主要有ST6、ST25、ST89、ST108、ST509、ST946 和ST2832;携 带SCCmecV 元 件 的 主 要 有ST338、ST88 和ST121;携带SCCmecIV元件的主要有ST5、ST45 和ST59。
几乎所有的SA 菌株均携带IEC 基因,某些SA菌株的分子背景呈现特异性,如3 株ST25 菌株均对红霉素、克林霉素和四环素耐药,且均携带ermC和tetK耐药基因,均携带pvl基因。9 株MSSA-ST188菌株中,有4 株携带了tsst-1基因,表明本地区流行的SA 菌株呈现克隆多样性和基因型分布的区域差异性,见表5。
3 讨论
最近的多中心研究表明,各种弱势人群的MRSA 感染率有所降低[9]。然而,儿科住院患儿MRSA 的感染率正呈现上升趋势[10]。MRSA 是PI‐CU 住院的婴幼儿感染的主要病原体之一[11]。由于宿主免疫系统不成熟,环境因素如侵入性设备的频繁使用以及PICU 的相对拥挤环境,使得MRSA 容易定植和感染PICU 患者[12]。此前已有研究揭示了MRSA 感染的主要危险因素为医疗机构接触史、侵入性医疗设备使用史、儿童入院前抗生素用药史等[13-14]。本研究结果与上述研究结果类似,入院前一周曾经使用抗生素,是PICU 患者获得MRSA 感染的主要危险因素。
婴幼儿SA 感染和MRSA 的抗菌药物耐药性已成为重要的公共卫生问题。世界卫生组织(WHO)建议对出现严重细菌感染或败血症的婴幼儿,可使用氨苄西林(或青霉素)与庆大霉素联用,作为一线抗生素的首选[15]。但本研究结果显示,PICU 分离的SA 菌株对青霉素的耐药率达96.5%,对氨苄西林的耐药率也达到了75.4%,这与最近我国报道的新生儿败血症中SA 对青霉素和氨苄西林的耐药率分别为96.0%和78.0%的结果相符[16]。此外,本研究结果显示,SA 菌株对庆大霉素的耐药率约为5.3%,与广州妇儿中心报道的0.8%的研究结果类似[17],尽管WHO 建议使用氨苄西林外加氨基糖苷类抗生素治疗金葡感染造成的脓毒血症,但由于庆大霉素具有严重的耳毒性及肾毒性,临床上基本庆大霉素基本不应用于婴幼儿及老人群体[15]。众所周知,万古霉素和利奈唑胺是少见的对于治疗MRSA 有特效的抗生素之一,本研究结果显示,所有的金葡菌菌株对万古霉素和利奈唑胺均敏感,与广州和我国大部分的研究结果一致[16-17],表明万古霉素和利奈唑胺仍是治疗金葡菌感染的一线药物之一。本研究结果显示,有29.8%的SA 菌株呈现多重耐药状态,且MRSA 的多重耐药性显著高于MSSA 菌株(P<0.05),研究结果与广州妇儿中心报道的30.5%菌株为多重耐药株的结果相似[17],表明在儿童医院的PI‐CU 病房,SA 菌株的多重耐药已不能被忽视。医护人员应主动对PICU 感染菌株进行前瞻性监测,尤其需要监测多重耐药性SA 菌株的流行模式和耐药模式,以便正确指导抗生素的合理使用,降低PICU内部流行的SA菌株多重耐药性。

表5 SA菌株克隆型、耐药基因和毒力基因的特征分析
SA的流行克隆株正在发生着动态的变化,包括SA 基因本身适应性的地域差异和基因的水平转移等[17]。对SA 进行分子特征的监测或许会拓宽研究者对SA 菌株在PICU 环境和患者中传播的机制认识。本研究分离的57 株菌株中,共检出了25 种ST型别,其中14 株MRSA 菌株按照国际上关于MRSA SCCmec的定义,均属于CA-MRSA。14 株CAMRSA 分布于13 种ST 型别中。57 株SA 菌株最常见的基因型是CC188(ST188)、CC59(ST338 和ST59)、CC5(ST5)、CC6(ST6)、CC7(ST7)和CC88(ST8),在德国最常见的SA CC是CC15、CC8、CC25和CC7,但在美国分离的SA 主要CC 为CC30、CC5和CC8[15,18]。上述研究显示SA菌株存在克隆多样性和基因型分布的区域差异。本研究发现,ST188 是PICU 住院患儿群体分离的SA 菌株主要基因型别,与广州妇儿中心的研究结果相似[17],研究表明,由于具有较强的生物膜形成和粘附能力,使得ST188 仍是从中国儿童感染性样本中分离出来的最常见MS‐SA 克隆。类似的报道在上海的人群和家畜样本分离株已出现[19],提示研究者需加强本地SA流行株如ST188的主动监测,以期发现新的流行规律,更好的指导临床针对型特异性进行主动干预。
本研究结果显示,pvl基因主要存在于CC59、CC25、ST281 和ST2832 中,且导致PICU 儿童发生SSTI的主要克隆株为CC59、CC25。tsst-1基因主要在CC6、CC7、CC15、CC88、CC188 等CC 中检出,且本研究发现,特定克隆株与耐药模式或毒力基因之间存在的一定的对应关系,如导致SSTI 感染的CC25对应ermC和tetK耐药基因,且携带pvl基因和IEC 的chp和sak。CC188 可导致SSTI,且容易携带tsst-1毒素、携带1 个或以上的IEC 基因(scn、chp和sak),这与早前温州以及全国大型多中心研究的结果一致[20-21],亦即ST25-pvl、ST188-tsst1存在相对应关系,且pvl和tsst1是脓液分离的金葡菌携带最多的基因之一。揭示基于多种表型-基因型特征用于区分SA 克隆的必要性[22],这为监测SA 新的流行病学趋势提供了另一种思路。
综上所述,SA 的遗传背景具有一定的特异性,提示在以后的研究中仍需对日常主动监测发现的SA 菌株加以鉴定分析,以期发现新的流行病学趋势。此外,从PICU 患者感染性样本中分离的部分SA 菌株呈现多重耐药性,也提示日后持续监测SA菌株抗生素耐药的重要性。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- Effect of miR-200a-3p targeting transthyretin(TTR)on the biological behavior of placental trophoblasts in hypertensive disorder complicating pregnancy
- 沙利度胺对重型β地中海贫血患者红系细胞γ珠蛋白基因表达及分化的作用研究*
- CEMIP调控Src/AKT/STAT3信号通路对非小细胞肺癌上皮间质转化及细胞侵袭、迁移的影响*
- 乳铁蛋白对正畸复发移动过程中牙周改建的影响*
- 秦皮苷对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响*
- miR-133b-3p对大鼠脑缺血/再灌注损伤的影响及其作用机制*
