miR-133b-3p对大鼠脑缺血/再灌注损伤的影响及其作用机制*
2021-03-03高静贵秦振秀梁程伟谢晓云刘竞丽
高静贵,徐 琛,秦振秀,瞿 祥,吴 双,梁程伟,谢晓云,刘竞丽
(广西医科大学第一附属医院神经内科,南宁 530021)
缺血性脑卒中是最常见的脑卒中类型,其特征是大脑区域的血液循环突然中断。目前,通过静脉溶栓治疗或介入手术取栓治疗快速恢复血液供应已成为缺血性脑卒中最有效治疗方法。但是,这会导致脑缺血/再灌注(I/R)损伤增加,加剧缺血后进一步的脑损伤和功能障碍。因此,阐明脑I/R 损伤潜在的分子机制,有助于改善脑I/R 损伤后的功能恢复。
众所周知,miRNA 是转录后负向调控基因表达的关键介质,可以通过结合靶mRNA的3'-UTR区来调节多种生物过程[1]。随着I/R研究的深入,对miR‐NA 在脑I/R 损伤中的作用的研究逐渐增多。例如敲低miR-34a 可以通过激活Notch1/HIF-1α 信号通路减轻大鼠脑组织损伤和神经元凋亡[2]。MiR-21通过靶向MAP2K3 来预防血脑屏障的破坏,从而发挥脑I/R 损伤中的神经保护作用[3]。相反,miR-27b 通过调节AMP 激活的蛋白激酶活性来促进缺血性卒中的恢复[4]。上述实验均明确表明,miRNA 在脑I/R损伤过程中起着重要作用。Norcini 等[5]研究发现,miR-133b-3p 可阻止大鼠周围神经损伤后持续性冷和机械性异位疼痛的发展。然而,miR-133b-3p 在脑I/R损伤的机制尚不完全清楚。
越来越多的证据表明,包括miR-133b-3p 在内的miRNA 的表达水平会随着神经损伤的变化而发生变化,这表明它们可能会影响脑损伤的病理生理过程[6]。为了分析miR-133b-3p 对I/R 后神经功能的潜在影响,本研究采用了I/R 模型,并通过脑室内注射miR-133b-3p 激动剂和抑制剂来观察对神经功能和脑组织的影响,并研究其潜在的分子机制。
1 材料与方法
1.1 主要仪器及试剂 脑立体定位仪、大鼠MCAO线栓(型号:MSRC37B250PK50)、动物麻醉机和异氟烷购自深圳瑞沃德公司;Trizol 购自美国Life 公司;逆转录试剂盒、实时荧光定量PCR(qPCR)检测试剂盒购自日本TaKaLa 公司;大鼠miR-133b-3p 引物购自广州复能公司;miR-133b-3p激动剂(agomir)和miR-133b-3p 抑制剂(antagomir)及其阴性对照物(NC)由广州锐博生物公司提供。
1.2 实验动物及分组 SPF 级雄性SD 大鼠36 只,体重250~280 g,购于广西医科大学实验动物中心,动物生产合格证号:SCXK 桂2020-0003,动物使用合格证号:SYXK 桂2020-0004。动物饲养温度25 ℃,相对湿度50%,光照条件为12 h 明/12 h 暗。本研究动物实验及处置符合广西医科大学实验动物中心动物实验伦理要求。
所有大鼠适应性喂养1 周后,随机分为6 组,分别为假手术组、I/R 组、I/R+agomir 组、I/R+antagomir组、I/R+agomir NC 组、I/R+antagomir NC 组,每组6只。
1.3 大脑中动脉I/R 损伤大鼠模型的建立 大鼠术前12 h 禁食,自由饮水。采用异氟烷吸入麻醉大鼠,颈部、头部备皮、消毒。剪开头部皮肤,取大鼠头部正中切口,以前囟为原点,应用脑立体定位仪进行定位(坐标:X=0.8 mm,Y=1.1 mm,Z=3 mm),用手持式微型电钻开一小孔,将miR-133b-3p agomir、miR-133b-3p antagomir 及其NC 注入各组大鼠右侧脑室,24 h后采用线栓法制备大鼠大脑中动脉I/R损伤模型。分离颈总动脉,颈内、颈外动脉,在右侧颈总动脉切一小口,将线栓经颈总动脉通过颈内动脉插入至大脑中动脉,闭塞大脑中动脉造成脑缺血,2 h后拔出线栓恢复血流,再灌注24 h。假手术组仅分离颈总动脉,未插入线栓。
1.4 神经行为学评分 再灌注24 h 后采用Longa评分法[7]对各组大鼠进行神经行为学评分。神经学检查分为5个等级,0分:正常,无神经功能缺损;1分:对侧前爪不能完全伸展,轻度神经功能缺损;2 分:行走时,大鼠向对侧(瘫痪侧)转圈,中度神经功能缺损;3 分:行走时,大鼠身体向瘫痪侧倾倒,重度神经功能缺损;4分:不能自发行走,有意识丧失。
1.5 qPCR 法检测大鼠miR-133b-3p 表达 I/R 24 h后断头取大鼠脑组织,使用TRizol 提取脑组织的总RNA,然后使用氯仿和异丙醇进行分离。使用Na‐no Drop 2000 测量总RNA 的浓度和纯度。大鼠miR-133b-3p 的引物序列为上游:5’-CTTTGGTCCCCTTCAACCAGCTA-3’,下游:5’-GTGCGTGTCGTGGAGTCG-3’。根据SYBR Premix Ex Taq Ⅱ试剂盒说明书进行逆转录和qPCR。使用Applied Biosystems 7500仪器进行PCR扩增反应。PCR 反应条件:95 ℃预变性30 s;95 ℃退火5 s,60 ℃延伸34 s,共40个循环。用2-ΔΔCt法计算miRNA 相对表达水平。
1.6 大鼠脑组织病理检查 取脑组织,石蜡包埋,切片,梯度酒精中脱水,苏木精染色5 min,伊红染色3 min,中性树脂封片。显微镜下观察大鼠脑组织病理形态变化。
1.7 原位末端标记(TUNEL)法检测神经元细胞凋亡 按照One Step TUNEL Apoptosis Assay Kit试剂盒(Roche 公司)说明书进行操作。制备脑组织切片,60 ℃烘烤1 h,二甲苯中脱蜡并用梯度酒精脱水,室温下用蛋白酶K 处理20 min,加入TUNEL 反应工作溶液,37 ℃下孵育1 h,PBS清洗,抗荧光衰减封片剂封片,荧光显微镜下观察TUNEL 染色结果并拍照。计算神经元细胞凋亡率,神经元细胞凋亡率=凋亡细胞数量/总细胞数量×100%。
1.8 miR-133b-3p 的靶基因分析 使用DIANA 数据库(融合了TarBase、microT-CDS和targetscan数据集)预测了miR-133b-3p 的靶基因[8],并进行了下游通路分析[9],同时分析靶基因上游相关的转录因子和激酶,并进行相互作用的网络构建[10]。
1.9 统计学方法 采用SPSS 20.0 软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 神经行为学评分与假手术组比较,I/R 组神经行为学评分明显升高(P<0.01);与相应NC组比较,I/R+agomir 组神经行为学评分明显升高(P<0.01),而I/R+antagomir 组神经行为学评分显著降低(P<0.05),见图1。
2.2 miR-133b-3p 表达水平 与假手术组比较,I/R组miR-133b-3p 表达水平明显下降(P<0.05);与I/R+agomir NC 组比较,I/R+agomir 组miR-133b-3p 表达量明显升高(P<0.01),与I/R+antagomir NC 组比较,I/R+antagomir 组miR-133b-3p 表达量显著降低(P<0.01),见图2。
2.3 苏木精-伊红(HE)染色结果 假手术组中,神经元细胞核大而圆,染色浅,核仁明显,而I/R 组中神经元出现萎缩,核深染和空泡现象(黄色箭头所示);与I/R+agomir NC组比较,I/R+agomir组可见大部分神经元萎缩(绿色箭头所示),神经元深染并出现明显的液泡变化,细胞间隙增大;相反,I/R+an‐tagomir组与其NC组比较,神经元损伤明显减少,神经元核染清晰可辨,见图3。
2.4 TUNEL 染色结果 与I/R 组比较,I/R+agomir组TUNEL 阳性细胞(红色荧光)数显著增加,I/R+antagomir可以显著逆转大鼠脑I/R 损伤引起的神经元凋亡,与I/R+antagomir NC 组比较,I/R+antagomir组细胞凋亡率明显降低(均P<0.01),见图4、图5。
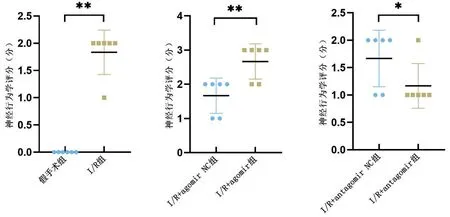
图1 miR-133b-3p对大脑中动脉I/R损伤大鼠神经行为学评分的影响
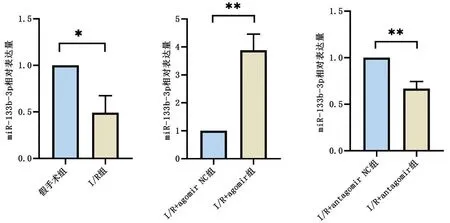
图2 大鼠miR-133b-3p相对表达量
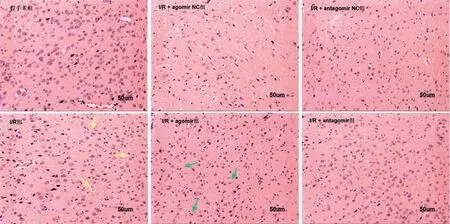
图3 大鼠脑组织切片HE染色(×200)
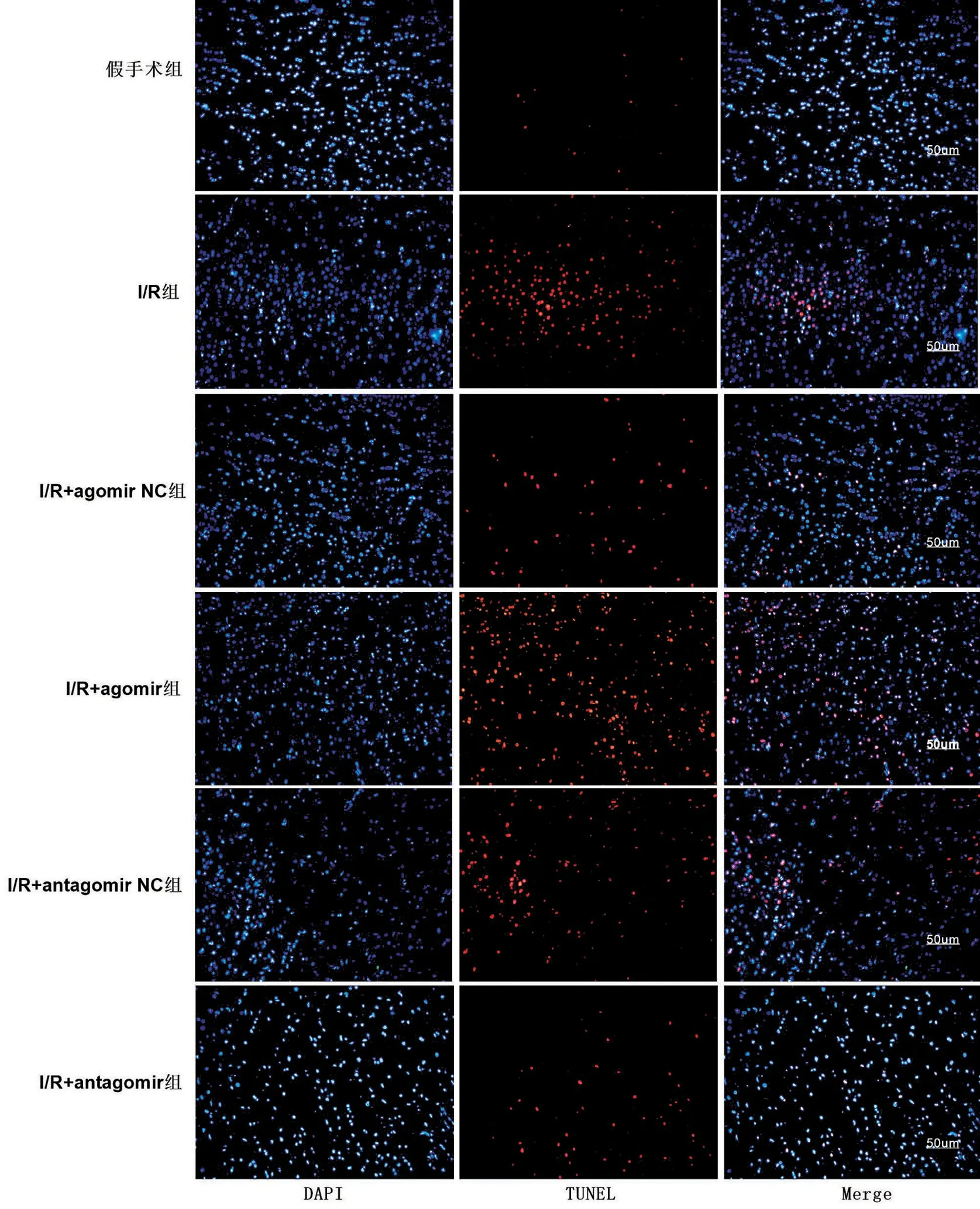
图4 大鼠脑组织切片TUNEL染色(×200)
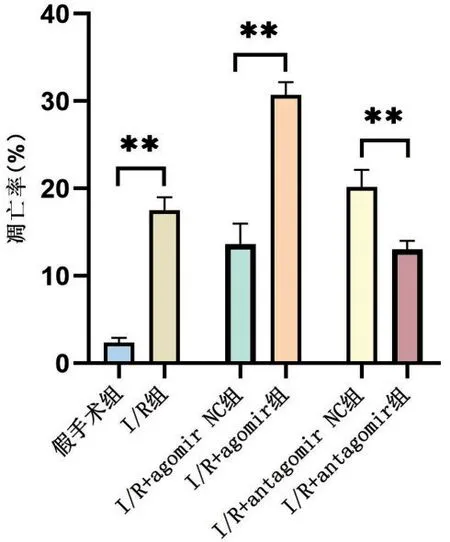
图5 6组大鼠神经元细胞凋亡率比较
2.5 KEGG 通路富集分析 为了进一步了解靶基因的生物学作用,使用webgestalt 数据库进行靶基因通路分析,结果发现,通路主要富集于自噬、加压素水吸收的调节及MAPK信号通路等,见表1。
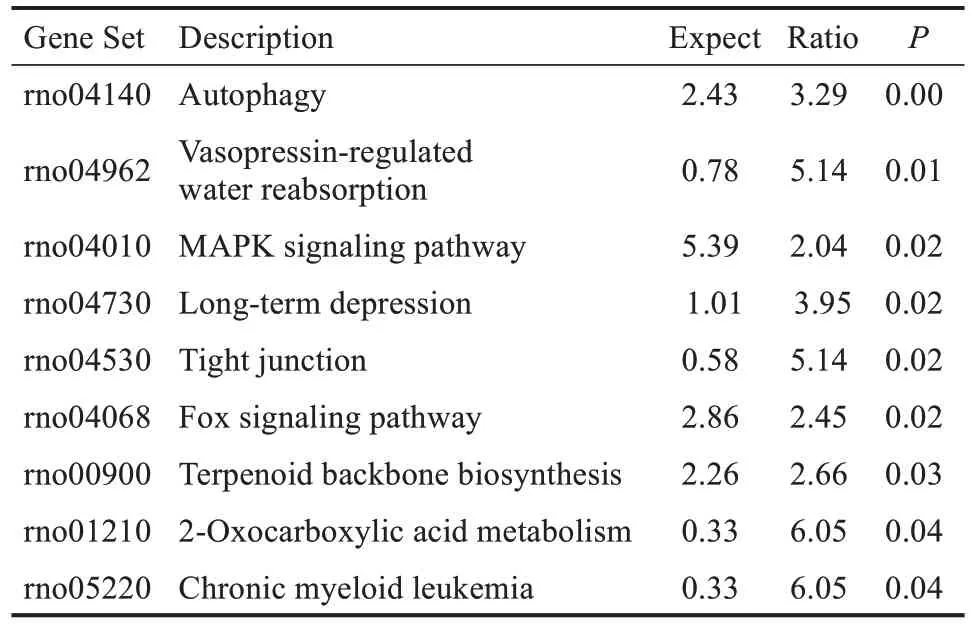
表1 靶基因生物学通路分析
2.6 上游调控网络分析 使用X2K 软件揭示miR-133b-3p 靶基因富集的前20 个转录因子和激酶,其中UBTF 和MAPK 为得分最高的转录因子和激酶。对这些靶基因、转录因子及激酶进行上游调控相互作用分析,通过eXpression2Kinases(X2K)算法将富集的转录因子-基因-激酶相连接,逐步构建完整的上游转录因子—基因—激酶交互网络,见图6。

图6 上游转录因子—靶基因—激酶交互网络
3 讨论
脑I/R 损伤是一个复杂的病理生理过程,受多种因素调节。当前miRNA已被证明在脑I/R损伤所致的神经元死亡中起重要的调节作用,从而影响疾病的发生和发展进程[11]。目前miR-133 主要在心肌梗死方面研究较多,如miR-133 抑制ROS 生成和抑制caspase-3 凋亡信号通路来预防心肌梗死[14-15],在脑I/R 损伤方面鲜有报道,值得进一步研究。本研究首次提供证据表明抑制miR-133-3p 表达在I/R 大鼠模型中发挥了神经保护作用。
研究表明,miR-133 可以通过靶向LASP1 来抑制细胞增殖并促进凋亡[16]。同时,抑制miR-133b-3p的表达可保护神经元细胞免受多巴胺诱导的死亡[17]。miR-133b 表达下调可抑制巨噬细胞的免疫反应,并通过MAML1 介导的Notch 信号通路减弱血管损伤[18]。本研究结果表明,miR-133b-pagomir能明显提高大脑中动脉I/R 损伤大鼠的神经行为学评分,加重大鼠神经元损伤,而注射miR-133-3p an‐tagomir 后,大鼠的行为学评分发生了逆转,神经元凋亡数减少(P<0.05)。说明抑制miR-133b-3p的表达可以起到保护大脑I/R 损伤的作用。miR-133b 是脑I/R 损伤的新型治疗靶点。HE 染色结果表明,与假手术组比较,I/R 组HE 染色核固缩深染,形状不规则,结构不清,核周胞质不明显;在注射miR-133-3p antagomir 的I/R 大鼠脑组织中,神经元核染清晰可辨,均匀分布,异染色质少。本研究HE 染色和TUNEL染色结果均表明,miR-133-3p下调可有效抑制大脑中动脉I/R大鼠的神经元损伤。
目前miRNA 的研究越来越多,但缺乏完整的miRNA 生物学功能和上、下游信号途径的分析。为了阐明miR-133-3p 可能涉及的上、下游机制,本研究使用生物信息学目标预测工具将UBTF和MAPK分别鉴定为miR-133-3p 的上游转录因子和激酶目标。转录因子和激酶可作为miRNA 和靶基因的重要调控因子,以不同方式参与调节神经发育和功能调节[19]。UBTF 可以使染色质结构固缩,从而导致神经元变性[20],同时UBTF 也可阻止细胞增殖并诱导细胞凋亡[21]。MAPK 是细胞内激酶,将细胞外环境的信号转化为精确的细胞内级联反应,并在细胞间同步调节各种生理过程,如细胞生长、分化、衰老和凋亡等功能[22]。同时,miR-133-3p 靶基因富集于自噬和MAPK 通路。以往的研究表明,自噬和MAPK 信号通路参与了卒中后细胞因子表达和细胞凋亡的调节,影响突触传递、神经元重塑等生物学过程[23-25]。在I/R 模型中,抑制MAPK 的激活可减少同侧皮质的氧化应激和凋亡,从而促进神经元存活和脑源性神经营养因子的释放,改善神经元的形态学变化。笔者推测,抑制miR-133-3p 表达可能通过抑制自噬和MAPK 通路的激活来发挥神经保护作用。
综上所述,miR-133-3p 在大脑中动脉I/R 大鼠中低表达,抑制miR-133-3p 表达可保护脑免受I/R损伤,但是miR-133-3p 影响靶基因上游的转录因子和激酶及下游的信号通路仍需进一步研究。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- Effect of miR-200a-3p targeting transthyretin(TTR)on the biological behavior of placental trophoblasts in hypertensive disorder complicating pregnancy
- 沙利度胺对重型β地中海贫血患者红系细胞γ珠蛋白基因表达及分化的作用研究*
- CEMIP调控Src/AKT/STAT3信号通路对非小细胞肺癌上皮间质转化及细胞侵袭、迁移的影响*
- 乳铁蛋白对正畸复发移动过程中牙周改建的影响*
- 秦皮苷对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响*
- 氯胺酮调控Akt/mTOR信号通路对大鼠肺缺血再灌注损伤的作用机制研究*
