秦皮苷对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响*
2021-03-03詹彦婷覃再嫩
詹彦婷,覃再嫩,郑 立△
(广西医科大学 1.广西生物医药协同创新中心 广西-东盟重大疾病预防协同创新中心;2.广西组织器官修复医用生物材料工程技术研究中心,南宁 530021)
骨关节炎(osteoarthritis,OA)作为一种致残率极高的疾病,给患者精神和经济都带来了沉重的负担[1]。OA 涉及整个关节的变化,包括透明软骨进行性丢失,软骨下骨发育不良、骨赘和骨包膜的厚度增加[2-3]。促进OA 发展的主要原因包括炎症介质过表达、降解酶的产生过多以及氧化应激等。其中,活性氧(ROS)引起的氧化应激能促进分解代谢,从而使软骨稳态遭到氧化及破坏,是软骨细胞损伤的主要原因[4]。目前,非甾体类抗炎药(NSAIDs)和阿片类的镇痛药已被应用于OA 的治疗,然而这些药物大部分情况下只能缓解OA 患者的症状,并且长期使用此类药物对人体会产生较大的副作用[5]。因此,在OA 的治疗策略上,可以采用抑制炎症、降低氧化应激和维持软骨代谢平衡的方法,有助于延缓OA的进展。
秦皮苷作为秦皮的有效成分,具有抑制炎症反应、减少氧化应激、降低肺血管通透性、护肝、护肾的作用[6]。研究发现,秦皮苷可以通过抑制核因子κB(NF-κB)和激活核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)信号通路,保护小鼠免于内毒素休克[7]。在脂多糖(LPS)诱导的急性呼吸窘迫综合征(ARDS)小鼠模型中,秦皮苷能下调炎症基因白介素(IL)-6、肿瘤坏死因子-α(TNF-α)和IL-1β 的表达,清除ROS,增加超氧化物歧化酶活性,从而避免氧化应激损伤[8]。在氧嗪诱导的高尿酸血症模型中,秦皮苷可以抑制肾脏中的相关转运体(如肾葡萄糖转运蛋白9 和尿酸转运蛋白1),从而使尿酸盐的排泄增加,达到抗高尿酸血症的目的[9]。然而,秦皮苷对LPS 诱导的OA 软骨细胞的作用和机制目前尚未见报道。本研究旨在探讨秦皮苷对炎症环境下软骨细胞的抗炎、抗氧化及软骨保护作用,以期为OA的治疗提供新思路。
1 材料与方法
1.1 药物和主要试剂 秦皮苷(纯度≥95%)(麦克林,中国);逆转录试剂盒(Fermentas Company,美国);LPS、青/链霉素、MTT 试剂、总RNA 提取试剂盒、苏木精-伊红(HE)染色试剂盒、番红O 染色试剂盒、总抗氧化能力(T-AOC)检测试剂盒(Solarbio,中国);二型胶原酶(Sigma,美国);钙黄绿素/乙锭均二聚物(Calcein-AM/EthD-I)染色试剂(百奥莱博,中国);ROS检测试剂盒(碧云天,中国);基质金属蛋白酶(MMP)-13 一抗、FITC 免疫荧光抗体(博士德,美国);胎牛血清、DMEM 培养基(Gibco,美国);引物(金开瑞,中国)。
1.2 实验动物 SPF 级雄性SD 大鼠,3~5 日龄,体重10~12 g,购自广西医科大学实验动物中心,许可证号:SYXK 桂2020-0004。本研究涉及的动物实验由广西医科大学实验动物伦理委员会批准,批准号:202010001。
1.3 T-AOC 检测 使用T-AOC 检测试剂盒评估秦皮苷的总抗氧化水平。在酸性状态下,秦皮苷能将Fe3+-三吡啶三吖嗪(Fe3+-TPTZ)还原,生成蓝色的Fe2+-TPTZ。秦皮苷按照对倍稀释的方法配置成不同浓度(0 µg/mL、0.3125 µg/mL、0.625 µg/mL、1.25µg/mL、2.5 µg/mL、5 µg/mL、10 µg/mL、20 µg/mL、40 µg/mL、80 µg/mL、160 µg/mL)的溶液,取秦皮苷溶液30 µL,工作液900 µL 和双蒸馏水90 µL,充分混合,室温条件下孵育10 min,加入100 µL 的混合液于96 孔板,并用酶标仪检测593 nm 处的吸光度(OD)值。
1.4 软骨细胞的提取、培养及鉴定 麻醉处死大鼠,备皮,用75%酒精消毒背部及四肢皮肤,无菌操作下取下双侧股骨头及膝关节(保留周围肌肉,软骨不能暴露),置于含1%的青/链霉素的PBS 中,去除软骨周围组织,将软骨剪为1 mm×1 mm×1 mm 的小块,胰蛋白酶消化30 min,含2 mg/mL的Ⅱ型胶原酶37 ℃下消化4 h,1 000 r/min 离心5 min,收集并重悬细胞于DMEM 培养基,置于37 ℃、5%CO2培养箱中培养。每两天换1次液,待细胞密度约为90%时,对细胞进行传代,使用第3 代细胞进行后续实验。通过HE染色和番红O染色法进行软骨细胞鉴定。
1.5 MTT法检测软骨细胞增殖率 通过MTT法检测软骨细胞增殖率,以评价秦皮苷对软骨细胞的毒性作用,具体步骤:将软骨细胞接种于96孔板,待细胞充分贴壁后,加入100 µL 浓度分别为0 µg/mL、0.312 5 µg/mL、0.625 µg/mL、1.25 µg/mL、2.5 µg/mL、5 µg/mL、10 µg/mL、20 µg/mL、40 µg/mL、80µg/mL 的秦皮苷溶液,培养24 h,弃去培养基,PBS清洗,换新培养基,加入MTT 试剂10 µL,置于37oC 培养箱中,4 h 后将培养基弃去,加入DMSO 100µL,37oC 避光孵育15 min,用酶标仪检测490nm 处各孔的OD 值。细胞增殖率=[(实验组OD-空白调零孔OD)/(对照组OD-空白调零孔OD)]×100%。实验重复3次。
1.6 细胞分组和干预 将细胞分为对照组、模型组和处理组。对照组只加入完全培养基,模型组加入含10 µg/mL LPS 的完全培养基,处理组先提前1 h加入含10µg/mL LPS 的培养基诱导软骨细胞损伤,随后加入5µg/mL 秦皮苷的完全培养基。将细胞种植于6孔板中,待24 h细胞贴壁后,经过相应的药物处理24 h 后,收集细胞。通过HE 染色和番红O 染色法评价秦皮苷对LPS诱导OA软骨细胞的作用。
1.7 Calcein-AM/EthD-I 染色检测细胞活性 将细胞爬片置于6 孔板中,调整细胞密度为2×105个/孔,待细胞密度达到80%~90%时,药物处理24 h,PBS清洗3次,加入0.05%Calcein-AM 和0.2%EthD-I染色试剂在暗室中37oC 孵育5 min,PBS 清洗掉荧光试剂,在荧光显微镜下观察细胞的生存情况并拍照,用Image J 软件统计活细胞和死细胞数目,计算细胞增殖率。
1.8 二氯荧光黄双乙酸盐(DCFH-DA)荧光探针检测软骨细胞内ROS 按照1∶1 000 的比例用无血清培养基稀释DCFH-DA荧光探针,使终浓度为10µmol/L。弃去细胞培养基,加入0.5 mL DCFH-DA 荧光探针稀释液,在37oC的CO2培养箱中避光孵育20 min,每3~5 min混匀1次,用无血清培养基将爬片洗涤3遍,在荧光显微镜下观察细胞的荧光强度,用Image J 软件分析荧光强度的平均值,荧光强度越强,细胞内的ROS水平越高。
1.9 免疫荧光染色检测软骨细胞MMP-13 的分泌情况 用PBS 洗涤细胞爬片3 次后,将细胞爬片置于3% H2O2中孵育15 min,PBS 洗涤3 次,与山羊血清温育15 min,弃去血清;滴加一抗(MMP-13,1∶100)37oC孵育4 h,PBS洗涤3次;二抗(FITC-抗兔IgG,1∶100)37 ℃避光孵育1 h,PBS清洗3次,吸去水分,荧光显微镜下观察荧光图像并拍照,用Image J软件分析荧光强度的平均值,绿色荧光强度越强,MMP-13的水平越高。
1.10 实时荧光定量聚合酶链反应(qPCR)检测相关基因的表达 提取细胞RNA,逆转录为cDNA,使用LightCycler®96 实时荧光定量PCR 仪(Roche,瑞士)进行qPCR反应,用GADPH作为内参,检测炎症基因IL-6、MMP-3、MMP-13 和诱导型一氧化氮合酶(iNOS)以及软骨特异性基因Col2al 的表达情况。引物序列见表1。实验重复3次,采用2-ΔΔCt法计算目的基因相对表达量。
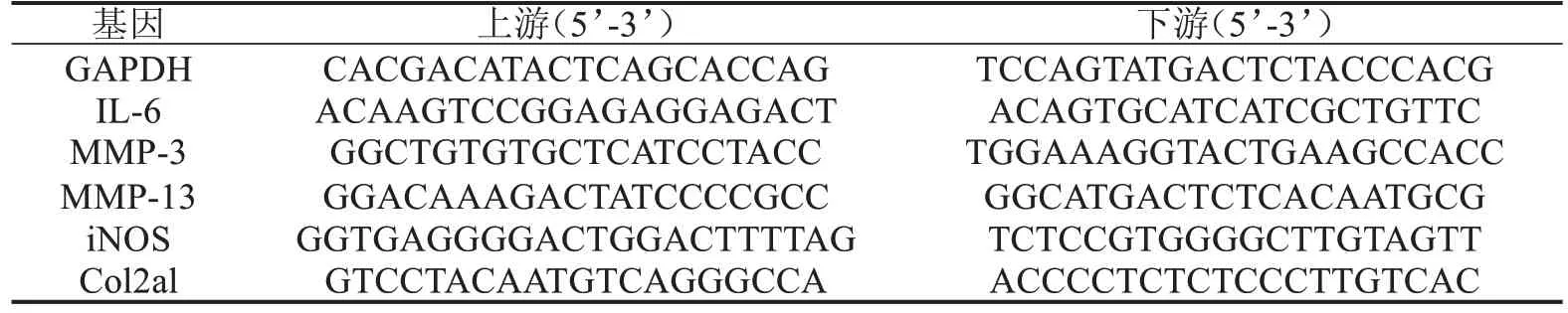
表1 PCR引物序列
1.11 统计学方法 采用SPSS22.0统计软件对实验数据进行分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用SKN-q检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 秦皮苷的T-AOC 在秦皮苷浓度为1.25 µg/mL时,总抗氧化水平较高(P<0.05),并且随着秦皮苷浓度的增加,总抗氧化水平也相应升高(图1),表明秦皮苷具有良好的抗氧化的能力。
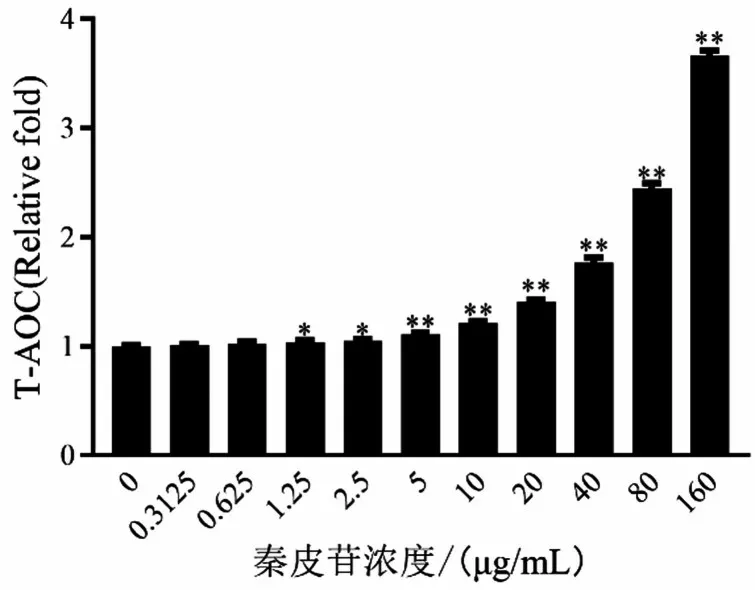
图1 秦皮苷的T-AOC
2.2 软骨细胞的鉴定结果 HE 染色显示:细胞形态呈多边形或椭圆形(图2A),符合软骨细胞形态特征。番红O 染色中,碱性染料与细胞蛋白多糖结合,使细胞变为红色(图2B),细胞具有分泌蛋白多糖的功能,表明提取的细胞为软骨细胞。
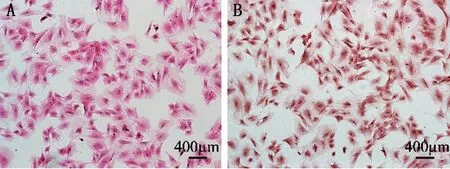
图2 SD大鼠软骨细胞的鉴定
2.3 秦皮苷对软骨细胞的毒性作用 秦皮苷浓度低于5µg/mL 时,对软骨细胞无明显毒性(P>0.05)(图3)。因此,选择5 µg/mL 作为秦皮苷的工作浓度。
2.4 秦皮苷对LPS 诱导OA 软骨细胞的作用 HE染色结果显示:对照组软骨细胞形态正常,模型组软骨细胞数量较对照组明显减少,细胞呈长梭型,与成纤维细胞形态类似;与模型组相比,秦皮苷处理后软骨细胞形态改善,细胞数量显著增加,形态接近于正常软骨细胞(图4),表明秦皮苷可以维持软骨细胞的正常形态。
番红O 染色显示:对照组有大量蛋白多糖分泌,经LPS 处理后,模型组颜色变浅,蛋白多糖的分泌量(红色细胞数)显著减少,且经秦皮苷处理后,蛋白多糖分泌量(红色细胞数)明显高于模型组(图5),说明秦皮苷可以促进蛋白多糖的分泌。
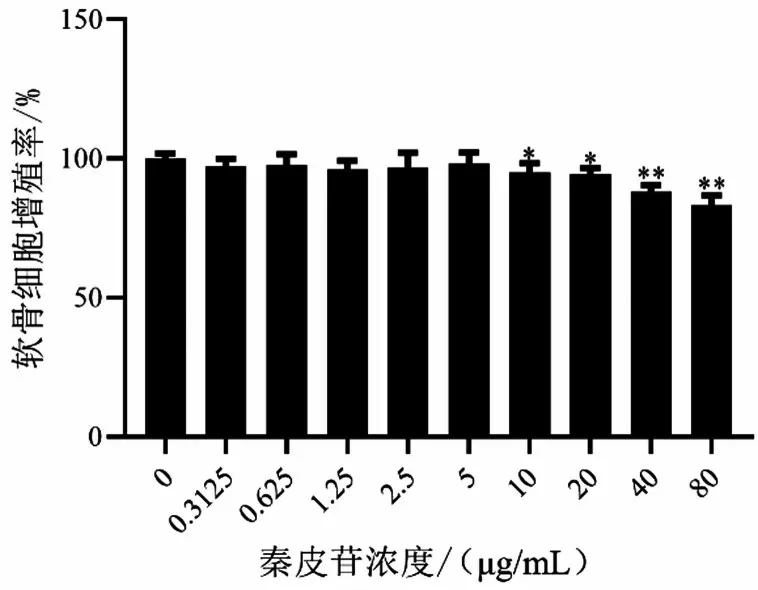
图3 MTT检测秦皮苷对软骨细胞的毒性作用
2.6 3 组软骨细胞活力比较 与对照组比较,模型组存活细胞数量显著减少,细胞增殖率下降(P<0.001);经秦皮苷处理后,与模型组相比,处理组存活细胞数量增加,细胞增殖率升高(P<0.001)(图6),表明秦皮苷能促进软骨细胞的增殖。
2.7 3 组细胞内ROS 水平比较 与对照组比较,模型组荧光强度明显提高(P<0.001),说明细胞内的ROS 水平显著升高;与模型组相比,处理组荧光强度明显降低(P<0.001),说明细胞内的ROS 水平明显降低,见图7。
2.8 3组软骨细胞MMP-13表达比较 与对照组相比,模型组MMP-13 的表达升高(P<0.001);与模型组相比,处理组MMP-13 表达明显降低(P<0.001),见图8。
2.9 3组软骨细胞特异性基因及炎症相关基因表达比较 模型组IL-6、MMP-3、MMP-13 和iNOS 基因的表达均高于对照组(P<0.001),软骨特异性基因Col2al 的表达降低(P<0.001)。与模型组相比,处理组炎症基因IL-6、iNOS、MMP-3 和MMP-13 的表达明显降低(P<0.05),软骨特异性基因Col2al的表达升高(P<0.05)(图9)。提示秦皮苷可以逆转炎症相关基因及软骨特异基因的表达。
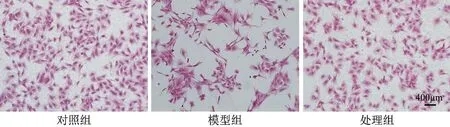
图4 细胞HE染色图(×100)
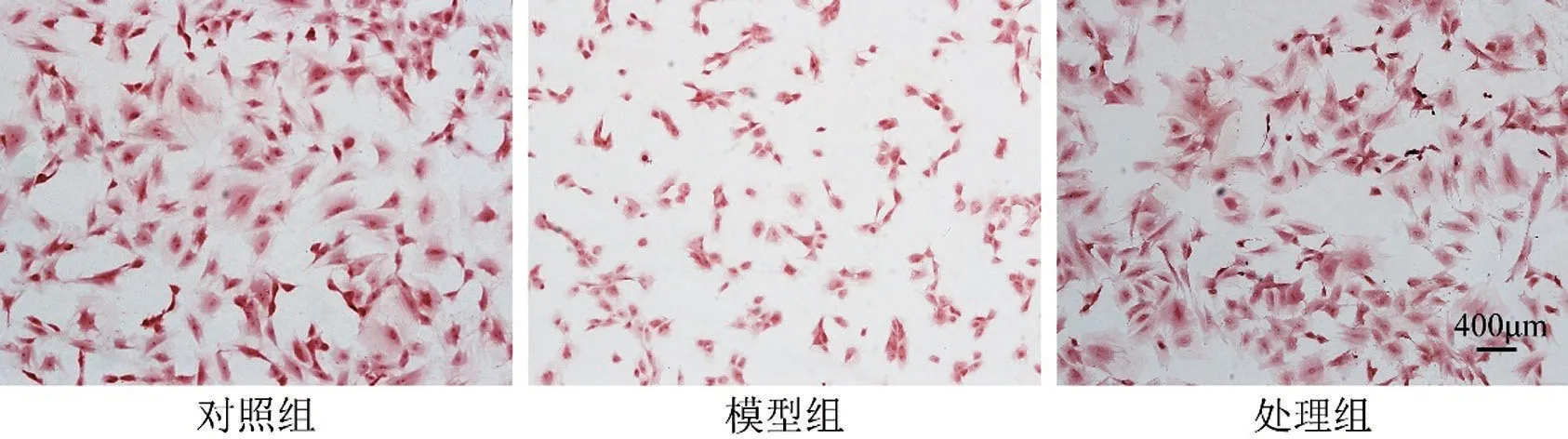
图5 细胞番红O染色图(×100)
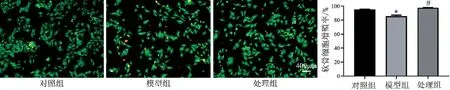
图6 Calcein-AM/EthD-I染色检测细胞的活性
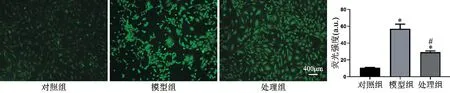
图7 荧光探针检测细胞内的ROS
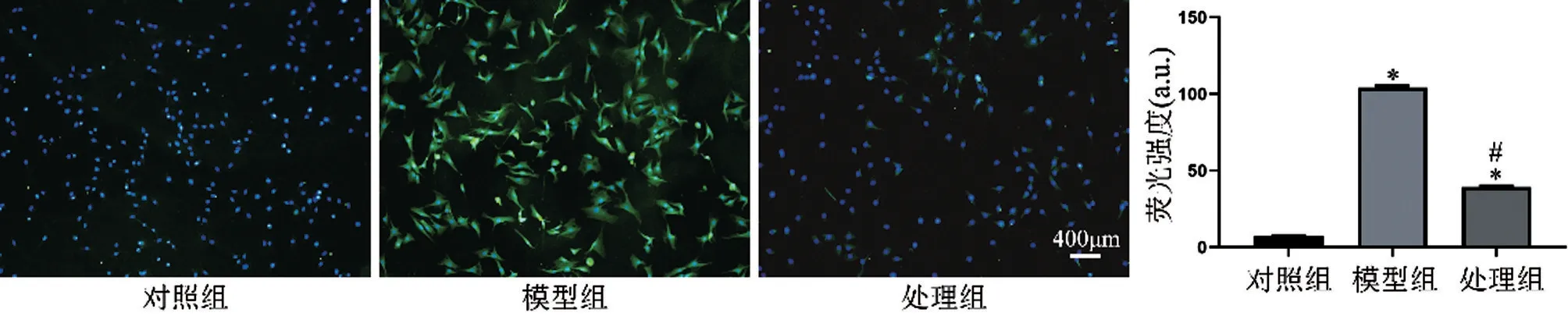
图8 免疫荧光染色显示MMP-13的表达情况

图9 特异性软骨基因和炎症相关基因的表达
3 讨论
OA 作为一种慢性退行性病变,多涉及关节软骨,软骨下骨和滑膜等部位[10]。软骨变性的最关键特征是基质降解酶(包括MMP 和蛋白聚糖)的上调。研究表明,由炎症介质过度表达引起的氧化应激可导致分解代谢酶增加,细胞外基质降解,OA 症和软骨细胞凋亡,从而促进了OA 的整体进展[11]。秦皮是临床常用的中药,具有清热解毒、消炎、抗氧化、抗菌、抗高尿酸血症和平喘止咳等功能[12-14]。秦皮苷是秦皮的有效活性成分,在LPS 诱导的ARDS小鼠模型中,具有明显的抗炎及抗氧化的作用。但目前尚未有研究报道秦皮苷对OA 的作用,本研究探讨了秦皮苷对LPS 诱导的体外OA 模型的影响。结果发现,在一定浓度范围内,秦皮苷具有抑制软骨细胞外基质降解、减少炎症介质和抗氧化作用,在一定程度上延缓了OA的进展。
关节软骨周围有大量的细胞外基质,而基质仅由软骨细胞产生,一旦受损,关节软骨内源性修复困难[15]。细胞外基质的主要成分是胶原和蛋白多糖,细胞外基质合成与降解的不平衡是导致OA 的主要因素[16]。因此,维持细胞外基质分解代谢的平衡,对于OA 的治疗具有至关重要的作用。MTT 结果显示,5 μg/mL 的秦皮苷对软骨细胞无毒性,Cal‐cein-AM/EthD-I染色结果表明,秦皮苷在该浓度下,能促进软骨细胞的增殖,抑制细胞的凋亡。蛋白多糖作为软骨细胞外基质的重要组成部分,其分泌的减少不利于软骨的生长,而蛋白多糖的分泌的增加则有助于调节细胞外基质稳态[17]。HE 和番红O 染色结果显示,秦皮苷能维持软骨细胞的正常形态,增加蛋白多糖的分泌,对软骨起保护作用。MMPs参与胶原降解,MMP-13是软骨分解代谢的关键酶,其过表达会导致细胞外基质降解[18-19]。MMP-13 在软骨细胞的分解代谢活动中起着重要的作用,抑制MMP-13 的表达有助于保护软骨[20]。本研究结果显示,秦皮苷能抑制MMP-3和MMP-13的表达(均P<0.05),有利于维持软骨分解代谢的平衡,避免细胞外基质的降解。此外,秦皮苷可上调软骨特异性基因Col2al的表达(P<0.001),提示秦皮苷能促进Ⅱ型胶原的合成,间接促进软骨细胞外基质的形成。
过量ROS 引起的氧化应激是引起软骨降解和OA 的主要原因,清除ROS 可以抑制氧化应激,对OA 的治疗起着重要的作用[21]。T-AOC 结果表明,秦皮苷具有良好的抗氧化性能,并且随着秦皮苷浓度的增加,其抗氧化能力也增加。DCFH-DA 荧光探针的结果也表明了秦皮苷具有清除软骨细胞内ROS、抑制氧化应激的作用。研究表明,炎症对OA的发展起着重要的作用,炎症因子的过度表达往往导致骨与软骨的破坏[22]。因此,抑制炎症因子的过表达有助于延缓OA 的进展。据文献报道,秦皮苷能通过降低炎性介质IL-1β 和IL-6 的表达,抑制JAK/STAT 和激活NF-κB 信号通路,以达到缓解肺炎克雷伯菌所致重症肺炎症状的目的[23]。本研究qPCR 结果显示,秦皮苷能抑制LPS 诱导IL-6、iNOS的过度表达(均P<0.05),表明秦皮苷能抑制LPS诱导的炎症,以发挥对软骨的保护作用。
综上所述,秦皮苷可以抑制炎症因子和分解代谢基因的过表达,促进软骨特异性基因的上调,清除ROS,对软骨细胞具有良好的抗炎、抗氧化和保护作用。因此,秦皮苷在LPS 诱导的体外OA 模型中具有抗氧化、抗炎的作用,其有望应用于OA 的治疗,作用机制有待进一步研究。
