尖叶假龙胆对酒精性肝损伤模型大鼠脂代谢及氧化-抗氧化系统的影响
2021-03-02孙爽朴圣爱张双良李响赵启腾郭钟秀胡晓阳
孙爽 ,朴圣爱 ,张双良,李响,赵启腾,郭钟秀,胡晓阳,4*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040; 2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;3.河北省沧州中西医结合医院,河北 沧州 061000; 4.鸡西市人民医院医疗集团,黑龙江 鸡西 158100)
酒精性肝损伤(alcoholic liver disease,ALD)是指长期过量饮用含有乙醇成分的酒水所造成的肝脏代谢紊乱。酒精对肝脏的损害是逐步积累的,进入体内的酒精,只有少部分可以通过肺脏呼吸作用和肾脏尿液排出体外,但是体内剩余的乙醇会在肝脏中进行代谢,并主要经乙醇脱氢酶(ADH)与微粒体乙醇氧化酶体系(MEOS)进行代谢。酒精经ADH和MEOS等代谢过程中发生的氧化应激反应是ALD的一个重要原因[1]。现代人由于超量饮酒引发的ALD人群逐年上升,因此关于防治ALD的中医药研究意义重大。
尖叶假龙胆(Gentianellaacuta)属于龙胆科假龙胆属,也称苦龙胆。大部分产于大兴安岭、蒙古高原等地,作为地方药以全草入药,具有护肝的作用[2-3]。尖叶假龙胆可用于解酒,同时还会减轻宿醉导致的恶心欲呕、乏力等症状。前期研究表明[4],尖叶假龙胆具有明显的抗氧化活性以及调节体内天冬氨酸转移酶和超氧化物歧化酶等水平,而在长期饮用酒精类饮品后的ALD患者,使体内乙醇代谢过程增强,加重肝脏内的氧化应激反应、并通过某些酶激活相关基因的表达而产生,因此推测尖叶假龙胆可能具有防治ALD的功能。
1 材料
1.1 实验动物
实验动物由黑龙江中医药大学动物实验中心提供,60只雄性Wistar大鼠平均体质量为(200±20)g,许可证编号:SCXK(黑)2018-001,符合药理学实验相关要求。将大鼠在可控温度的实验室条件下饲养,给予标准食物与水。本实验按照国家实验动物保护和使用指南,并经本单位实验动物伦理委员会批准后进行。
1.2 药物
阳性对照药物采用吉林通化东宝药业股份有限公司生产的东宝甘泰片。尖叶假龙胆样品经王振月教授鉴定为Gentianellaacuta的全草。样品信息见表1。

表1 样品信息
1.3 试剂与仪器
ADPN、TNF-α、NEFA、MDA、ALDH、ADH测定试剂盒:上海联硕生物科技有限;MIKRO22/22R台式(常温/冷冻)离心机:德国Hettich公司;Infinite M200 pro多功能酶标仪:瑞士Tecan公司;SZ-96自动纯水蒸馏器、恒温水浴锅:上海亚荣生化仪器厂;紫外分光光度计:日本岛津制作所;DH4000AB型电热恒温培养箱:天津市泰斯特仪器有限公司;CS213电热烤箱:重庆仪器设备厂;LEICA-RM2135组织切片机:德国莱卡公司;Nikon 50i型正置显微镜:日本尼康公司。
2 方法
2.1 药物制备
取东宝甘泰片粉碎后置于量瓶中,加蒸馏水溶解并稀释成0.04 g/mL的溶液,阳性药组大鼠给药量为10 mL/(kg·d),即给药量为0.4 g/d,相当于临床成人常用量的6.25倍。
称取1 kg尖叶假龙胆全草,粉碎后,置圆底烧瓶中,加入20 L 75%乙醇浸泡2 h,加热回流提取过滤,重复2次,合并滤液。将所得滤液分多次置旋转蒸发器中进行减压浓缩,从而得到尖叶假龙胆浸膏。取出尖叶假龙胆浸膏(按原生药材1 kg计),置2 000 mL量瓶中,加蒸馏水溶解并稀释至2 L,即为高剂量组服用剂量,相当于含生药材浓度为0.50 g/mL;取出1 L高剂量组服用溶液1 L,置2 L量瓶中,加蒸馏水至2 L,即为中剂量组服用剂量,相当于含生药材浓度为0.25 g/mL;按照相同方法,取中浓度1 L,加蒸馏水1 L,即为低剂量组,相当于含生药材浓度为0.13 g/mL。
2.2 分组、造模及给药
将60只Wistar大鼠随机分为6组,空白组、模型组、阳性药组各10只,尖叶假龙胆剂量组分为高中低3个剂量组,每组10只。60只大鼠在适应性饲养1周后,除空白组给予生理盐水外,其他各组均使用梯度50%酒精灌胃方法进行造模[4](梯度酒精灌胃造模方法为第1周2 mL/kg,第2周4 mL/kg,第3周6 mL/kg,从第4周开始到第8周结束7 mL/kg),均在上午进行。于第7、8周每日下午分别给予高、中、低剂量组大鼠相应浓度的尖叶假龙胆稀释液10 mL/kg,阳性药组给予东宝肝泰稀释液10 mL/kg,空白组、模型组给予生理盐水10 mL/kg。造模后,各组大鼠均有死亡,至第8周,空白组、阳性药组、高剂量组、低剂量组大鼠各死亡1只、模型组、中剂量组大鼠各死亡2只。
2.3 取材及检测
第8周末最后一次给药后,22:00时开始禁食水,12 h后,用20%乌拉坦溶液5 mL/kg腹腔注射麻醉后,腹主动脉取血,4 ℃ 3 500 r/min离心10 min,分离血清,-80 ℃冰箱冻存,测试前先于恒温水浴锅中37 ℃复温,应用多功能酶标仪和紫外分光光度计检测样本ADPN、TNF-α、NEFA浓度,得出数据并做记录。同时在腹主动脉取血后,迅速取出肝脏,剪取1 g肝组织,加9 g生理盐水于手动匀浆器中,置于冰水混合物中充分研磨,得10%组织匀浆,倒入离心管中于低温冷冻离心机中4 ℃ 3 500 r/min离心10 min,吸取上清液,移至编号的EP管中,置于-80 ℃冰箱中保存备用,测试前先于恒温水浴锅中复温,然后采用多功能酶标仪和紫外分光光度计检测ALDH、ADH、MDA水平,得出数据并记录。并于肝右叶相同部位取材,及时将其放入各组多聚甲醛溶液中浸泡1周,后乙醇溶液脱水、二甲苯透明、浸蜡包埋、切片(片厚5 μm),采用HE染色,具体方法:石蜡切片脱蜡至水, 苏木素染液染色10 min,充分水洗,1%盐酸乙醇分色1 s,充分水洗,自来水返蓝10 min,伊红染液染色30 s,充分水洗,中性树脂封片,光镜下观察肝组织病理形态学变化。
2.4 统计学处理
采用SPSS22.0统计软件对数据进行处理,每组数值以均值±标准差表示,各组之间的比较使用单因素方差分析以及Dunnett's检验,本实验中,检验水准定为α=0.05,以P≤0.05作为差异具有统计学意义。
3 结果
3.1 尖叶假龙胆对ALD大鼠血清中ADPN、TNF-α、NEFA水平的影响
与空白组相比,模型组大鼠血清ADPN水平明显降低(P<0.01),差异极显著;与模型组相比,阳性药组、尖叶假龙胆高剂量组大鼠血清ADPN水平明显升高(P<0.05),差异显著;与阳性药组相比,尖叶假龙胆高剂量组血清ADPN水平明显升高(P<0.05),差异显著;与尖叶假龙胆高剂量组相比,中、低剂量组血清ADPN水平明显偏低(P<0.05),差异显著;与尖叶假龙胆中低剂量组相比,血清ADPN水平无明显差异(P>0.05)。结果见表2。
与空白组相比,模型组大鼠血清TNF-α含量明显升高(P<0.05),差异显著;与模型组相比,阳性药组、尖叶假龙胆高、中、低剂量组TNF-α含量明显降低(P<0.05),差异显著;与尖叶假龙胆高剂量组相比,尖叶假龙胆中、低剂量组TNF-α含量明显偏高(P<0.05),差异显著;与尖叶假龙胆中剂量组相比,尖叶假龙胆低剂量组TNF-α含量明显偏高(P<0.05),差异显著。结果见表2。
与空白组相比,模型组大鼠血清NEFA浓度明显升高(P<0.05),差异显著;与模型组相比,阳性药组大鼠血清NEFA浓度升高,尖叶假龙胆高、中、低剂量组浓度明显降低,尖叶假龙胆高剂量组NEFA浓度降低幅度最大(P<0.05),差异显著;尖叶假龙胆高、中、低三剂量组NEFA浓度逐渐升高,高剂量组浓度最低(P<0.05),差异显著。结果见表2。
3.2 尖叶假龙胆对ALD大鼠肝组织中ALDH、ADH、MDA含量的影响
与空白组相比,模型组大鼠肝组织中ALDH浓度降低(P<0.05),差异显著;与模型组相比,阳性药组、尖叶假龙胆低剂量组ALDH含量变化不明显(P>0.05);尖叶假龙胆高、中剂量组ALDH含量明显升高(P<0.05),差异显著;尖叶假龙胆高、中、低剂量组之间相比,ALDH含量逐渐降低(P<0.05),差异显著。结果见表3。
与空白组相比,模型组大鼠肝组织中ADH活力明显降低(P<0.05),差异显著;与模型组相比,阳性药组、尖叶假龙胆高、中、低剂量组ADH活力明显升高(P<0.05),差异显著;与阳性药组相比,尖叶假龙胆高、中剂量组ADH活力明显升高(P<0.05),差异显著;尖叶假龙胆低剂量组ADH活力变化不明显(P>0.05)。结果见表3。
与空白组相比,模型组大鼠肝组织MDA含量明显升高(P<0.05),差异显著;与模型组相比,阳性药组、尖叶假龙胆低剂量组MDA含量变化不明显(P>0.05),尖叶假龙胆高、中剂量组MDA含量明显降低(P<0.01),差异极显著;高、中剂量组MDA含量变化不明显(P>0.05);与高、中剂量组相比,低剂量组MDA含量明显升高(P<0.05),差异显著。结果见表3。

3.3 尖叶假龙胆对ALD大鼠肝组织病理学的影响
空白组大鼠肝小叶结构完整,肝细胞排列成索,围绕中央静脉以辐射状排列,细胞大小基本一致,呈多边形,可见双核,细胞内未发现明显腔泡,肝小叶内和肝小叶间未发现明显纤维组织增生,见图1a。模型组大鼠可见多个区域肝小叶结构破坏,肝索排列杂乱,肝窦间隙增大,中央静脉周围的肝细胞肿大明显,胞质浅染,并有水样、气球样变性,可见大量炎性细胞浸润,距离中央静脉较远的肝细胞内出现大小不等的空泡,可见有明显脂肪变性,见图1b。阳性药组大鼠紊乱排列的肝小叶数量较模型组少,中央静脉周围的肝细胞胞质染色比模型组深,水样变性也较轻,远离中央静脉的肝细胞内空泡较小,而且数量较模型组少,见图1c。尖叶假龙胆各剂量组肝脏组织结构紊乱的肝小叶数量较模型组少,炎症反应轻,炎性细胞浸润程度轻微。其中高剂量组更接近空白组,虽有少量脂肪沉积,但无纤维组织增生。见图1d、1e、1f。
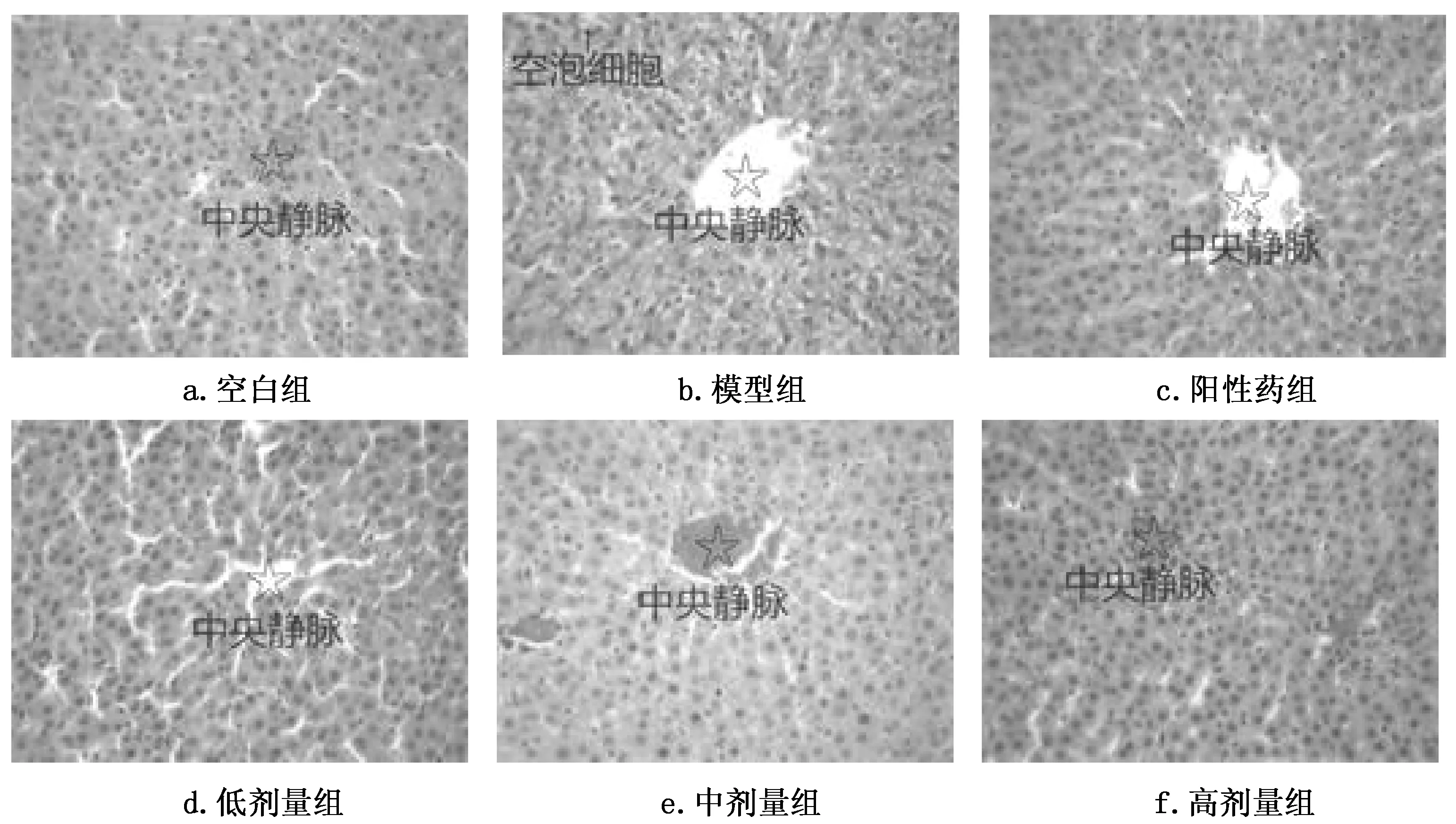
图1 尖叶假龙胆对ALD大鼠肝组织病理学的影响(HE 200×)
4 讨论
ADPN是一种内源性生物活性多肽或蛋白质,由脂肪细胞分泌,对机体具有广泛的保护作用[5],Bertolani C等人研究表明[6],肝脏病变时出现ADPN的水平失调,会导致一系列肝脏问题。研究表明[7]ALD的发生与血清ADPN水平下降、肝脏细胞ADPN受体表达下降、肝细胞内ADPN传导通路受损有关,ADPN通过调节信号传导,能够对ALD提供保护作用。有关实验研究发现[8-9]通过某些饮食或药物诱导的ADPN表达可以阻止或延缓ALD的进展。虽然ADPN发挥保护ALD的分子作用机制尚未明确,但有一点可以被证明,ADPN是通过调节一个复杂的信号网络系统从而发挥保护作用,最终使得肝脏脂质累积的下降[6]。TNF-α是由激活后的单核-巨噬细胞产生的一种单核细胞因子[10],是肝细胞损伤发生过程中的主要参与因子之一。相关研究表明TNF-α介导了内毒素对肝损伤的作用,同时在乙醇、四氯化碳等化学物质引起的肝脏损伤过程中起到了重要的促炎介质作用[11]。可能机制有如下几点:介导脂类介质产生,诱导氧自由基产生,诱导一氧化氮的产生,活化中性粒细胞,诱导肝细胞凋亡[12]。总之,TNF-α引起的肝损伤是一个复杂的过程,TNF-α不但能直接损伤肝细胞,而且可以通过诱导产生炎症介质、激活中性粒细胞等途径产生间接毒性作用。ADPN可以抑制TNF-α的产生,同时减少TNF-α的释放,双管齐下,减轻ALD的病理反应。NEFA通过内源性和外源性两种途径来促进肝脏细胞的破坏凋亡,并促进促炎因子的合成,从而导致肝细胞炎性损伤[13]。尖叶假龙胆通过降低血清中NEFA的浓度来减轻炎性损伤,从而减轻ALD的病理反应。
已有研究证实[14],ADH和ALDH在肝脏分解代谢外来酒精过程中发挥了重要作用。首先乙醇会在ADH的作用下代谢为乙醛,然后乙醛会在线粒体ALDH作用下代谢为乙酸,最终乙酸通过三羧酸循环代谢成为终产物二氧化碳和水[15]。尖叶假龙胆通过升高肝组织中ALDH、ADH浓度来促进乙醇的代谢,从而对ALD产生保护作用。MDA是一种具有细胞毒性的过氧化产物,通过检测肝组织中MDA水平变化可以反映肝细胞膜脂质氧化应激程度[16],说明尖叶假龙胆可以抑制体内的脂质过氧化作用,从而保护肝脏。
上述实验表明,尖叶假龙胆对ALD具有保护作用,其机制可能是尖叶假龙胆可以促进ADPN的生成,增加脂质代谢,促进ALDH、ADH的分泌,加快肝脏分解代谢外来酒精,降低TNF-α、NEFA、MDA水平,减少酒精对肝脏造成的氧化损伤。
