基于代谢组学技术的麻黄汤对发热模型大鼠解热作用的初步研究
2021-03-02付新刘阳栾诣晗郑淇匡海学
付新,刘阳,栾诣晗,郑淇,匡海学
(黑龙江中医药大学 教育部北药基础与应用研究重点实验室,黑龙江省中药及天然药物药效物质基础研究重点实验室,黑龙江 哈尔滨 150040)
麻黄汤为著名的中药传统经典方剂,出自汉代张仲景的《伤寒论》[1]。麻黄汤由麻黄、桂枝、杏仁、炙甘草四味中药组成,是一个被广泛应用的经典复方。现代药理学研究表明,这四味中药的组方配伍对感冒、流涕、哮喘等疾病具有显著的疗效[2]。在中国,虽然麻黄汤在临床上被广泛应用于发热病人的治疗上,但是关于麻黄汤的解热作用机制研究报导却很少。有研究报道,通过GC-MS气质联用技术,麻黄汤中有40种化学成分被鉴定。通过UPLC-Q/TOF-MS的液质联用技术在麻黄汤中发现了39种化合物,同时,麻黄汤中的麻黄碱,甲基麻黄碱,苦杏仁苷,甘草酸在比格犬血浆中被发现和鉴定[3-5]。2018年,麻黄汤成为了国家中医药管理局公布的第一批古代经典名方[5]。事实上,麻黄汤的作用机制还不清楚,中药复方研究对于科研工作者是一个巨大的挑战。
1 材料
1.1 动物
Wistar清洁级大鼠,雄性,体质量为(200±20)g,黑龙江中医药大学动物实验中心提供,许可证号(HUCM-201506912)。所有大鼠在室内保持12 h光照、12 h避光循环饲养,控制室内温度为(23±2)℃ 、相对湿度在(60±5)%,并在代谢笼中适应1周。给予饮用水和标准饲料。
1.2 仪器
美国超高效液相色谱仪(UPLC-Q/TOF-MS),工作站MassLynxV4.1,HSS T3色谱柱(2.1 mm×100 mm,1.7 μm,UK),欧姆龙牌电子数字式温度计MC-612型,赛多利斯牌电子天平,KQ-50B超声波清洗器(杭州微米派科技有限公司)。
1.3 药品
所选麻黄(批号:1410030M;检索号:2014-CP-10038)产自内蒙古,桂枝(批号:1312010S;检索号:2013-CP-012023)产自广东省,苦杏仁(批号:1401074ch;检索号:2014-CP-01106)产自河北省,甘草(批号:1503036M;检索号:2014-CP-03027)产自内蒙古。经黑龙江中医药大学药学院王振月研究员鉴定为麻黄科植物麻黄EphedrasinicaStapf的干燥草质茎,樟科植物肉桂CinnamomumcassiaPresl的干燥嫩枝,蔷薇科植物山杏的苦杏仁Prunusmandshurica(Maxim.) Koehne干燥成熟种子,豆科植物甘草GlycyrrhizauralensisFisch的干燥根和根茎。
供试药品的制备:精密称取麻黄9 g浸泡在700 mL水中,煮沸30 min,水量减至约500 mL,除去泡沫,再加入桂枝6 g,苦杏仁12 g,炙甘草3 g,煮沸1 h,水量减至约200 mL。重复3次并合并滤液。采用6层纱布过滤,并浓缩成浓度为每毫升含生药材1 g。
1.4 试剂
酵母菌(GB/T20886)为河北省售品,甲酸(批号:9806684)色谱级,Sigma公司,乙腈(批号:148407)为色谱级,Fisher公司,甲醇(批号:110301)为色谱级,Fisher公司,屈臣氏蒸馏水,亮氨酸-脑啡肽,Sigma公司,氢氧化钠分析级。
2 方法
2.1 动物分组及实验
实验大鼠每日测量肛温2次,适应后大鼠于代谢笼中分笼饲养适应环境3 d,期间测量温差变化不超过0.5 ℃的大鼠为合格大鼠。通过预实验研究结果发现,麻黄汤(4.2 mL/kg)高剂量组的解热效果明显高于麻黄汤(2.1 mL/kg)低剂量。所以正式实验选取麻黄汤(4.2 mL/kg)作为给药组。将24只健康大鼠随机分为3组,即空白组、模型组和麻黄汤组。模型组和麻黄汤组大鼠背部皮下注射20%酵母水悬液(15 mL/kg)。实验组于造模前1 h给予麻黄汤(4.2 mL/kg)1次,空白组和模型组给予同体积的0.9%生理盐水。
2.2 样品的采集与制备
在造模后0 h、3 h、5 h、7 h、9 h、12 h、15 h、20 h各时间点分别收集尿液1次。即收集0~3,3~5,5~7,7~9,9~12,12~15,15~20 h共7个时间段的尿液,尿液在13 000 r/min的速度下4 ℃离心15 min,取上清液供UPLC-Q/TOF-MS分析。
2.3 色谱条件
采用98%的A溶剂和2%的B溶剂进行梯度洗脱。流动相A 0.1%甲酸-水溶液,流动相B 0.1%甲酸-乙腈溶液。柱温40 ℃;流速0.4 mL·min-1。洗脱梯度见表1。
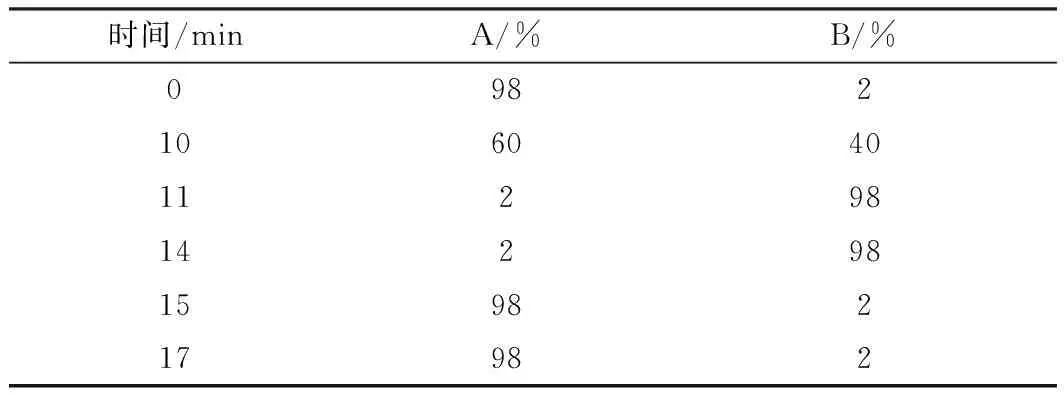
表1 洗脱梯度
2.4 质谱条件
UPLC-Q/TOF-MS质谱中,使用电喷雾离子源(ESI),应用质谱法技术进行了正负离子模式测量。 所有数据均在m/z100~1 200之间采集。毛细管电压3.0 kV、锥形电压45 V、脱溶剂气流量扫描为600 L/h、脱溶剂温度为450 ℃、锥孔气流量为100 L/h和离子源温度为120 ℃。准确质量校正采用亮氨酸-脑啡肽(leucine-enkephalin)。
2.5 数据处理
采用MarkerLynx XS软件进行色谱峰识别以及峰匹配,采用Progenesis QI 1.0对代谢组学的原始数据进行处理。利用现有数据库,包括 KEGG、HMDB、METLIN分析潜在的生物标志物,然后利用MetPA工具分析生物标志物的途径。采用SPSS软件对数据进行统计学分析。
3 结果
3.1 麻黄汤对酵母菌致发热大鼠体温的影响
实验结果表明,5~12 h时间段,大鼠体温在模型组中发生了显著变化,表明酵母菌已成功诱导发热模型。与模型组比较,麻黄汤组对酵母菌致发热大鼠体温升高有明显的抑制作用,组间差异均有统计学意义(P<0.05),如图1所示。
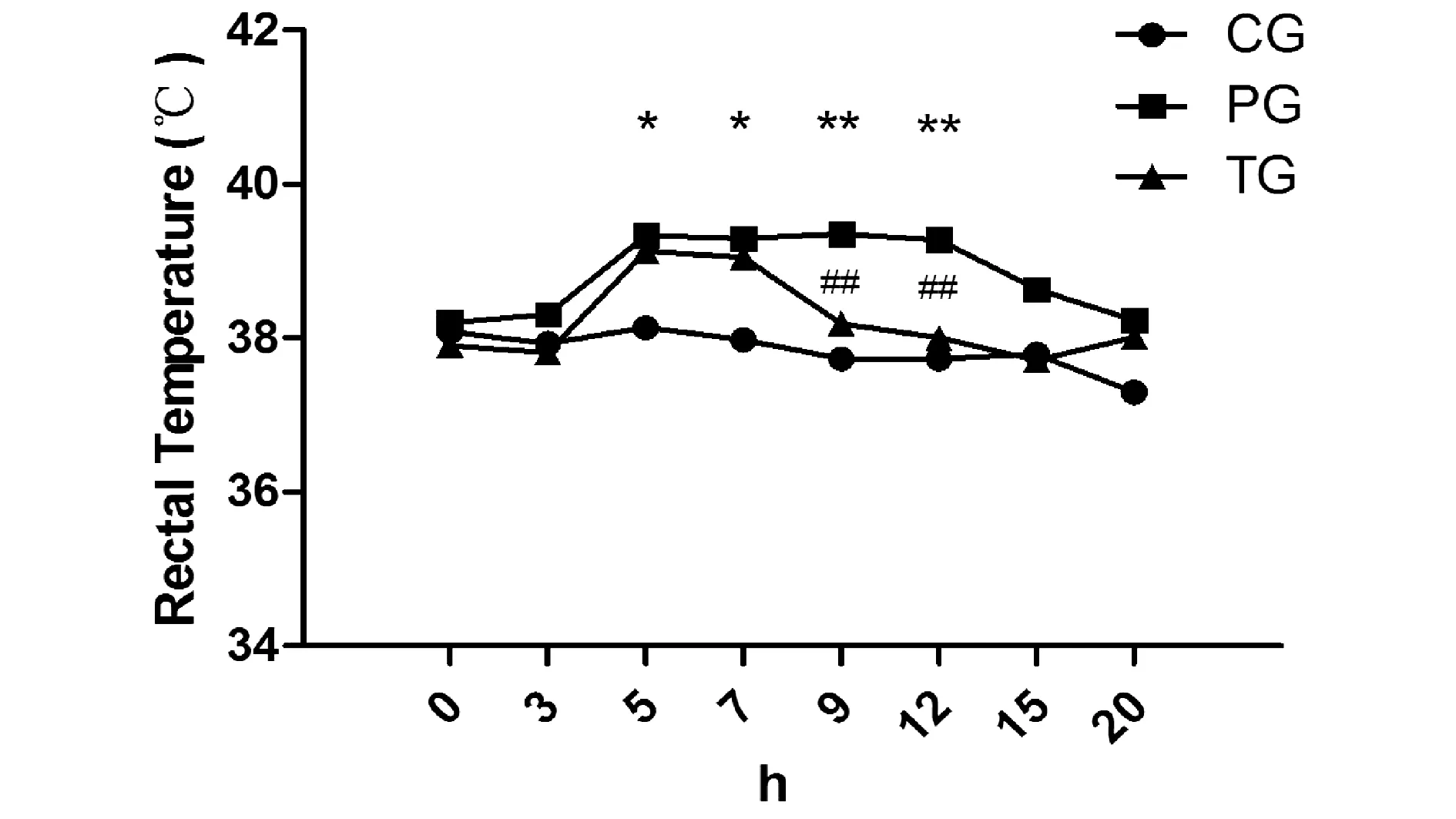
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01;CG(空白组);PG(模型组);TG(麻黄汤组)。图1 空白组、模型组和麻黄汤组大鼠直肠温度
3.2 生物标志物鉴定
在正离子模式下,共鉴定了9个潜在的生物标志物见(表2),在负离子模式下,共鉴定了4个潜在的生物标志物见(表3)。生物标志物选择必须满足以下要求:(1)VIP值大于2;(2)t检验结果具有统计学意义;(3)模型组和麻黄汤组呈相反的变化趋势。如果一个离子满足以上三个方面,它将被认为是一个潜在的生物标志物。

表2 正离子模式下的潜在生物标志物及其变化趋势

表3 负离子模式下的潜在生物标志物及其变化趋势
3.3 麻黄汤对酵母致热的保护作用
给药5~12 h时间段,模型组代谢变化大,因此,进一步利用非监督的PCA统计分析方法,分别对空白组、模型组和麻黄汤组进比较。麻黄汤组能够逆转发热模型组的代谢紊乱。采用PCA积分图(如图2),对空白组、模型组和麻黄汤组进行分析,表明它们的代谢特征存在显著差异,麻黄汤具有调控发热模型大鼠代谢网络的作用,使其向正常组回调。不同代谢物的峰面积值,如图3所示。代谢途径分析结果,如图4所示。

注:空白组,模型组和麻黄汤组在正离子(A)和负离子(B)模式下的主成分分析法PCA;空白组,模型组和麻黄汤组在正离子(C)和负离子(D)模式下主成分分析法PCA的3D图。CG(空白组 绿色);PG(模型组 黑色);TG(麻黄汤组 红色)。图2 麻黄汤对对酵母菌发热的代谢轮廓的保护作用
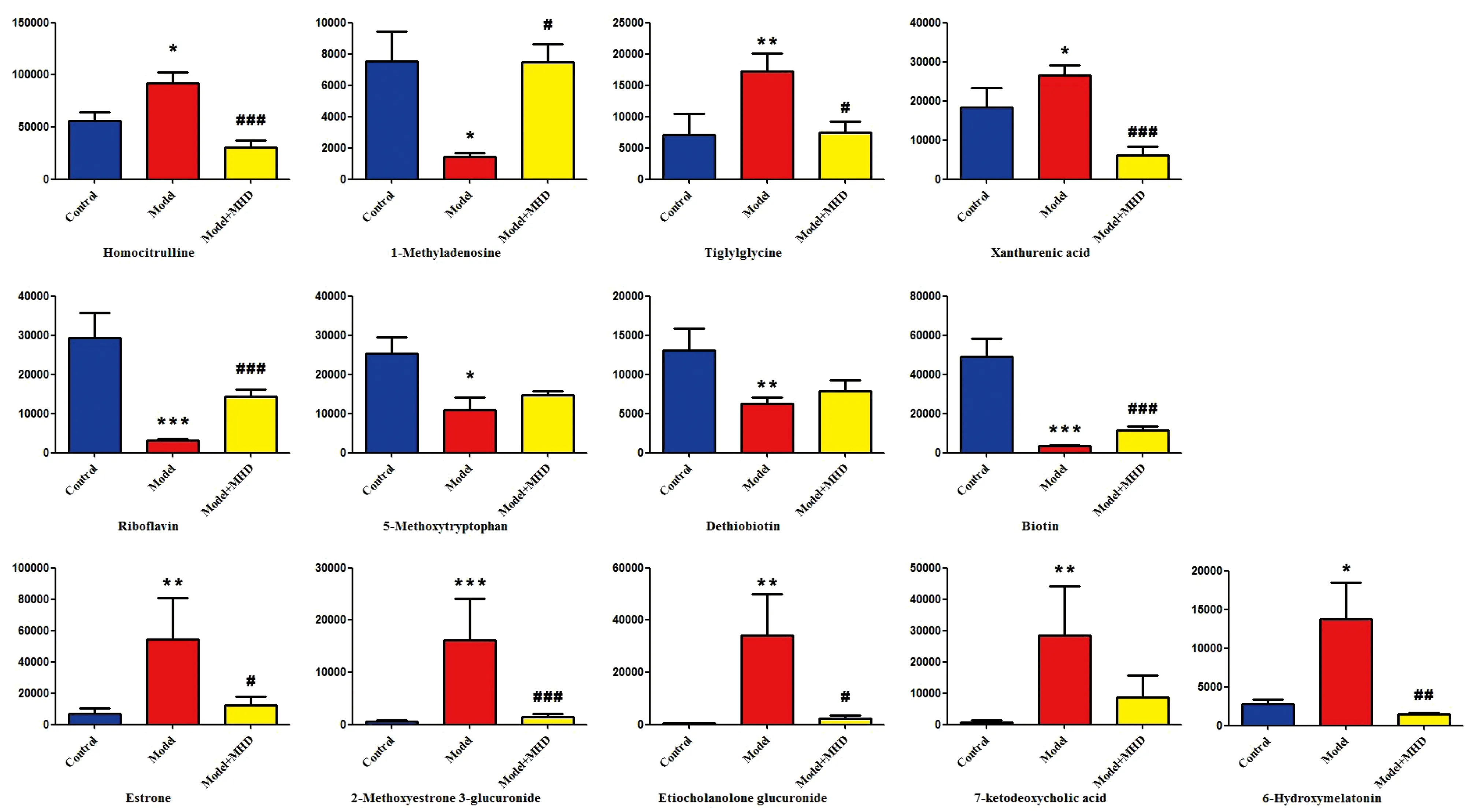
注:与空白组比较,*P<0.05, **P<0.01,***P<0.001;与模型组比较,#P<0.05,##P<0.01,###P<0.001。图3 UPLC-Q-TOF-MS模式下潜在生物标记物的峰值面积水平的变化
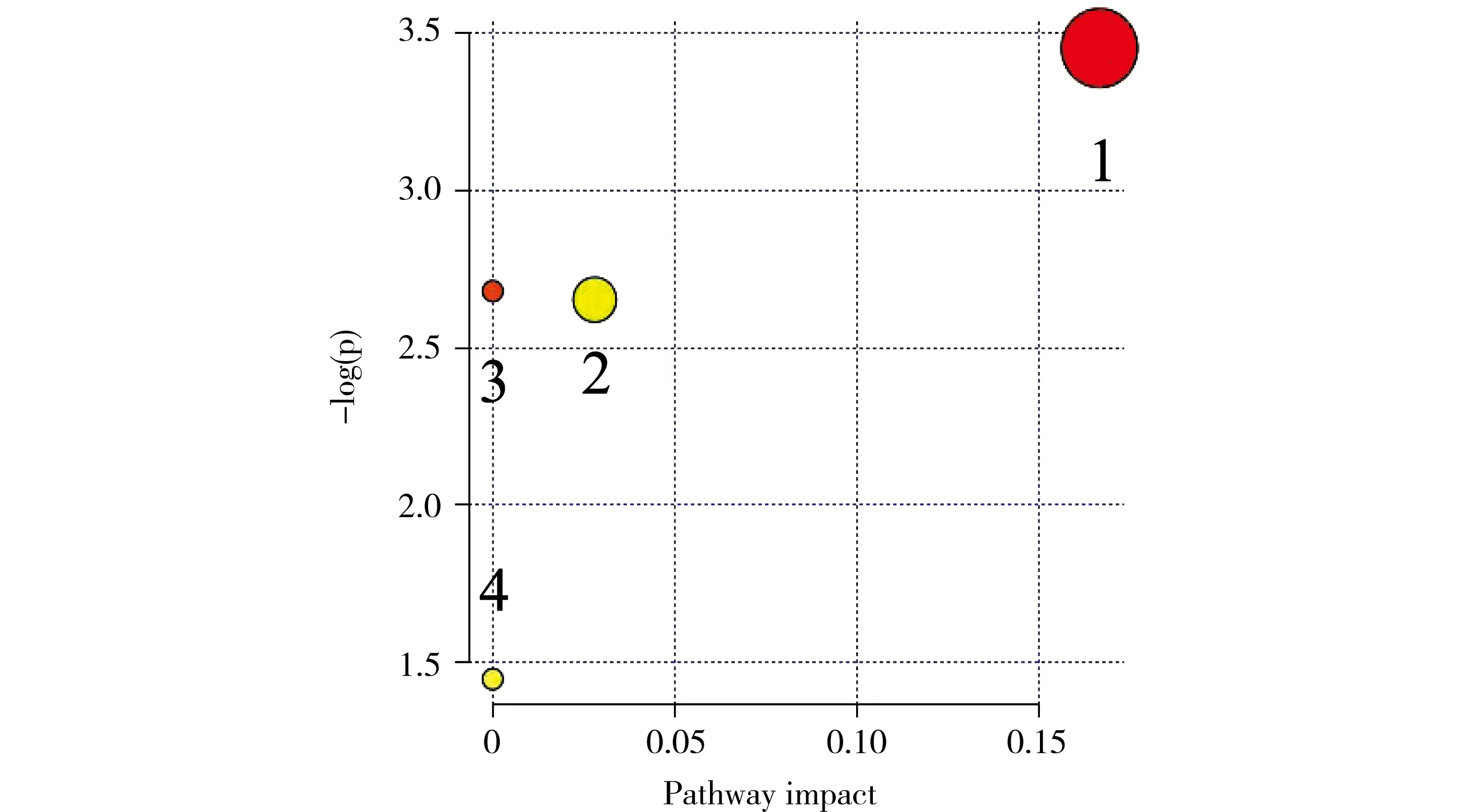
注:(1)生物素代谢;(2)核黄素代谢;(3)类固醇激素合成;(4)色氨酸代谢。图4 用MetPA工具进行路径分析
3.4 代谢途径分析
利用MetaboAnalyst代谢分析软件对麻黄汤的代谢机制进行了研究,并分析了代谢途径。 Kegg和MetPA数据库被用来确定麻黄汤干预发热大鼠模型的代谢途径,并揭示这些潜在的生物标志物之间的关系。如图5所示,聚类热图显示了空白组、模型组和麻黄汤组之间的相对值差异。 为了进一步了解不同组之间的代谢差异,代谢产物在一个可视化聚类热图中,揭示了每种代谢产物的变化。
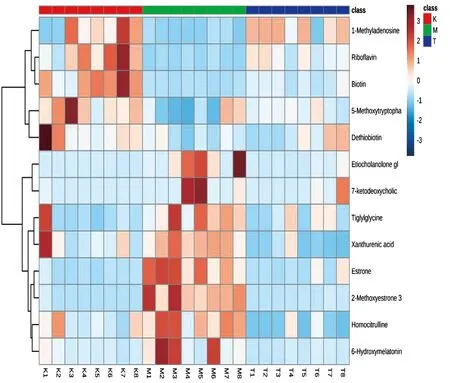
注:每个部分的颜色与代谢物的变化(红色,上调; 蓝色,下调)成正比。 行代表样品;列代表代谢物。不同群体相应标记群体间的相关系数分析。对照组class K(红色)(K1-K8);模型组class M(绿色)(M1-M8);麻黄汤组class T(T1-T8)(蓝色)。图5 对照组、模型组和麻黄汤组尿液样本可视化热图
3.5 生物标志物的表达水平研究
研究结果表明,麻黄汤通过提高5-甲氧基色氨酸(5-methoxytryptophan)水平达到抗炎的作用。在大鼠的肾脏中,麻黄汤能够降低6-羟基褪黑素(6-hydroxymelatonin)、黄嘌呤酸(xanthurenic acid)、巴豆酰甘氨酸(tiglylglycine)、同丝氨酸(Homocitrulline)水平;在大鼠的肝脏中,麻黄汤可以降低雄酮葡萄糖醛酸(etiocholanolone glucuronide)、7-酮脱氧胆酸(7-ketodeoxycholic acid)水平,并且升高脱硫生物素(dethiobiotin)、1-甲基腺苷(1-methyladenosine)水平。在生物素代谢途径中,麻黄汤可以提高生物素(biotin)水平;在核黄素代谢代谢途径中,麻黄汤提高了核黄素(riboflavin)水平;在类固醇激素合成代谢途径中,麻黄汤能够降低雌酮(estrone)、2-甲氧基雌酮-3-葡萄糖醛酸酯(2-methoxyestrone 3-glucuronide)水平最后达到解热的作用。代谢途径见图6。

图6 麻黄汤解热作用的代谢途径
4 讨论
生物素( biotin)又名维生素H、维生素B7,是一种水溶性维生素,是人类五种羧基酶的辅酶,即乙酰辅酶A羧化酶1、乙酰辅酶A羧化酶2、丙酮酸羧化酶、丙酰辅酶A羧化酶和3-甲基巴豆酰辅酶A羧化酶[6]。这些酶在脂肪酸、葡萄糖和氨基酸的新陈代谢中起重要作用。 哺乳动物不能合成生物素,而依赖于微生物和植物的摄入。在这个途径中,脱硫生物素由油酸盐代谢产物吡美啉辅酶a和氨甲酰磷酸形成[7]。硫再与脱硫生物素结合,生成生物素[8]。生物素长期以来被认为是羧基酶的共价结合辅酶[9]。最近,有证据表明,生物素在细胞信号传递、基因的表观遗传调控和染色质结构方面也发挥着独特的作用。人体因缺乏生物素可引起的贫血、脱发、呕吐、舌炎、情绪抑郁、肌肉痛等症状,临床上常用于湿疹、接触性皮炎、异常性痤疮等皮肤病治疗;畜禽因缺乏生物素引起的生长迟缓、皮炎、脱毛等症状[10]。
在尿液中,雌激素通过雌激素结合物的形式排泄出来,是雌激素受体α和β的特定激动剂。 由于雌激素可以转化为雌二醇,而雌二醇比雌激素的作用要强得多,体内雌激素效能是因为大部分雌激素转化为了雌二醇[11-12]。核黄素又叫维生素B2,微溶于水。为体内黄酶类辅基的组成部分,当人体缺乏核黄素时,就会出现机体的生物氧化紊乱和代谢发生障碍。核黄素参与了线粒体电子传递链,并已用于一些线粒体功能紊乱疾病患者[13-16]。核黄素是已知的线粒体氧化磷酸化的共同因子,也是线粒体呼吸过程中电子运输所需的黄素前体[17]。核黄素被认为是潜在的生物标志物,它在核黄素代谢途径在内皮功能障碍大鼠中受到干扰[18]。核黄素缺乏症会导致疲劳、喉咙肿胀、视力模糊和抑郁。 核黄素缺乏症还影响皮肤,引起皮肤裂纹,瘙痒,和皮炎等疾病[19]。 最重要的核黄素生物活性形式是黄素腺嘌呤二核苷酸和黄素单核苷酸,参与一系列的氧化还原反应,对有氧细胞功能具有重要作用[20]。
羟基褪黑素是一种天然存在的内源性神经递质蛋白,是神经递质褪黑激素的主要活性代谢产物。 科学家发现羟基褪黑素是MT1和MT2受体的激动剂。同时,羟基褪黑素具有抗氧化和神经保护作用,说明褪黑激素的具有多全面的保护作用[21-23]。一些研究发现褪黑激素的突然增加会导致生殖障碍和抑郁症。
黄嘌呤酸定位于中枢神经系统的神经元中[24]。黄嘌呤酸尿一种少见的遗传性、嘌呤代谢障碍性疾病,当体内缺乏黄嘌呤氧化酶时,黄嘌呤不能被解体,而是大量积聚在体内,致使血和尿中的黄嘌呤浓度急剧升高。黄嘌呤酸水平的增加是由于上调犬尿氨酸途径影响四氢生物蝶呤的生物合成和四氢生物蝶呤依赖途径[25]。
甘氨酸是异亮氨酸分解代谢的中间产物,它也被认为是呼吸链相关疾病的诊断标记物,并且所有患者的的尿液中甘氨酸含量均升高。这是第一个在尿液中与呼吸链紊乱相关的潜在的标记物[26]。
7-酮脱氧胆酸是一种胆汁酸,影响肝功能的脂质代谢和胆汁酸的肠肝循环[27],体内积累过多会产生强烈的毒性(如破坏细胞膜)。此外,在新陈代谢中,7-酮脱氧胆酸代谢障碍可能导致肝炎及肝硬化[28-29]。同时,7-酮脱氧胆酸也是丙烯酰胺致肝损伤的潜在生物标志物[30]。
5-甲氧基色氨酸预防和治疗脓毒症相关性肺损伤。与健康人相比,脓毒症患者血清5-甲氧基色氨酸水平降低到35%。因此,5-甲氧基色氨酸是抗炎分子的生物标志物,可以预防内皮屏障功能障碍和过度全身性炎症[31-32]。 麻黄汤可能通调节预酵母菌模型大鼠体内的潜在生物标志物含量变化,干预了大鼠紊乱的代谢途径,从而达到预防与治疗疾病的目的。
本文研究了酵母菌致发热模型大鼠尿液的代谢标志物和代谢途径。采用UPLC-Q/TOF-MS代谢组学研究方法,结合多元统计分析,建立了麻黄汤解热机制的代谢组学方法。研究发现了13个与发热相关的潜在生物标志物。同时,研究结果还表明,麻黄汤可能通过调节多种代谢途径,对酵母菌引起的发热具有预防作用。通过代谢途径分析,麻黄汤的解热作用可能通过调节生物素代谢、核黄素代谢、类固醇激素合成和色氨酸代谢等主要代谢途径实现的。
