真核表达hCD1d二聚体的纯化及其对iNKT细胞的刺激效应*
2021-03-02吕燕霞翁秀芳梁智辉吴雄文
杨 敬,吕燕霞,翁秀芳,梁智辉,吴雄文
华中科技大学同济医学院基础医学院免疫学系,武汉430030
CD1d分子属于CD1家族,在结构上与经典的MHC-Ⅰ类分子高度相似,与β2m非共价结合[1],表达于细胞膜表面。自然杀伤T细胞(natural killer T cells,NKT)同时具有T细胞与NK细胞的表型,属固有免疫样T淋巴细胞,主要识别CD1d分子提呈的脂类、糖脂类抗原[2-3]。其中恒定自然杀伤T细胞(invariant natural killer T cells,iNKT)表达相对恒定的T细胞抗原受体(T cell receptor,TCR),可被α-半乳糖基神经酰胺(α-Galactosylceramide,α-GalCer)特异性活化,活化后可分泌IFN-γ、IL-4、IL-17、IL-10等多种细胞因子,具有双向免疫调节功能[4-5]。iNKT细胞效应物功能多样,在自身免疫性疾病、移植耐受、抗肿瘤和抗感染性等病理过程中发挥重要作用[6-7],因此,对其功能的研究具有重要意义。
α-GalCer/CD1d四聚体作为iNKT细胞识别的配体,已被广泛应用于iNKT细胞的检测与分选,但却存在加载的脂类抗原单一,不易获得等问题。通过加载不同的脂类抗原,制备真核表达的CD1d二聚体,可为iNKT细胞的功能研究提供稳定的工具来源。本室前期工作中已建立能够同时表达人CD1d(α1-α3)与IgG1-Fc(CH1-CH3区)融合蛋白及β2m的杆状病毒双表达载体pFastBacTMDual+[β2m+CD1d/IgG1-Fc],并将携带目的基因的质粒通过转座作用转入到杆状病毒载体中。在此基础上,本研究通过提取昆虫杆状病毒质粒并转染至sf9细胞中,用ELISA法鉴定融合蛋白的正确性并建立hCD1d二聚体的纯化方法,获得的纯化hCD1d二聚体与抗CD28抗体可加载到细胞样大小(4~5 μm)的聚苯乙烯乳胶微粒上,制备人工抗原提呈细胞[8],为T细胞提供TCR信号和共刺激信号,研究其对iNKT细胞的刺激效应,可为iNKT细胞的功能研究奠定基础。
1 材料与方法
1.1 实验材料与仪器
pFastBacTMDual+[β2m+CD1d/IgG1-Fc]由本实验室构建并保存。spodoptera frugiperda(sf9)细胞是草地贪夜蛾细胞,转染杆状病毒表达系统后,组装杆状病毒并表达外源蛋白(本室保存)。Grace培养基粉剂、Grace不完全培养基粉剂购自Gibco公司。山羊抗人IgG抗体购自康为公司;HRP标记的山羊抗人IgG抗体购自武汉飞弈公司;人IgG标准品购自中杉科技公司;鼠抗人CD1d,作为检测CD1d的ELISA包被抗体,克隆号为51.1,购自Biolegend公司;生物素化的鼠抗人β2m,用于检测β2m的抗体,克隆号为2M2,购自Biolegend公司;HRP标记的链酶亲和素和生物素化的鼠抗人β2m购自Biolegend公司;四环素、庆大霉素和卡那霉素购自华北制药;脂质体Cellfectin、sf9细胞转染试剂购自Invitrogen公司;质粒提取试剂盒购自Omega Bio-tech;α-GalCer(KRN7000)购自美国Avanti PolarLipids;S37223购自Fisher Scientific公司;IFN-γ、TNF-α、IL-4、IL-10、IL-2、IL-17细胞因子检测试剂盒购自Sigma公司;APC-PBS57/CD1d四聚体为美国NIH馈赠;BV421标记抗人CD3抗体(UCHT1)购自Biolegend公司。
超净工作台为苏州净化设备厂产品;CO2细胞培养箱、高速低温台式离心机为德国Heraeus公司产品;-80℃低温冰箱为德国Nuaire公司产品;倒置显微镜为OLYMPUS;酶标仪为Bio-Tech公司产品;流式细胞仪为美国BD公司FACLSR2;层析柜为北京四环仪器厂产品。
1.2 实验方法
1.2.1 重组杆状病毒载体质粒的提取 将已构建好的pFastBacTMDual+[β2m+CD1d/IgG1-Fc]质粒转化本实验室制备的DH10 BacTM感受态细胞,接种于含有卡那霉素、四环素、庆大霉素的LB培养液中,振摇扩增并收集菌液,并应用Omega Bio-tech质粒提取试剂盒抽提质粒,加入50 μL无菌水溶解质粒,即得到含有目的基因的重组杆状病毒载体质粒。
1.2.2 sf9细胞的转染与再次感染 于6孔板中接种sf9细胞,每孔1×106个,加入10 % FBS Grace完全培养液2~3 mL,置27℃温箱,使细胞贴壁;将1 μg无菌重组杆状病毒载体质粒DNA和5 μL的脂质体Cellfectin各溶于100 μL Grace不完全培养液中,然后将两者充分轻柔混匀,置室温45 min;待细胞贴壁后弃去培养液,Grace不完全培养液洗涤2次;加入800 μL Grace不完全培养液在DNA与脂质体Cellfectin的混合液中,轻柔混匀后,置于含有sf9细胞的孔板中,27℃温箱5 h;10% FBS的Grace完全培养液洗涤2次,弃去混合液,再加入2 mL含有10% FBS的Grace完全培养液;27℃温箱3~5 d,期间注意观察细胞形态的变化,如细胞出现形状扁圆、胞内颗粒增多、体积变大和漂浮等特征,则提示转染成功。收集此时上清,将收集的含有sf9表达的hCD1d二聚体和大量携带重组基因的杆状病毒的上清继续感染sf9细胞,连续收集几代,比较表达量最高的细胞上清,用于后续实验。
1.2.3 人CD1d二聚体的鉴定 ①应用抗IgG-Fc抗体对融合蛋白的人IgG-Fc段进行ELISA鉴定。酶标板中加入包被液稀释的山羊抗人IgG抗体5 μg/mL,每孔50 μL,4℃湿盒过夜;弃去包被液,封闭、洗涤后每孔加入50 μL样品;应用1∶2000稀释的辣根过氧化物酶标记的山羊抗人IgG抗体进行检测;TMB显色,100 μL 2 mol/L H2SO4终止反应;酶标仪450 nm处读取吸光度(A)值。②应用抗CD1d抗体与抗β2m抗体对融合蛋白的人CD1d和人β2m组分进行ELISA检测。将鼠抗人CD1d抗体(克隆号为51.1)用包被液稀释至5 μg/mL,酶标板中加入50 μL/孔,4℃湿盒过夜;弃去包被液,封闭、洗涤后每孔加入50 μL样品;应用1∶1000稀释的生物素化鼠抗人β2m抗体以及辣根过氧化物酶标记的链酶亲和素进行检测;TMB显色,100 μL 2 mol/L H2SO4终止反应,酶标仪450 nm处读取A值。
1.2.4 hCD1d二聚体SPA柱纯化 hCD1d二聚体含有IgG1-Fc段,所以可用金黄色葡萄球菌表面蛋白A(SPA)柱进行纯化。取2 mL SPA凝胶加入5 mL体积的层析柱中,并置于4℃层析柜中;用结合缓冲液以1 mL/min的速度,平衡SPA层析柱30 min;将过滤好的样品以1 mL/min的速度经过SPA层析柱,使样品中的hCD1d二聚体与SPA充分结合;当样品过完后,用结合缓冲液过柱,以洗脱其它杂蛋白,流速为1 mL/min,直至流出的液体不再检测得到蛋白;将结合缓冲液更换为洗脱缓冲液,选择不同浓度的甘氨酸或柠檬酸作为洗脱液,以1 mL/min的速度过SPA,洗脱结合于SPA上的hCD1d二聚体;1 mL/管,Bradford液检测每管蛋白质含量,在pH值发生变化的收集样品中,加入1 mol/L Tris碱溶液,将pH值调至7~8;ELISA检测收集样品中的hCD1d二聚体含量并确认有效的洗脱方法。
1.2.5 hCD1d人工抗原提呈细胞的制备 用PBS洗涤微球(S37223),调整浓度至107/mL,加入纯化后的hCD1d二聚体(1 μg/mL)和抗CD28抗体分子(0.5 μg/mL),4℃转动反应12 h;离心洗涤,加入0.4 mL 1 % BSA,封闭15 min;离心洗涤,再加入α-GalCer(0.5 μg/mL),4℃转动反应6 h;离心洗涤后重悬于PBS中,即可获得α-GalCer/hCD1d aAPC;用PBS洗涤微球,并调浓度为1×107/mL;同方法制备表面仅有抗CD28抗体分子的微球,作实验对照。
1.2.6 hCD1d人工抗原提呈细胞刺激外周血iNKT细胞的效应 淋巴细胞分离液分离外周血细胞,计数后10%FBS-1640调PBMC浓度为5×106个/mL;按5∶1的比例在96孔板中接种PBMC与CD1d人工抗原提呈细胞,混合培养3 d,收集上清,通过人Th1/Th2/Th17细胞因子检测试剂盒同时检测多种细胞因子分泌水平。混合培养7 d后,收集细胞,应用APC-PBS57/CD1d四聚体以及BV421标记抗人CD3抗体通过流式细胞术检测iNKT细胞的扩增效率。
1.3 统计学分析

2 结果
2.1 hCD1d二聚体的表达与鉴定
通过pFastBacTMDual+[β2m+CD1d/IgG1-Fc]质粒转染,并感染sf9细胞组装病毒,反复感染结果显示:收集的第4代病毒感染的上清中目的蛋白表达量较高,所以用第4代感染细胞上清进行后续实验。
为了检测hCD1d二聚体的浓度,我们应用羊抗人IgG抗体与辣根过氧化物酶标记的羊抗人IgG抗体进行双抗体夹心法绘制人IgG标准曲线(图1A)。对感染的第4代细胞中的hCD1d二聚体进行IgG-Fc段检测与定量分析,结果显示,蛋白浓度约为(1.05±0.20)μg/mL(图1B)。为了验证所获得的hCD1d二聚体中CD1d α链与β2m是否折叠并形成正确构象,本研究进一步用鼠抗人CD1d抗体包被作为捕获抗体,生物素化的鼠抗人β2m抗体作为检测抗体进行双抗体夹心ELISA检测,结果显示hCD1d二聚体构象正确。并应用美国NIH四聚体实验室提供的CD1d单体作为标准品绘制标准曲线(图1C),对hCD1d二聚体进行定量分析,结果显示,感染的第4代细胞中hCD1d二聚体的蛋白浓度约为(0.85±0.01)μg/mL(图1D)。
以上2种ELISA方法通过检测CD1d二聚体的IgG1-Fc、CD1d和β2m等3个部分,验证了sf9细胞表达的hCD1d二聚体的正确性。
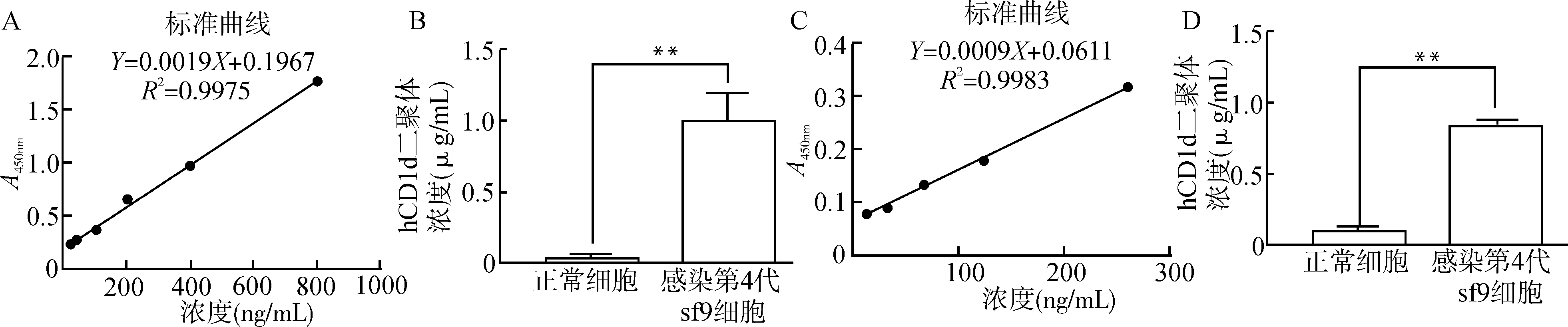
A:用羊抗人IgG抗体进行ELISA检测,绘制人IgG的标准曲线;B:用羊抗人IgG抗体检测收集的第4代感染细胞上清中hCD1d二聚体的浓度;C:联合鼠抗人CD1d抗体与生物素化的鼠抗人β2m抗体进行ELISA检测,绘制hCD1d的标准曲线;D:联合鼠抗人CD1d抗体与生物素化的鼠抗人β2m抗体,检测收集的第4代感染细胞上清中hCD1d二聚体的浓度;**P<0.01图1 hCD1d二聚体的ELISA鉴定Fig.1 Identification of hCD1d dimer by ELISA
2.2 hCD1d二聚体的纯化
SPA能与IgG-Fc结合,这种结合具有特异性和可逆性,所以可以用SPA柱对hCD1d二聚体/IgG1-Fc段进行亲和层析,达到对蛋白纯化和浓缩的目的。在纯化过程中发现,样品流过SPA柱后的流出液中检测不到蛋白,说明目的蛋白在过柱时被结合在SPA柱上,用传统方法洗脱,即用pH4.5的0.1 mol/L甘氨酸洗脱液进行洗脱,在流出的洗脱液中无法检测到含有蛋白的洗脱峰,提示hCD1d二聚体可能结合到SPA柱上,而未能成功洗脱下来(图2A),应考虑更换洗脱液和改变条件。
为了建立hCD1d二聚体有效的洗脱方法,我们首先在EP管中应用少量SPA琼脂糖颗粒与hCD1d二聚体上清模拟蛋白纯化过程,比较pH2.5的0.1 mol/L甘氨酸、pH2.5的0.5 mol/L甘氨酸、pH2.5的1 mol/L甘氨酸、pH2.5的0.1 mol/L乙酸、pH1.9的0.1 mol/L盐酸和pH2.5的0.1 mol/L柠檬酸等6种不同洗脱液洗脱效果。结果显示,pH2.5的1 mol/L甘氨酸和pH2.5的0.1 mol/L柠檬酸有相对较好的洗脱效果(图2B)。
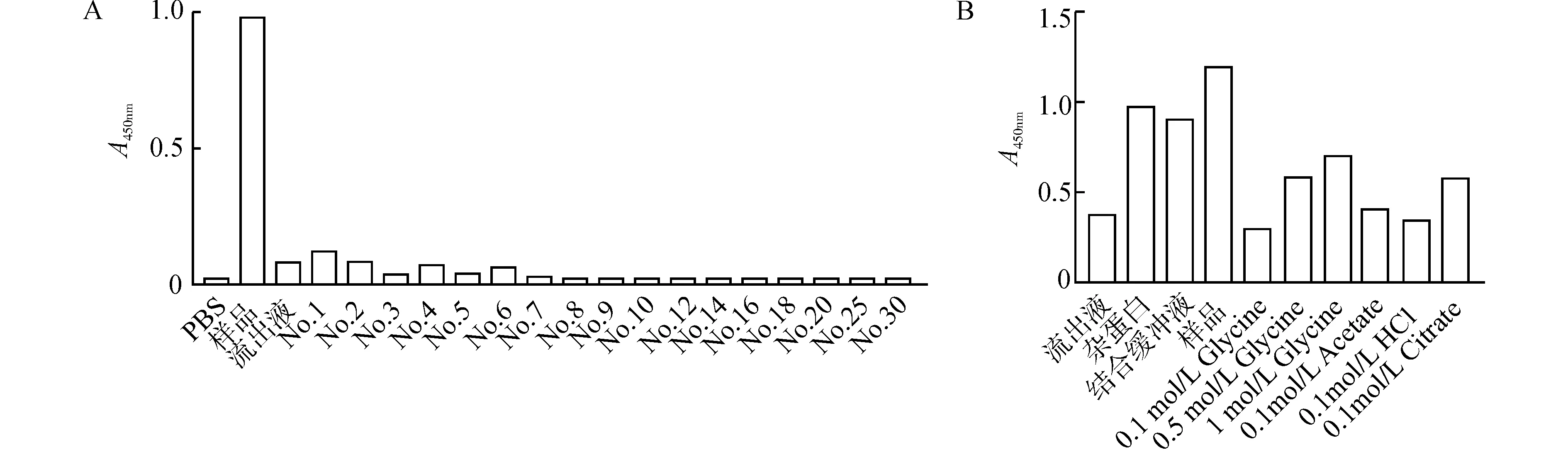
A:将250 mL含hCD1d二聚体的上清经过SPA柱结合,并用pH4.5的0.1 mol/L的甘氨酸洗脱,应用抗人IgG抗体检测洗脱的hCD1d二聚体量;B:将100 μL SPA琼脂糖颗粒分装于EP管中,并加入1 mL含hCD1d二聚体的上清,应用不同洗脱液洗涤,并用抗人IgG抗体检测洗脱的hCD1d二聚体量图2 hCD1d二聚体纯化条件的摸索Fig.2 Exploration of purification conditions of hCD1d dimer
分别用pH2.5的1 mol/L甘氨酸和pH2.5的0.1 mol/L柠檬酸作为洗脱液,用SPA柱对200 mL含hCD1d二聚体的上清进行纯化与比较分析,发现pH2.5的1 mol/L甘氨酸洗脱峰较宽(图3A)而pH2.5的0.1 mol/L柠檬酸洗脱峰相对较窄(图3B)。对纯化后蛋白进行IgG1-Fc的ELISA检测发现pH2.5的0.1 mol/L柠檬酸有较好的浓缩效果(图3C)。进一步对纯化后蛋白的hCD1d二聚体进行ELISA检测构象,发现相比于pH2.5的1 mol/L甘氨酸,pH2.5的0.1 mol/L柠檬酸可以更好维持hCD1d二聚体构象的稳定性(图3D)。所以对于hCD1d二聚体的纯化,用SPA进行亲和层析纯化时,用pH2.5的0.1 mol/L柠檬酸作为洗脱液洗脱效果更好。
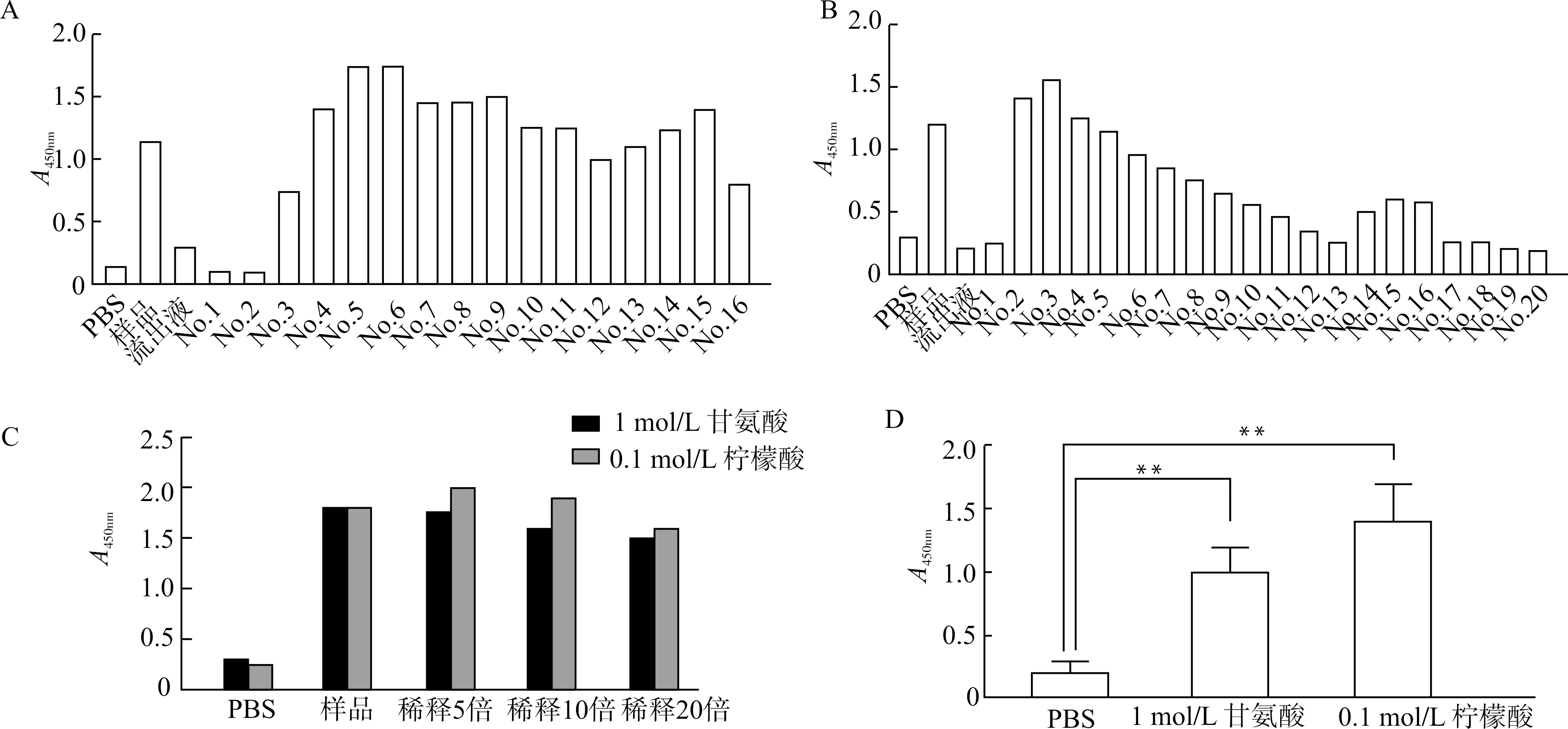
A:用pH2.5的1 mol/L甘氨酸作为洗脱液,应用抗人IgG进行ELISA检测,检测不同洗脱峰中纯化的hCD1d二聚体;B:用pH2.5的0.1 mol/L柠檬酸作为洗脱液,应用抗人IgG进行ELISA检测,检测不同洗脱峰中纯化的hCD1d二聚体;C:应用抗人IgG进行ELISA检测,比较分析2种洗脱液洗脱的最高洗脱峰中hCD1d二聚体量;D:应用抗人CD1d与抗人β2m抗体进行夹心ELSIA检测,检测与比较2种洗脱液洗脱的最高洗脱峰中构象正确的hCD1d二聚体量;**P<0.01图3 pH2.5的0.1 mol/L柠檬酸为优化的hCD1d二聚体洗脱条件Fig.3 Better elution conditions for hCD1d dimer with 0.1 mol/L citric acid at pH 2.5
2.3 纯化的hCD1d二聚体刺激与扩增iNKT细胞效应
iNKT细胞发挥效应的途径主要通过细胞因子分泌来实现。我们首先对健康个体PBMC在α-GalCer/hCD1d人工抗原提呈细胞刺激后的细胞因子分泌谱进行分析,检测α-GalCer/hCD1d人工抗原提呈细胞刺激健康个体PBMC后第3天上清中各类细胞因子的含量,图4显示,实验组上清中IFN-γ、TNF-α含量分别为(1876.26±96.73)pg/mL和(1186.25±98.63)pg/mL,明显高于对照组(79.98±18.52)pg/mL和(29.96±4.43)pg/mL,具有显著性差异(均P<0.01)。然而实验组IL-4、IL-2、IL-10、IL-17细胞因子水平未见明显升高,上清含量依次为(23.92±1.94)pg/mL、(33.32±14.96)pg/mL、(47.33±9.02)pg/mL、和(64.53 ±10.13)pg/mL,与对照组相比差异无统计学意义(均P>0.05),说明iNKT细胞α-GalCer/hCD1d刺激后主要产生Th1型细胞因子,这与iNKT细胞接收刺激后分泌细胞因子谱基本一致。

**P<0.01图4 健康个体PBMC经α-GalCer/hCD1d人工抗原提呈细胞刺激3 d后细胞因子分泌Fig.4 Secretion of cytokines in PBMC of healthy individuals stimulated by α-GalCer/hCD1d artificial antigen-presenting cells for three days
健康人PBMC经α-GalCer/hCD1d人工抗原提呈细胞刺激7 d后,iNKT细胞比例显著升高,可占PBMC的(4.17±0.76)%,而未包被hCD1d二聚体的微球对照组,iNKT细胞占(0.41±0.09)%,两组相比差异有统计学意义(P<0.01)(图5A、5B),说明iNKT细胞经α-GalCer/hCD1d人工抗原提呈细胞刺激后能有效扩增。

A:人iNKT细胞体外扩增代表性流式图,Control beads为对照组,α-GalCer/hCD1d aAPC为实验组;B:不同组中iNKT细胞比例统计柱状图;**P<0.01图5 健康个体PBMC经α-GalCer/hCD1d人工抗原提呈细胞刺激7 d后iNKT细胞有效扩增Fig.5 iNKT cells expanded effectively in PBMCs of healthy individuals stimulated with α-GalCer/hCD1d artificial antigen-presenting cells for seven days
3 讨论
pFastBacTMDual依托的杆状病毒Bac-to-Bac昆虫表达体系作为真核表达体系,被证实可有效地对目的蛋白进行糖基化修饰,并具有大量表达目的蛋白的优势[9],因此可作为hCD1d二聚体的有效表达工具。本室前期构建的hCD1d二聚体表达体系满足了3个条件:①可同时稳定表达CD1d α链与β2m,从而组装成完整构象的hCD1d蛋白;②CD1d α链需要与IgG1-Fc段蛋白共价融合,从而可以借助IgG1-Fc段形成的链间二硫键实现二聚化,组装成正确构象的hCD1d二聚体;③hCD1d分子属于高度糖基化的分子,其糖基化程度可明显影响脂类抗原提呈的有效性。
应用SPA柱对sf9细胞表达正确的hCD1d二聚体进行纯化,发现用传统洗脱液即pH4.5的0.1 mol/L的甘氨酸洗脱时,hCD1d二聚体不能有效地洗脱下来,推测可能的原因是hCD1d结合了脂类抗原可改变hCD1d二聚体的亲水性与疏水性,从而影响hCD1d二聚体的洗脱效率,具体原因有待进一步研究。进一步对hCD1d二聚体在酸性环境中的构象稳定性进行分析,结果提示在酸性环境中,hCD1d二聚体其非共价结合的β2m不易脱落。
iNKT细胞是一类天然存在的,能够介导先天免疫和获得性免疫的具有限制性TCR谱的T淋巴细胞的子集,主要识别CD1d分子呈递的糖脂类抗原[10-11]。iNKT细胞有内源性和外源性两种糖脂配体,在接受抗原刺激之后,iNKT细胞快速反应,分泌出大量炎性细胞因子,如IFN-γ和IL-4等[12],从而影响T细胞、NK细胞及CTL细胞功能,并可直接杀伤肿瘤细胞等靶细胞[13],成为最有效的免疫调节物质,起到先天性免疫应答和获得性免疫应答的桥梁作用[14]。目前发现的对iNKT细胞最有效的外源性糖脂抗原是α-GalCer。然而,研究显示iNKT细胞是一群异质性的细胞,不能全部被α-GalCer-CDld四聚体识别,因此,通过筛选新型的CD1d分子配基,可有助于进一步获取新型的iNKT细胞激活剂,为体外扩增iNKT细胞提供新的途径[15]。
虽然小鼠iNKT细胞经过α-GalCer刺激会大量分泌IL-4,但是我们的前期研究显示人iNKT细胞经过α-GalCer刺激后主要分泌Th1型细胞因子[16-17]。本研究通过本室前期构建并保存的pFastBacTMDual+[β2m+CD1d/IgG1-Fc]重组杆状病毒质粒,获得自制α-GalCer/hCD1d人工抗原提呈细胞,利用α-GalCer/hCD1d人工抗原提呈细胞激活健康个体PBMC,结果显示,iNKT细胞接受刺激3 d后分泌的细胞因子与已报道的人iNKT细胞体外刺激后细胞因子分泌谱基本一致,主要分泌Th1型细胞因子IFN-γ与TNF-α。另外,在体外培养的第7天收获细胞并检测iNKT细胞的比例,显示健康个体PBMC中的iNKT细胞在接受α-GalCer刺激后能迅速扩增,而未包被hCD1d二聚体的微球对照组iNKT细胞未见明显扩增,说明包被有hCD1d二聚体的人工抗原提呈细胞可特异性刺激iNKT细胞分泌Th1型细胞因子并有效扩增。
综上所述,本研究成功制备了hCD1d二聚体的人工抗原提呈细胞,为后期开发iNKT细胞靶向治疗奠定了基础,具有重要意义。
