正相高效液相色谱法同时测定肉制品中4 种羟基十八碳二烯酸异构体的含量
2021-03-01耿志明徐为民
刘 婷,熊 强,耿志明,徐为民,3
(1.南京工业大学食品与轻工学院,江苏 南京 211816;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
脂质氧化贯穿肉制品加工整个过程,对肉制品、尤其是腌腊肉制品风味的形成具有重要影响[1-2],并且脂质氧化产生的产物也会引起肉制品中其他组分的变化,降低肉制品的营养价值[3-4]。亚油酸是肉制品中最常见的多不饱和脂肪酸,在脂肪氧合酶、过渡金属离子以及自由基等作用下[5-7],亚油酸首先被氧化形成初级氧化产物ü ü 氢过氧化十八碳二烯酸(hydroperoxyoctadecadienoic acids,HPODEs)[8]。由于存在共轭双键,HPODEs有4 种异构体:13-9Z,11E-氢过氧十八碳二烯酸、13-9E,11E-氢过氧十八碳二烯酸、9-10Z,12E-氢过氧十八碳二烯酸和9-10E,12E-氢过氧十八碳二烯酸。HPODEs性质活泼,在谷胱甘肽过氧化物酶或过渡金属离子等作用下还原形成亚油酸的次级氧化产物ü ü 羟基十八碳二烯酸(hydroxyoctadecadienoic acids,HODEs)[9]。还原反应不改变共轭双键的异构现象[10],因此存在相应的4 种HODEs异构体,分别为13-羟基-9Z,11E-十八碳二烯酸(13-hydroxy-9Z,11Eoctadecadienoic acid,13-Z,E-HODE)、13-羟基-9E,11E-十八碳二烯酸(13-hydroxy-9E,11E-octadecadienoic acid,13-E,E-HODE)、9-羟基-10Z,12E-十八碳二烯酸(9-hydroxy-10Z,12E-octadecadienoic acid,9-Z,EHODE)、9-羟基-10E,12E-十八碳二烯酸(9-hydroxy-10E,12E-octadecadienoic acid,9-E,E-HODE)。HODEs异构体的种类及比例取决于亚油酸氧化的途径,自由基诱导的自动氧化途径产生4 种HODEs异构体;而脂肪氧合酶催化的酶促途径只会产生13-Z,E-HODE和9-Z,E-HODE两种异构体[11]。
人体内存在内源性的HODEs,是体内亚油酸的代谢产物之一[12]。研究表明,内源性HODEs具有病理生理学作用,但不同位置异构体的作用有所差异。如13-HODE对早期动脉粥样硬化具有延缓作用,而9-HODE则在动脉粥样硬化晚期表现出显著的促进作用[13];在皮肤相关疾病的发展中,9-HODE表现为促炎作用[14],而13-HODE则表现为抗炎作用[15]。原发性高血压病人体内13-HODE的水平显著高于正常人群[16],13-HODE还被认为与人类多种癌症的发生或发展密切相关[17-18]。通过研究异构体种类、含量变化等,内源性HODEs已被作为脂质代谢指示物,广泛用于人类多种相关疾病的病理生理学研究[12,19]。
近年来加工肉制品的安全问题受到了人们的广泛关注[20]。研究发现,加工肉制品普遍含有包括HODEs在内的多种亚油酸的次级氧化产物[21-22]。尤其值得关注的是,这些外源性的亚油酸次级氧化产物可通过膳食被人体直接吸收,具有内源性亚油酸次级氧化产物相同的作用[23]。因此对加工肉制品中4 种HODEs异构体含量同时进行分析,可以完整地了解不同异构体在肉制品中的存在水平,为进一步开展暴露评估提供数据,也为探索肉制品中HODEs主要形成途径、以及相应的调控工艺的研发打下基础。
HODEs的分析方法主要有高效液相色谱-紫外(high performance liquid chromatography-ultraviolet,HPLC-UV)检测法[24-25]、气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)法[26]、液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)联用[27-28]以及酶联免疫吸附[29]等方法。这些方法满足各类样本(组织、血浆、食品等)中HODEs的分析,但多侧重于单一HODE(如13-HODE)或HODEs总量分析,同时分析食品中4 种HODEs异构体含量的研究鲜见报道。肉制品中普遍存在的高含量HODEs以及HODEs中存在的共轭双键,使得运用HPLC-UV建立同时分析肉制品中4 种HODEs异构体含量的方法成为可能。
本实验利用硅胶柱为分离柱、利用二极管阵列检测器(photo diode array,PDA)在234 nm波长处检测4 种HODEs异构体,建立同时测定肉制品中13-Z,E-HODE、13-E,E-HODE、9-Z,E-HODE和9-E,E-HODE含量的正相高效液相色谱-二极管阵列检测器(high performance liquid chromatography-photo diode array detector,HPLC-PDA)分析方法,以期用于肉制品中HODEs形成规律及机制相关研究。
1 材料与方法
1.1 材料与试剂
生腌肉制品S 1 ~S 11、即食肉制品S 1 2 ~S 1 8江苏省南京市苏果超市及农贸市场;标准品1.0 mg/mL 13-Z,E-HODE、0.1 mg/mL 9-Z,E-HODE 美国Cayman Chemicals公司;0.2 mg/mL 13-E,E-HODE、0.2 mg/mL 9-E,E-HODE 瑞典Larodan公司;Sep-Pak C18固相萃取柱(500 mg/3 mL) 美国Waters公司;正己烷、异丙醇(均为色谱纯) 美国ROE公司;乙酸(色谱纯)美国Aladdin公司。
1.2 仪器与设备
e2695 HPLC仪(配有PDA) 美国Waters公司;T25高速匀浆机 德国IKA公司;Biofugestratos高速离心机 德国Heraeus公司;氮吹仪 美国Organomation公司;超纯水仪 美国Millipore公司。
1.3 方法
1.3.1 标准溶液的配制
取适量体积质量浓度分别为1.0、0.2、0.1、0.2 mg/mL的13-Z,E-HODE、13-E,E-HODE、9-Z,E-HODE和9-E,E-HODE标准溶液,于氮吹仪中氮吹至干,分别加入正己烷配制成质量浓度分别为20 μg/mL的标准储备液,于-40 ℃冰箱中保存,备用。
1.3.2 样品处理
样品处理方法参考姜春娇等[30]的方法。将肉制品分别切碎后,密封贮存于-18 ℃备用。称取2.0 g(精确到0.01 g)肉样于80 mL离心管中,加入15 mL甲醇,使用匀浆机5 000 r/min均质2 min,加入10 mL超纯水,涡旋混匀后3 500hg离心12 min。Sep-Pak C18固相萃取柱(500 mg/3 mL)预先用3 mL甲醇进行活化、3 mL水平衡,然后取5 mL上清液过C18小柱,再采用2 mL甲醇进行洗脱,收集洗脱液氮吹至干,最后采用200 μL正己烷(对于HODEs含量较高的样品,应适当增加正己烷的用量以保证目标分析物的检测浓度处于线性范围内)溶解HODEs,过0.22 μm滤膜后用于HPLC-PDA分析。
1.3.3 色谱条件
色谱柱:Absolute SiO2(250 mmh 4.6 mm,5 μm);流动相:正己烷-异丙醇-乙酸(98.3∶1.6∶0.1,V/V);流速:1.0 mL/min;柱温:30 ℃;检测器:PDA;检测波长:234 nm;进样量:10 μL。
1.3.4 方法学验证
1.3.4.1 线性范围、线性回归方程及检出限和定量限
取适量体积1.3.1节制备的标准储备液混合,采用正己烷逐级稀释配制系列混合标准工作溶液,按照1.3.3节的条件进行HPLC-PDA分析,每个质量浓度重复测定3 次。以4 种标准品质量浓度为横坐标x,以对应峰面积为纵坐标y,分别绘制标准曲线并计算回归方程。取标准HODEs溶液用正己烷逐级精密稀释,依次进样,以3 倍信噪比(RSN=3)时的HODEs质量浓度作为检出限,以10 倍信噪比(RSN=10)时的HODEs质量浓度作为定量限。
1.3.4.2 精密度实验
取3 种样品(S2、S5、S18),按照1.3.2节进行处理,进行日内与日间精密度实验。日内精密度实验:每种样品重复处理6 个,在1 d内不同时段按照1.3.3节的条件进行HPLC分析;日间精密度实验:每种样品重复处理3 个,连续3 d每天按照1.3.3节的条件进行HPLC分析。分别计算日内和日间精密度,以相对标准偏差(relative standard deviation,RSD)表示。
1.3.4.3 回收率实验
选择3 种不同HODEs浓度水平的肉制品(S9、S12、S14)进行添加回收实验,分别精密加入3 个水平的标准品,分别按照1.3.2节进行处理后按1.3.3节的条件进行HPLC测定,分别计算回收率,每个添加水平做3 个重复。
1.4 数据统计分析
2 结果与分析
2.1 固相萃取前处理条件的优化
HODEs为极性较大的羟基类脂肪酸,常用的提取溶剂有乙酸乙酯、甲醇、乙醚等。生物样本(如血液、血浆、组织等)中的HODEs多采用经典的液液萃取进行提取[31];但肉制品富含蛋白质、脂类,杂质较多,简单的液液萃取难以满足HPLC-PDA法同时测定肉制品中4 种HODEs异构体含量的要求。本实验参考姜春姣等[30]的方法,采用液液萃取结合固相萃取的方法提取、净化肉制品中4 种HODEs异构体,并着重对固相萃取的条件进行优化。
2.1.1 样品提取溶剂的选择
选择甲醇为提取溶剂[30],提取液中的甲醇含量同时影响HODEs、杂质在C18小柱上的保留,高甲醇含量的提取液有利于降低杂质在C18小柱上的保留,但也可能造成HODEs回收率降低。为了确定提取液中甲醇的最佳体积分数,本实验以不同体积分数甲醇溶液(50%~80%)作为溶剂,配制质量浓度均为0.5 μg/mL的4 种HODEs异构体的混合标准溶液,分别取5 mL标准溶液上样到C18小柱,再采用2 mL甲醇进行洗脱,观察提取液中甲醇体积分数变化对HODEs提取回收率的影响,如图1所示。结果表明,在甲醇体积分数50%~65%范围内,HODEs的回收率均保持在90%以上,无显著差异,但进一步加大甲醇体积分数,回收率显著下降,因此本实验将提取液的甲醇体积分数确定为60%。
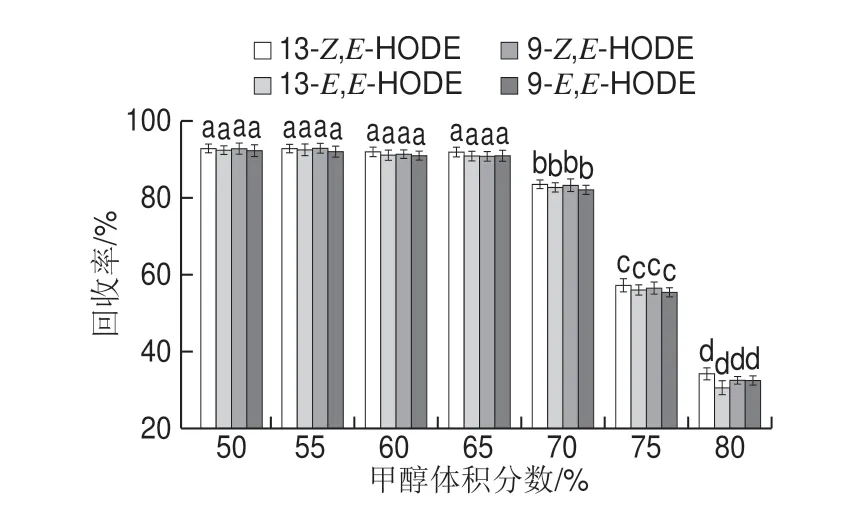
图1 提取液甲醇体积分数对回收率的影响Fig.1 Effect of various methanol and water mixtures on recoveries of analytes
2.1.2 洗脱液用量的优化
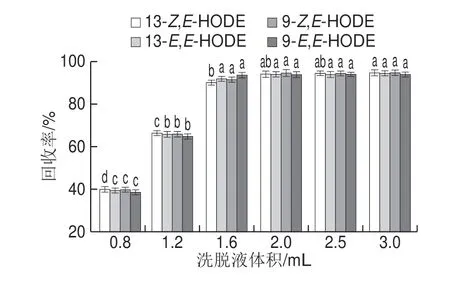
图2 洗脱液体积对回收率的影响Fig.2 Effect of eluent volume on recoveries of analytes
为了让吸附在小柱上的HODEs尽可能被完全洗脱,本实验选择甲醇为HODEs的洗脱液,用体积分数为60%的甲醇溶液配质量浓度均为0.5 μg/mL的4 种HODEs异构体的混合标准溶液,取5 mL标准溶液上样到C18小柱,观察不同体积的甲醇溶液(0.5~3 mL)洗脱对HODEs回收率的影响,结果如图2所示。随着洗脱液用量加大,回收率显著上升,当洗脱液体积≥1.6 mL 时,HODEs的回收率没有显著差异(P>0.05),均保持在90%以上。为确保HODEs完全洗脱并提高实验效率,本实验确定的洗脱液甲醇的用量为2 mL。
本实验建立的液液萃取结合固相萃取的样品处理方法,可以有效去除样品中的杂质,避免HODEs色谱分析受杂质干扰。
2.2 色谱条件的优化
HODEs含有共轭双键,在231~235 nm波长范围内具有特征性紫外吸收[32]。本实验采用PDA在190~400 nm范围内扫描,结果表明13-Z,E-HODE、13-E,E-HODE、9-Z,E-HODE和9-E,E-HODE分别在234、231、234 nm和231 nm波长处有最大吸收。为实现同时测定肉制品中的13-Z,E-HODE、13-E,E-HODE、9-Z,E-HODE和9-E,EHODE,选择234 nm为检测波长。
HODEs是含有一个羟基的十八碳二烯酸,具有一定极性,可以选择反相柱(如C18柱)或正相柱(如硅胶柱)进行液相色谱分离。本实验比较了4 种HODEs异构体在C18柱和硅胶柱上的保留行为,4 种HODEs在硅胶柱上表现出了更好的色谱分离效果;在选择硅胶柱正相分离的基础上,观察流动相中正己烷、异丙醇、乙酸组成比例对HODEs保留时间、峰形、分离度以及杂质干扰的影响,确立流动相中正己烷-异丙醇-乙酸体积比为98.3∶1.6∶0.1。
在本实验设定的色谱条件下,4 种HODEs异构体均具有适中的保留时间(分别为12.55、18.17、22.31 min和24.89 min)和良好的峰形,与杂质完全基线分离。13-Z,E-HODE(3.0 μg/mL)、13-E,E-HODE(4.2 μg/mL)、9-Z,E-HODE(6.0 μg/mL)、9-E,EHODE(2.8 μg/mL)混合标准品的色谱图见图3A,一种肉制品S12中HODEs的色谱图如图3B所示。
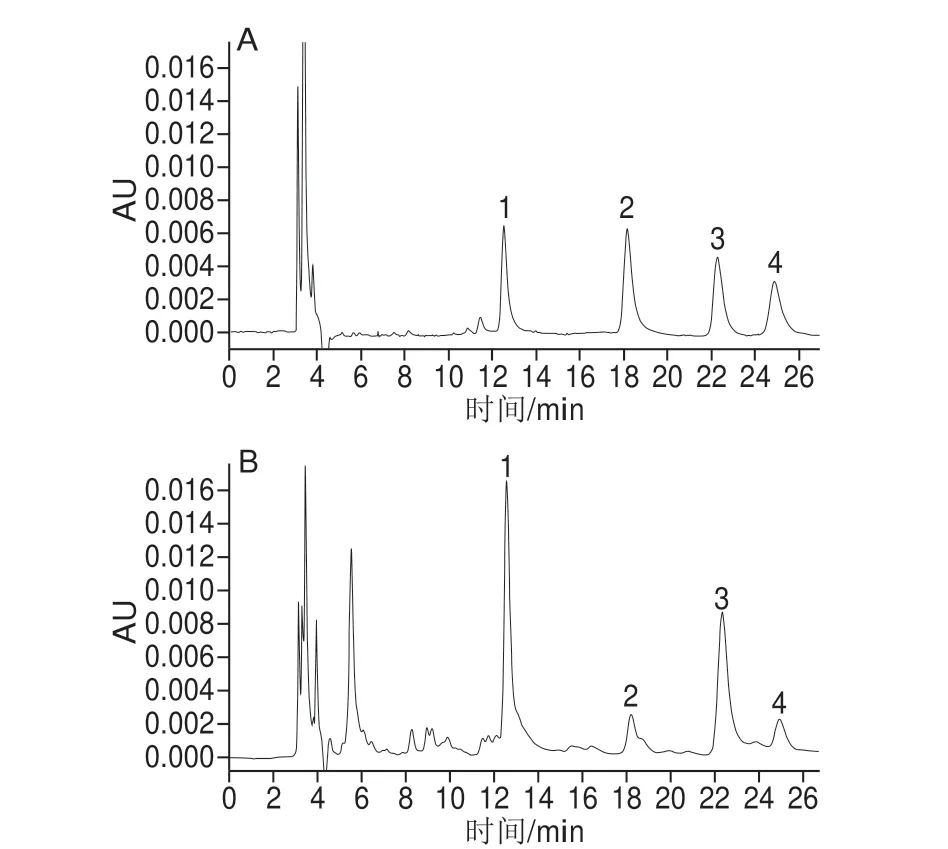
图3 混合标准品(A)与肉样品(B)的HPLC图Fig.3 HPLC chromatograms of HODEs in mixed standard solution (A) and in meat sample (B)
2.3 方法学验证结果
2.3.1 线性范围、线性回归方程及检出限和定量限
方法的线性关系结果见表1,4 种分析物的相关系数(R2)均大于0.999,在设定的范围内,4 种HODE的质量浓度与峰面积均呈现良好的线性关系。检出限分别为0.15、0.07、0.18、0.12 μg/mL,定量限分别为0.50、0.24、0.64、0.40 μg/mL,根据样本处理换算,检出限分别为0.075、0.035、0.090、0.060 μg/g,定量限分别为0.25、0.12、0.32、0.20 μg/g。
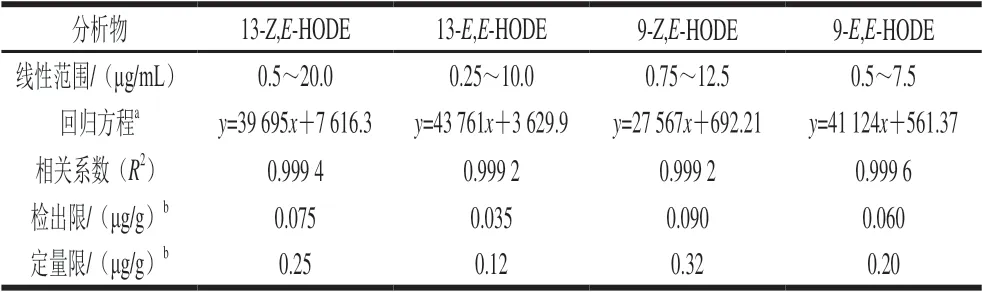
表1 HPLC法测定HODEs的线性范围、回归方程、检出限以及定量限Table 1 Calibration curve equations, linear ranges, detection limits and quantification limits for HPLC analysis of HODEs
2.3.2 精密度实验结果
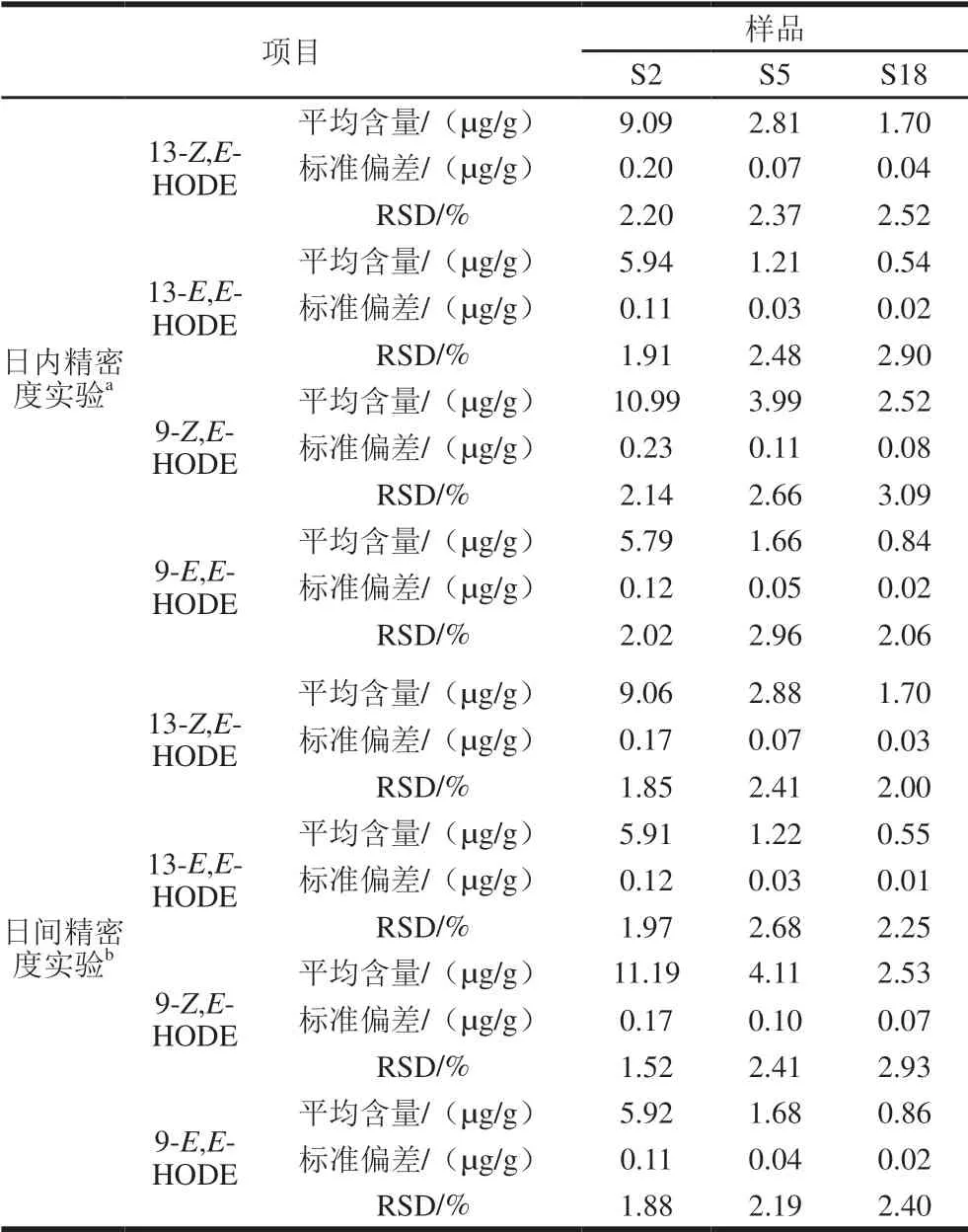
表2 精密度实验结果(n=3)Table 2 Results of precision tests (n= 3)
如表2所示,13-Z,E-HODE、13-E,E-HODE、9-Z,E-HODE和9-E,E-HODE的日内RSD范围分别为2.20%~2.52%、1.91%~2.90%、2.14%~3.09%和2.02%~2.96%;日间RSD范围分别为1.85%~2.41%、1.97%~2.68%、1.52%~2.93%和1.88%~2.40%,表明本实验建立的检测方法精密度良好。
2.3.3 回收率实验结果
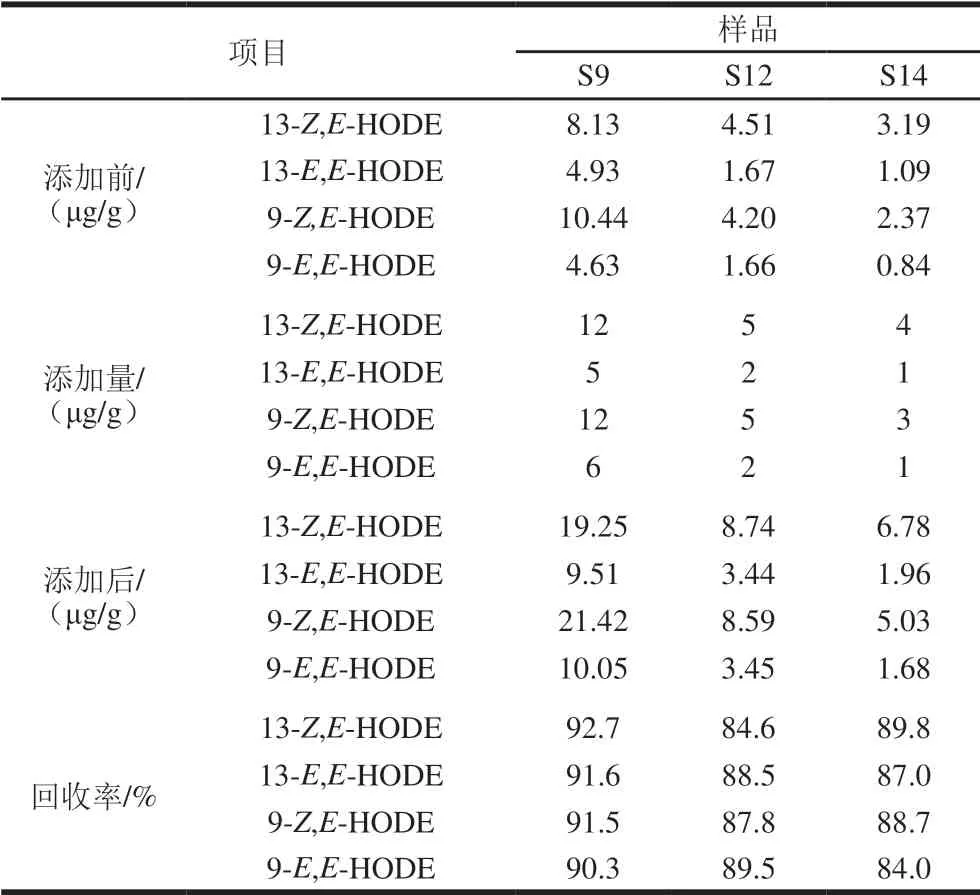
表3 不同添加水平回收率测定结果(n=3)Table 3 Recoveries of analytes at different spiked levels (n= 3)
由表3可知,13-Z,E-HODE、13-E,E-HODE、9-Z,E-HODE和9-E,E-HODE的回收率范围分别为84.6%~92.7%、87.0%~91.6%、87.8%~91.5%、84.0%~90.3%,不同添加水平的平均回收率分别为89.03%、89.03%、89.33%、87.93%。表明本实验建立的同时测定肉制品中4 种HODEs含量的分析方法具有较好的准确性。
2.4 实际样品分析结果
利用本实验建立的检测方法对市售的咸肉、腊肉、腊肠、中式火腿等18 种肉制品(其中生腌肉制品11 种,即食肉制品7 种)进行分析,结果发现所有样品中均含有4 种HODE,结果见表4。
从表4可以看出,所有样本均检测出13-Z,E-HODE、13-E,E-HODE、9-Z,E-HODE和9-E,E-HODE。在生腌肉制品中,13-Z,E-HODE、13-E,E-HODE、9-Z,E-HODE和9-E,E-HODE含量范围分别为2.78~9.10、0.85~5.79、3.45~11.02 μg/g和0.78~5.82 μg/g;即食肉制品中4 种目标分析物的含量范围分别为1.73~5.29、0.56~3.77、2.37~4.69 μg/g和0.84~2.41 μg/g。
生腌肉制品与即食肉制品中的HODEs含量未见显著差异(P>0.05),表明加工温度对HODEs含量的影响较小,HODEs具有较好的热稳定性。从表4还可以看出,无论是13-HODE还是9-HODE,其中Z,E-异构体的含量均明显高于E,E-异构体的含量,但18 个样本(13-Z,E-HODE+9-Z,E-HODE)/(13-E,E-HODE+9-E,E-HODE)的比值为1.40~3.66,变化幅度较大,表明不同产品之间脂质氧化途径(酶促和非酶促氧化)对总体脂质氧化的贡献存在显著差异。
表4 18 种肉制品中13-Z,E-HODE、13-E,E-HODE、9-Z,E-HODE和9-E,E-HODE的含量(,n=3)Table 4 Contents of 13-Z,E-HODE, 13-E,E-HODE, 9-Z,E-HODE and 9-E,E-HODE in 18 meat products (n= 3)

表4 18 种肉制品中13-Z,E-HODE、13-E,E-HODE、9-Z,E-HODE和9-E,E-HODE的含量(,n=3)Table 4 Contents of 13-Z,E-HODE, 13-E,E-HODE, 9-Z,E-HODE and 9-E,E-HODE in 18 meat products (n= 3)
注:同列字母不同表示差异显著(P<0.05)。
样本 含量/(μg/g)13-Z,E-HODE 13-E,E-HODE 9-Z,E-HODE 9-E,E-HODE生腌肉制品S1 7.59f 0.06c 3.47f 0.03f 8.88f 0.06c 3.47f 0.06e S2 9.10f 0.03a 5.79f 0.05a 11.02f 0.04a 5.82f 0.03a S3 7.71f 0.09c 2.84f 0.03g 8.81f 0.10c 1.67f 0.05hi S4 3.03f 0.07l 0.85f 0.04o 5.66f 0.10f 2.43f 0.11g S5 2.78f 0.02m 1.21f 0.03m 4.05f 0.03j 1.62f 0.03i S6 5.11f 0.05g 2.84f 0.03g 6.95f 0.06d 3.38f 0.07f S7 5.94f 0.14e 1.91f 0.03i 3.45f 0.09m 0.78f 0.01l S8 6.44f 0.06d 4.65f 0.04c 6.22f 0.05e 4.13f 0.01c S9 8.13f 0.04b 4.93f 0.03b 10.44f 0.10b 4.63f 0.03b S10 3.53f 0.04j 1.79f 0.01j 3.90f 0.03k 1.34f 0.02j S11 5.88f 0.08e 3.60f 0.12e 4.83f 0.09g 3.59f 0.07d S12 4.51f 0.05h 1.67f 0.05k 4.20f 0.05i 1.66f 0.03hi S13 5.29f 0.07f 2.70f 0.05h 4.69f 0.04h 2.41f 0.03g S14 3.19f 0.03k 1.09f 0.06n 2.37f 0.02o 0.84f 0.01l S15 2.88f 0.03m 1.54f 0.03l 3.58f 0.03l 1.72f 0.02h S16 5.19f 0.06fg 3.77f 0.03d 2.42f 0.03o 1.68f 0.03hi S17 3.83f 0.11i 1.98f 0.01i 2.50f 0.03no 0.95f 0.01k S18 1.73f 0.02n 0.56f 0.01p 2.55f 0.03n 0.85f 0.02l即食肉制品
3 结 论
本实验通过样品处理条件和色谱条件的优化,建立了同时测定肉制品中4 种HODEs异构体的HPLC-PDA分析方法。经方法学验证,本方法操作简便、适用性强,在本实验设定的范围内线性关系良好、准确度高、重复性好,可用于同时测定肉制品中13-Z,E-HODE、13-E,E-HODE、9-Z,E-HODE和9-E,E-HODE的含量。对18 种市售肉制品的检测结果表明,肉制品中普遍含有HODEs,其形成机制、影响因素及其潜在健康风险等值得进一步研究。
