T9SS蛋白质分泌系统及其在微生物降解多糖过程中的功能
2021-03-01陈晓艺
陈晓艺,方 程,王 辛,赵 鑫
(大连工业大学 生物工程学院,辽宁 大连 116034)
0 引 言
分泌系统在细菌的生命活动中发挥着重要作用,细胞通过分泌系统从外界环境中摄取营养物质、进行细胞间的信号传递、分泌毒力(致病)因子以及抵御宿主免疫系统的攻击等[1-3]。近几十年来,人们对革兰氏阴性菌的蛋白质分泌途径进行了深入的研究,迄今共发现了9种不同类型的分泌系统,分别被命名为Ⅰ~Ⅸ型分泌系统。待分泌的物质通过贯穿细胞被膜的专一性通道被直接运送到胞外(T1SS、T3SS、T4SS、T6SS),或先通过细胞内膜上的Sec通道从胞质被转运至周质空间,再进一步跨细胞外膜被分泌至胞外(T2SS、T5SS、T7SS、T8SS、T9SS)[4-6]。
其中,T9SS是新近发现的一类蛋白分泌系统,最初也被称为PorSS系统,仅在拟杆菌门的部分微生物中存在,具有较高的种属特异性[6-8]。以T9SS为分泌系统的微生物主要是牙龈卟啉单胞菌(Porphyromonasgingivalis)和约氏黄杆菌(Flavobacteriumjohnsoniae),前者是主要的牙周炎致病菌,后者则是一种常见的环境微生物,具有滑动运动的特征。目前已经鉴定到很多通过T9SS转运的蛋白质,它们在结构上具有一定的共性,除了具有N末端信号肽外,C末端还普遍存在一个保守结构域——CTD。CTD由大约80个氨基酸残基组成,负责引导蛋白质跨越细胞外膜而被运送至胞外[9]。围绕T9SS的结构、功能以及相关分泌蛋白的性质已展开了许多研究,取得了一定的进展。
1 T9SS的发现
T9SS最初在牙龈卟啉单胞菌P.gingivalis中被发现,该菌株属于革兰氏阴性菌,专性厌氧,是诱发牙周炎的主要病原菌之一[10]。P.gingivalis能够向胞外大量分泌一系列牙龈蛋白酶,它们大部分吸附在细胞外膜的外表面上,少部分以游离状态存在。这些蛋白酶能够攻击和破坏宿主的先天防御机制,是重要的毒力因子[10]。P.gingivalis在血琼脂平板上培养时,由于亚铁血红素在细胞表面积累,菌落正常呈黑色,而这与细胞表面牙龈蛋白酶的蛋白水解活性及其与血凝素和血红蛋白的结合能力密切相关[11]。自发突变产生的白色或浅褐色突变株,其细胞表面的蛋白酶活性均显著下降[11]。因此,牙龈蛋白酶的胞外活性与P.gingivalis菌落颜色之间的正相关性成为研究菌株蛋白分泌途径的有效筛选工具。
PorT(PG0751/PGN_0778)是第一个被成功鉴定的编码牙龈蛋白酶分泌途径中关键转运蛋白的基因,它的缺失导致突变株的胞外牙龈蛋白酶活性显著降低,大量的酶蛋白以没有活性的酶原形式滞留在细胞周质空间中[12]。研究者们将含有PorT基因的牙龈卟啉单胞菌与不含有PorT基因的多形拟杆菌(Bacteroidesthetaiotaomicron)的蛋白质组/基因组进行了比对,从中筛选出除PorT外另外55个可能参与的基因。随后,通过对这些基因进行同源基因突变实验,最终确定了11个与牙龈蛋白酶跨细胞外膜转运及激活过程相关的基因。由于以上基因编码的蛋白质与其他已知分泌系统(T1SS-T8SS)的任何组分都没有序列相似性,因此研究者们认定这是一个全新的分泌系统,并将其命名为PorSS分泌系统[7],该系统各组分蛋白的命名大多以“Por”为前缀,以表示这些蛋白质在牙龈蛋白酶分泌过程中的重要作用,而后者则与细胞产卟啉类黑色素密切相关[13]。为了与已有分泌系统命名一致,后又将其更名为Ⅸ型分泌系统,即T9SS[9,14]。
随着T9SS在拟杆菌门中的发现,越来越多研究表明,不仅是P.gingivalis,很多其他病原微生物如福赛斯坦纳菌(Tannerellaforsythia)和鸭疫里默氏杆菌(Riemerellaanatipestifer)等,同样是利用这一系统向胞外分泌毒力因子或效应蛋白,从而具有入侵宿主细胞以及抵御宿主免疫系统攻击的能力[15-18]。另一方面,以哈氏噬纤维菌(Cytophagahutchinsonii)和约氏黄杆菌(Flavobacteriumjohnsoniae)为代表的非病原环境微生物,也通过T9SS向胞外分泌几丁质酶和纤维素酶,使细胞能够利用几丁质和纤维素等生物大分子作为营养物质。同时,这两类微生物细胞都具有滑动运动的特性,而研究发现T9SS的核心组件本身也是重要的滑动蛋白编码基因[7-8,19]。所以,对不同的拟杆菌门微生物而言,T9SS既可以是病原菌攻击宿主细胞的有力武器,也可以是细胞运动以及从外界环境摄取营养物质的有效工具[20-21]。
2 T9SS的组成
T9SS本身是一个多蛋白复合体,以P.gingivalis的T9SS为例,目前已知至少由18个组分构成(PorT、Sov、PorK、PorL、PorM、PorN、PorP、PorQ、PorU、PorW、PorV、PorX、PorY、PorZ等),整体结构跨越了细胞质、细胞内膜、周质空间和细胞外膜。实验证实,敲除任何一个基因,都会导致突变株菌落呈白色,且分泌蛋白在周质空间非正常积累[22]。P.gingivalis的T9SS结构预测如图1所示[23]。
在P.gingivalis的基因组中,porPKLMN这5个基因连续排列并且同时转录,但PorP蛋白的表达水平比其他4个蛋白要低很多,研究者推测可能有单独的启动子负责调控porKLMN这5个基因的转录[24]。PorK是嵌于细胞外膜上的一个脂蛋白,与PorN相连接,PorL和PorM两个蛋白则位于细胞内膜上(图1)。这5个蛋白共同组成了一个分子质量超过1 000 ku的复合体,构成了跨细胞膜的转运通道[7]。同样,在F.johnsoniae中,这4个蛋白在细胞滑动和代谢几丁质的过程中也起着关键作用,重要的滑动黏附素SprB和RemA都是通过这一通道被分泌到胞外的[19]。在众多T9SS的外膜组分中,PorK和PorN被认为是细胞分泌物质以及滑动运动最不可或缺的两个蛋白。结构分析表明,二者均具有32~36个亚基组成的大型环状结构,直径50 nm,高度约7 nm,且环状结构大部分位于外膜的周质空间一侧。据推测,PorK或PorN的环状结构至少有一部分参与组成了外膜上的运输孔道[25]。
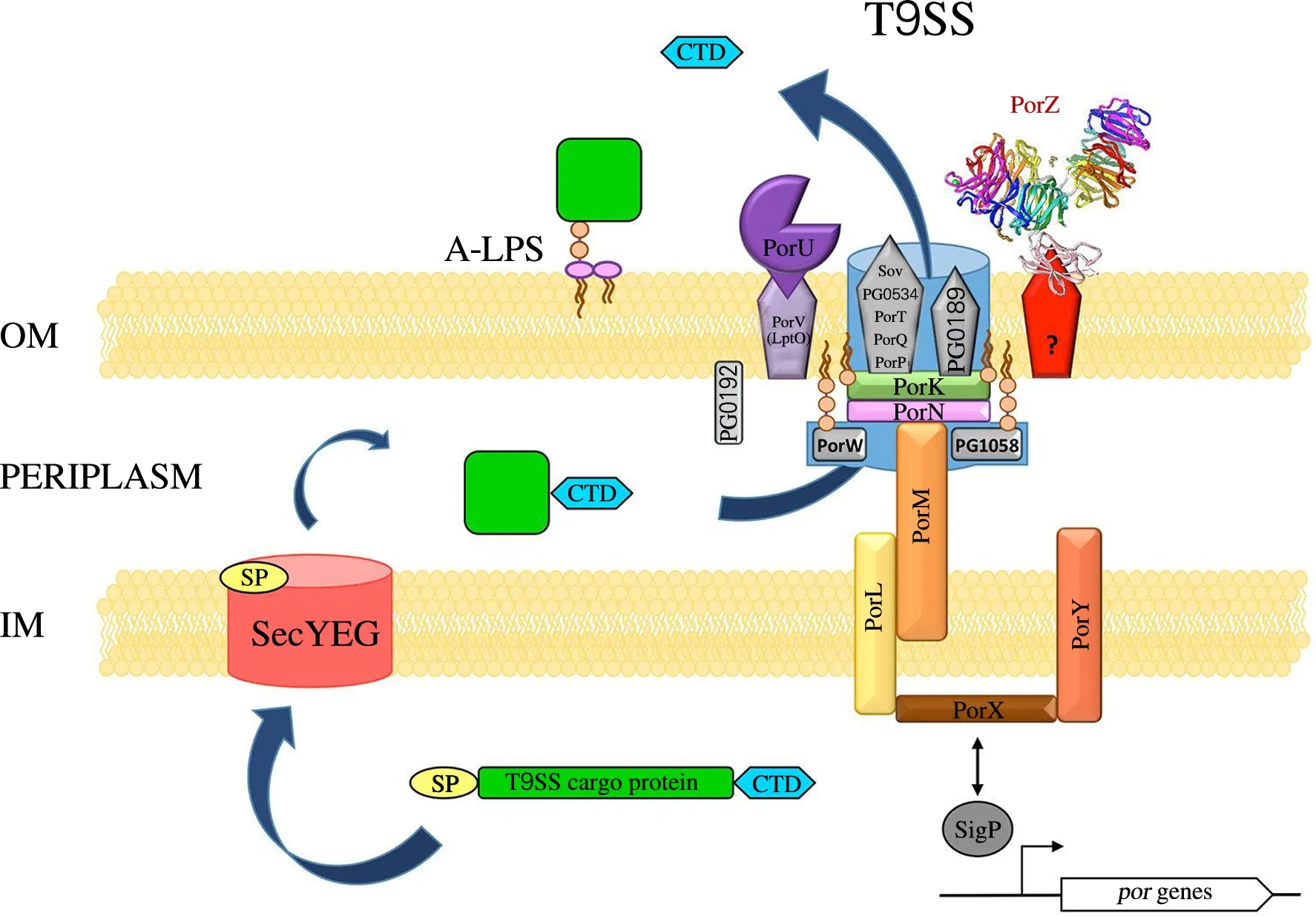
图1 P.gingivalis的T9SS的结构预测Fig.1 Structural prediction of T9SS of P.gingivalis
根据现有的研究数据,大多数通过T9SS分泌的蛋白都是锚定在细胞外膜的表面,而非游离释放到培养基中。在P.gingivalis中,分泌蛋白在一个转肽酶的作用下切除C末端的部分肽段(转运信号),并与脂多糖A-LPS共价结合,进而被锚定在细胞外膜上,这个转肽酶即PorU[26]。PorU与其他3个蛋白(PorV、PorQ和PorZ)一起共同构成了一个“附着复合体”,在分泌蛋白锚定到外膜的过程中起关键作用[27]。PorV和PorQ都是外膜上的内在蛋白,而PorU则通过PorV而被锚定在外膜上[28]。缺失PorU和PorZ基因的突变菌株,分泌蛋白会部分游离释放到培养基中,且其C末端信号肽未被切除[26-27],由此推测PorU和PorZ参与了分泌蛋白信号肽切除及与A-LPS的结合过程。PorU的主要功能是作为转肽酶进行肽段的切除,而PorZ则主要通过识别脂多糖A-LPS的甘露糖重复单元,帮助分泌蛋白与A-LPS共价结合。同时,PorZ对PorU在外膜上的固定也起到了一定的作用。相反,缺失PorV和PorQ基因的P.gingivalis突变菌株,细胞表面则完全没有锚定分泌蛋白[27]。实验表明,PorV与PorU的功能有相似之处,也能够锚定细胞分泌的蛋白,在敲除PorU的突变株中,分泌蛋白可通过PorV的作用而被锚定在细胞表面。
除蛋白外,T9SS还包含很多其他组分,但目前对它们的结构和功能研究报道相对较少。PorP虽然在基因组中与PorKLMN相连,但PorP的蛋白表达水平几乎比另外4个蛋白低了20倍。尽管PorP在空间结构上与PorK等其他组分相连,但却不是外膜上分泌通道的核心组成成分。在约氏黄杆菌F.johnsoniae中存在多个PorP的同源基因,SprF是其中之一。在基因组上,SprF与SprB相连,后者编码一种滑动黏附蛋白。SprF对SprB的分泌表达至关重要,但SprF的敲除并不影响细胞的滑动性,说明细胞还存在其他PorP同源基因在调控滑动黏附蛋白的分泌表达[29]。PG1058也是P.gingivalis细胞T9SS的一个重要组分,它的发现相对较晚[22]。PG1058是一个脂蛋白,定位于细胞的周质空间,由TolB和肽聚糖结合模块组成。与PorP类似,PG1058在F.johnsoniae及其他滑动细菌中也存在多个同源蛋白,推测可能参与了某些特定底物的分泌表达。PorT和Sov是最先被鉴定的两个T9SS组分,但是它们的功能至今尚未得到解析。PorT、Sov和PorW都是P.gingivalis细胞T9SS的基本组成成分,在F.johnsoniae中,这3个基因的缺失会导致细胞不能正常分泌几丁质酶,但不影响细胞的滑动性。
PorX和PorY两个蛋白既是T9SS的组成成分,也是系统的调控因子。PorX是响应调控因子同源蛋白,PorY是组氨酸激酶感应蛋白[30]。敲除其中任何一个基因,都导致T9SS各组分表达下调,同时细胞的牙龈蛋白酶活性降低[7,31]。研究表明,PorY能够自我磷酸化,并与PorX相互作用,使得后者也被磷酸化修饰。PorX在细胞质中与信号分子SigP结合,后者又进一步与T9SS各组分基因的启动子区域结合[31]。由此,PorY感应来自周质空间的信号,并通过PorX和SigP级联反应来上调T9SS各组分基因的表达。
3 T9SS的蛋白转运机制
蛋白质通过T9SS分泌运输的过程可分为两步。首先,分泌蛋白在其自身N端信号肽的引导下,通过细胞内膜上的Sec转运通道被运送至周质空间;然后,信号肽被切除,蛋白质折叠成具有稳定构象的结构。其次,蛋白质进一步在其CTD的引导下,通过细胞外膜上的易位子被转运至胞外。已有研究结果表明,所有通过T9SS运送的蛋白质普遍具有保守的CTD结构域。以牙龈蛋白酶RgpB为例,去掉C末端72个氨基酸残基的突变体蛋白只能在细胞周质空间中积聚,不能被分泌到胞外[9]。CTD的完整性对RgpB的分泌至关重要,即使仅仅缺失2个氨基酸残基,或者其中保守氨基酸残基发生突变,都直接导致蛋白质不能够被正常分泌[15]。
与其他分泌系统相比,T9SS转运蛋白质有其独特的特点,即被转运的蛋白质大多数都被锚定在细胞表面,只有少数以游离状态分泌到培养基质中。实验表明,锚定在外膜上的分泌蛋白,其分子质量通常比理论值大20 ku左右,这是由于蛋白质共价结合了一个脂多糖分子A-LPS[32]。A-LPS本身是镶嵌在细胞外膜上的,从而使与之结合的蛋白质被锚定在了细胞表面。在电镜下观察P.gingivalis细胞,发现被锚定在细胞表面的牙龈蛋白酶形成了一层包裹着细胞的致密电子层[26]。A-LPS合成有缺陷的突变株细胞表面则没有电子层包裹,细胞分泌的蛋白质均以游离态被释放到培养基中[33]。A-LPS与分泌蛋白的结合机制目前尚未得到解析,推测这一过程主要是在PorU的作用下完成的。PorU具有转肽酶功能,能够切除分泌蛋白的CTD结构域,随后将新生成的C末端与A-LPS通过一段连接肽结合起来,而这一模式与革兰氏阳性菌细胞表面蛋白质与肽聚糖层的结合十分相似[34]。
4 T9SS转运的典型蛋白
通过T9SS转运的蛋白质,按照功能不同大致可分为两类:一类是能够分解复杂生物大分子的酶,包括蛋白酶、糖苷水解酶(主要是几丁质酶和纤维素酶)、核酶和脂酶等;另外一类则主要是黏附素、血细胞凝集素以及一些富含亮氨酸的蛋白质等。
P.gingivalis产生的牙龈蛋白酶RgpA、RgpB和Kgp是研究相对深入的T9SS转运蛋白。它们是细胞分泌的主要毒力因子,能够结合肽段和血红素,摄取血红蛋白为细胞提供营养;同时,它们通过自身的吸附性以及异常调节宿主的免疫防御和炎症响应系统,在细胞致病机理中也发挥着重要作用[35-36]。类似的,T.forsythia利用T9SS分泌一系列毒素因子,包括各种细胞表层蛋白、富含亮氨酸的重复蛋白以及一类被称为KLIKK的蛋白酶等[17,37-38]。其中两个重要的分泌蛋白TfsA和TfsB构成了细胞表面的S层。S层结构较为规则,在细胞表面形成了一层被膜,能够帮助菌株黏附并入侵人牙龈上皮细胞,且能够延迟人体免疫系统对细菌细胞的识别[39]。
C.hutchinsonii能够高效降解结晶纤维素,且降解过程依赖于完整的活细胞。已有研究证实,该菌株利用T9SS向胞外分泌纤维素酶,并将酶蛋白锚定在细胞表面[20]。SprP是C.hutchinsonii细胞中发现的PorP(P.gingivalis)同源蛋白,基因敲除实验表明,SprP基因缺失的突变株失去纤维素降解能力,且依赖于T9SS分泌的胞外蛋白CHU_3105含量也显著降低;同时,突变株也丧失了在纤维素表面的滑动能力,推测可能与滑动蛋白SprB不能够被正常分泌有关[20]。已知C.hutchinsonii基因组中有147个基因编码的蛋白质含有CTD结构域,包括5个β-1,4-内切葡聚糖酶以及大量与纤维素和其他多糖结合和降解相关的蛋白质。C.hutchinsonii细胞能够在纤维素表面滑动、与纤维素底物吸附以及降解结晶纤维素的过程均与T9SS转运的蛋白质密切相关。
C.hutchinsonii的细胞外膜上存在许多纤维素酶组分,它们可能共同构成了一个蛋白复合体[40]。例如,蛋白CHU_3220的C末端具有保守的CTD结构域,定位在细胞外膜上,可与纤维素结合,是菌株降解结晶纤维素过程中不可或缺的一个酶组分。敲除CHU_3220基因后,突变株细胞表面的内切葡聚糖酶活性显著降低,说明CHU_3220基因可能同时调控了其他内切葡聚糖酶的表达[40]。CHU_1276和CHU_1277也是两个外膜蛋白,二者本身都不具有纤维素酶活性,但均参与调控多个纤维素酶基因的表达或者与维持细胞表面的纤维素酶活性密切相关[41-42]。Zhu等[43]系统研究了C.hutchinsonii的所有内切葡聚糖酶编码基因及其编码蛋白的细胞定位和活性,发现其中5个酶蛋白(Cel5A、Cel9A、Cel9B、Cel9D和Cel9E)是通过T9SS被分泌并锚定在细胞外膜上,它们负责将纤维素分解为小分子的纤维寡糖,继而跨过细胞外膜被运送至周质空间,再进一步被定位于周质空间的两个内切酶Cel5B和Cel9C分解,由此共同组成了一个完整的纤维素降解酶系。
F.johnsoniae与C.hutchinsonii同属拟杆菌门,具有滑动运动能力,并且能够降解几丁质。研究表明,F.johnsoniae利用T9SS向胞外分泌滑动黏附蛋白SprB和RemA,使菌体细胞能够在固体表面滑动[19]。SprB蛋白的分子质量大小为669 ku,是一个高度序列重复的蛋白质,它从外膜开始形成向外的长丝状,并沿细胞表面呈螺旋状运动[44]。在F.johnsoniae细胞中还含有多个SprB同源蛋白,它们可能赋予细胞在不同固体表面滑动的能力。RemA的分子质量为152 ku,与SprB一样呈螺旋状运动。RemA蛋白中心含有一个凝集素结构域,能够结合细胞自身分泌的多糖[45]。F.johnsoniae正是借助SprB和RemA等蛋白来推动细胞的自我滑动,而这些黏附蛋白如何锚定在细胞外膜上并沿着一定轨迹运动的机制还有待进一步的研究。
F.johnsoniae能够分泌几丁质酶ChiA,该蛋白由两个GH18家族结构域组成,分子质量为168.9 ku。ChiA基因的插入突变导致细胞失去利用几丁质的能力,表明ChiA是该菌株降解几丁质的关键酶蛋白。与上述大多数T9SS转运蛋白不同的是,ChiA是以游离态被分泌到培养基质中,而不是锚定在细胞表面;同时,序列分析结果显示,ChiA的CTD与已知的其他CTD序列相似性很低,可能是一种新型的CTD[46]。因此,CTD或许是决定T9SS转运蛋白细胞定位的关键影响因素。此外,GldK、GldL、GldM、GldN、SprA、SprE或SprT等编码滑动蛋白相关基因的缺失则会导致分泌的ChiA被锚定在细胞外膜上,说明F.johnsoniae的很多滑动蛋白本身也是T9SS的组成成分,它们除了赋予细胞运动能力,同时也直接参与酶蛋白的胞外转运过程。
5 总结与展望
与其他已知蛋白分泌系统相比,T9SS的功能与运送机制相对较为独特,主要体现在两个方面:一是其组成构造较为复杂,由分布在细胞内膜、周质空间和细胞外膜上的多个组分相互连接构成,所转运的蛋白底物首先跨细胞内膜被运送至周质空间,经过一定加工后再进一步穿过细胞外膜被运送到胞外;二是被运送到胞外的蛋白质,大多数不能够游离分泌到培养基质中,而是通过与外膜上的脂多糖A-LPS共价结合而被锚定在细胞表面,并由此形成S层被膜结构(某些微生物中)。因此,以T9SS作为细胞主要蛋白分泌系统的微生物,它们的致病性、运动性、降解生物大分子等生理功能与细胞膜上的锚定蛋白密切相关。
尽管已经初步了解了T9SS的组成及蛋白转运模式,但对其各组分的结构和功能、各组分之间如何相互连接形成复杂的蛋白复合体、蛋白质如何通过外膜上的运送孔道以及蛋白转运过程的调控机理等具体信息还知之甚少。随着生物学研究技术的不断发展,特别是冷冻电镜(crys-EM)技术的应用,将有助于更好地了解T9SS这一复杂“细胞机器”的构造,解析蛋白转运机制。
以C.hutchinsonii和F.johnsoniae为代表的微生物能够吸附在不溶性多糖底物表面并进行滑动,它们降解多糖的过程依赖于细胞与底物的紧密吸附。锚定在细胞外膜上的多糖降解酶在底物降解过程起着至关重要的作用,但它们是如何被转运并锚定在细胞表面、CTD是否影响酶蛋白的空间结构及活性、纤维寡糖又是如何被转运至周质空间等问题目前尚未得到解析。对T9SS结构和功能的深入解析将有助于更清晰地了解微生物的多糖降解机制,或许也有助于发现新型的多糖降解酶类,从而为工业酶制剂的研发提供新的思路。
