尿液细胞来源iPSCs-NSCs联合3D打印支架移植修复大鼠急性脊髓损伤的研究
2021-02-28李长明邵荣学邓小梅赵士杰王拓全仁夫
李长明 邵荣学 邓小梅 赵士杰 王拓 全仁夫
急性脊髓损伤(acute spinal cord injury,ASCI)是一种严重的中枢神经系统损伤,发病率和致残率均较高,常导致受损平面以下运动和感觉功能障碍[1]。ASCI 的主要损伤机制包括轴突的失连、神经细胞的凋亡与坏死等。目前尚无有效的方法治疗ASCI。近年来,组织工程学的兴起为ASCI 的治疗提供了新方向,并取得了不少进展[2-3],其基本思路是生物支架+种子细胞原位移植于受损脊髓处,提供细胞再生的微环境及通路,以期重塑传导束及促进轴突再生。本研究通过对尿液细胞(urine cell,UC)进行重编程建立诱导性多能干细胞(induced pluripotent stem cells,iPSCs),并定向分化为神经干细胞(neural stem cells,NSCs),再将3D 打印支架载iPSCs 分化的NSCs 移植至受损脊髓,探讨3D 打印支架载UC 来源重编程iPSCs 分化的NSCs 对ASCI大鼠的疗效。
1 材料和方法
1.1 实验动物和标本 SPF 级8 周龄雄性SD 大鼠42只,体重(200±10)g;SPF 级5 周龄雄性SD 小鼠14 只,体重(21±3)g;均购于湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004。均分笼饲养于屏障环境内,室温20~25 ℃,12 h 光照/12 h 黑暗交替的环境,自由摄食摄水。操作均严格遵守《实验动物管理条例》的相关规定。采集1 例23 岁健康成年男性的尿液作为实验标本,经杭州市萧山区中医院医学伦理委员会审批通过,患者签署知情同意书。
1.2 试剂和仪器 聚乳酸-羟基乙酸共聚物(PLGA)(aladdin P133293)、胶质纤维酸性蛋白(GFAP)(ab53554)、微管蛋白(β-tubulin Ⅲ)(ab52623)、生长相关蛋白43(GAP-43)(ab75810)、巢蛋白(Nestin)(OM264981)、FBS(F8687)均购于美国Sigma 公司;神经元特异性烯醇化酶(NSE)(bs-10445R)购于中国Bioss 公司;原代神经元细胞基础转染(Amaxa Basic Nucleofector)试剂盒(VPI-1003)购于德国Lonza 公司;ALP 检测试剂盒(KL-ALP-Ra)购于上海康朗生物科技有限公司;硫酸肝素(QC30767)购于美国GlpBio 公司;牛血清白蛋白(BSA)购于中国AMRESCO 公司;荧光显微镜(CKX53)购于日本Olympus 公司;冰冻切片机(CMll00)购于德国Leica 公司;高速冷冻离心机(HC-3018R)购于安徽中科中佳科学仪器有限公司;生物信号采集处理系统(medlab-1)购于南京卡尔文生物科技有限公司;3D 打印机购于杭州捷诺飞生物科技有限公司;冷场发射高分辨扫描电镜(S-4300)购于日本Hitachi 公司;可控性皮质损伤撞击仪(mode 6.3)购于美国Custom Design 公司;手术器械购于江苏鱼跃医疗设备股份有限公司。
1.3 UC 来源iPSCs 的分离及鉴定 UC 分离及构建iPSCs 参照Zhou 等[4]的方法。采集1 例23 岁健康成年男性尿液200 ml,进行细胞培养,按1∶2~1∶3 传代,取第3 代UC 进行转染,电转染使用原代神经元细胞基础转染试剂盒,培养6~10 d,待iPSCs 克隆出现(细胞出现聚集、核质比增大等变化),用玻璃针收集iPSCs 克隆并按1∶3~1∶5 进行传代。挑取克隆前1 d 接种饲养层细胞,在显微镜下,选取状态好的单克隆细胞用ALP 检测试剂盒进行ALP 活性检测(ALP 染色)。并将1×106个iPSCs 注入5 周龄雄性SD 小鼠背部皮下,HE 染色验证畸胎瘤的形成。iPSCs 使用4%多聚甲醛室温下固定15 min,0.25%(V/V)聚乙二醇辛基苯基醚(Triton X-100)/PBS 透膜10 min,室温下4%(W/V)BSA 封闭1 h。随后4 ℃下一抗孵育过夜,室温下二抗孵育30 min,以4'6-二脒基-2-苯基吲哚(DAPI)染核。使用的一抗为抗OCT4(1∶350,兔多克隆)、抗NANOG(1∶1 000,兔单克隆)、抗TRA-1-81(1∶100,小鼠单克隆)、抗TRA-1-60(1∶100,小鼠单克隆)。二抗为山羊抗兔Alexa Fluor 488或568、山羊抗鼠Alexa Fluor 647。以DAPI 进行细胞核染色,荧光显微镜下观察并采集图像。
1.4 iPSCs 向NSCs 的分化及鉴定 将消化下来的iPSCs 集落移至培养皿中,差速贴壁30 min,去除分化细胞及饲养层细胞,收集悬浮细胞集落,用拟胚体(EBs)培养基重悬,转移至细菌培养皿中悬浮培养,隔天换液;悬浮培养4 d 形成成熟的EBs;应用维甲酸+无血清培养基诱导,在EBs 培养基中诱导培养4 d,换成无血清培养基贴壁培养。筛选培养得到的神经球样克隆命名为iPSCs-NSCs。取诱导分化好的iPSCs-NSCs 置于含10%FBS 的培养基中培养,培养基先用0.1%明胶包被,采用免疫荧光检测β-tubulin Ⅲ和GFAP 表达。在培养板中将已爬好细胞的培养皿用4%多聚甲醛固定15 min,在培养皿内滴加5%BSA,37 ℃封闭30 min,移液枪吸掉封闭液,培养皿内滴加一抗Nestin(1∶200),4 ℃孵育过夜,PBS 冲洗,移液枪吸干培养皿内多余液体后滴加荧光二抗FITC(1∶100),37 ℃孵育45 min,PBS冲洗,滴加DAPI 避光孵育5 min 进行细胞核染色。PBS冲洗多余的DAPI,50%甘油封闭培养皿,荧光显微镜下观察iPSCs-NSCs 特异性标志物Nestin 的表达。
1.5 3D 打印硫酸肝素-胶原蛋白支架 采用3D 打印技术联合真空冷冻干燥法。取Ⅰ型胶原蛋白100 mg、Ⅱ型胶原蛋白10 mg 和硫酸肝素1 mg,加入PLGA 200 mg,充分混匀,增稠剂提高浆料的黏稠性与稳定性。打开氮气,将配制好的浆料置于物料桶内,设置好分压。选择打印针头并进行物料出料校准。设置与调节打印参数,包括出料温度、平台温度等。三维支架成型,室温下放置4 h 以上,45 与60 ℃分别恒温干燥箱中持续干燥12 h。电镜下观察支架形态。
1.6 支架细胞预处理 将3D 支架截成约2~3 mm 的小段,置于干细胞培养基中浸泡48 h 后,在无菌操作台中风干,灭菌备用。将iPSCs-NSCs 细胞培养至第7 天时,消化计数,将1×106个细胞浓缩为0.2 ml,滴于预处理过的支架上,置于培养箱中2 h 后用于实验。
1.7 实验动物分组 42 只8 周龄雄性SD 大鼠按照随机数字表法分为模型组、支架模型组和iPSCs-NSCs 组3 组,每组14 只。
1.8 ASCI 模型建立 采用改良Allens 法通过可控性皮质损伤撞击仪(mode 6.3)构建ASCI 模型。常规护理1 周后进行实验。大鼠麻醉后去除椎板,3 组均切除2~3 mm 长损伤处脊髓,给予不同干预措施。模型组于损伤处滴入DMEM 培养液0.2 ml,支架模型组于损伤处植入载DMEM 培养液的2~3 mm 支架,iPSCs-NSCs 组于损伤处植入载iPSCs-NSCs 的2~3 mm 支架。
1.9 观察指标
1.9.1 开放领域运动测试(basson beattle bresnahan,BBB)评分 干预1、2、4、6、8 周后,采用BBB 评分评价3 组大鼠关节协调功能,总分为21 分,分数越高,关节协调情况越好。
1.9.2 Tarlov 和Rivlin 评分 干预8 周后,采用Tarlov和Rivlin 评分评价3 组大鼠后肢运动功能,Tarlov 评分总分5 分,Rivlin 评分总分66 分,分数越高,后肢运动功能越好。
1.9.3 神经电生理检测 干预8 周后,采用生物信号采集处理系统(medlab-1)用电极针进行测定,给予直流方波电脉冲刺激,直至可刺激观察到后肢轻微抽搐为止,强度为7.5 V,波宽为0.2 ms,频率为3 Hz,叠加达到50 次。计算机叠加处理测试结果,记录运动、感觉诱发电位潜伏期长短和振幅的变化,观察神经电生理学情况。
1.9.4 病理检查 干预8 周后,10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉后开胸,自左心室插管至主动脉,然后剪开右心耳,先灌注PBS 150 ml,再用含4%中性多聚甲醛的0.9%氯化钠溶液250 ml 进行心脏灌注、固定。沿原手术正中切口,再次逐层暴露受损节段脊髓组织,切取原损伤区域胸段脊髓,石蜡包埋,连续5 μm 切片。HE 染色,光镜下观察3 组大鼠脊髓组织病理学改变情况。
1.10 统计学处理 采用SPSS 16.0 统计软件。计量资料以表示,组间比较采用单因素方差分析,方差齐时,两两比较采用LSD-t 检验;方差不齐时,两两比较采用Tamhane's T2 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 UC 来源iPSCs 构建 从尿液样本分离培养UC,结果显示第3 代UC 呈现纤维样或上皮样,状态良好(图1a,见插页)。ALP 染色显示,UC 来源iPSCs 克隆呈阳性(图1b,见插页)。畸胎瘤试验中,形成的畸胎瘤具有3 个胚层特征:软骨(中胚层)、肠上皮(内胚层)、神经上皮(外胚层)(图2)。表明UC 来源的iPSCs 在体内具有向3 个胚层分化的能力,进一步验证UC 来源iPSCs 的全能性。

图1 尿液细胞(UC)及诱导性多能干细胞(iPSCs)ALP 染色结果所见[(a:尿液中分离得到的第3 代UC,×25;b:UC 来源的诱导性多能干细胞(iPSCs)ALP 染色呈阳性,×100)]

图2 畸胎瘤组织切片HE 染色所见[a:肠上皮(内胚层);b:软骨(中胚层);c:神经上皮(外胚层);HE 染色,×200]
2.2 UC 来源iPSCs 的鉴定 免疫荧光检测显示,UC来源iPSCs 表达全能性蛋白OCT4、NANOG、TRA-1-81、TRA-1-60(图3,见插页),说明UC 来源iPSCs 呈全能性状态。
2.3 iPSCs-NSCs 鉴定 免疫荧光显示iPSCs-NSCs 中Nestin 目的蛋白呈现为绿色荧光,细胞核经DAPI 染色呈现蓝色荧光,结合上述细胞形态分析可以鉴定出细胞为iPSCs-NSCs(图4a,见插页)。免疫荧光显示βtubulin Ⅲ目的蛋白呈现为红色荧光,细胞核经DAPI 染色呈现蓝色荧光,细胞大量表达,分化能力良好(图4b,见插页)。免疫荧光显示GFAP 目的蛋白呈现为红色荧光,细胞核经DAPI 染色呈现蓝色荧光,细胞向周围延伸,分化能力良好(图4c,见插页)。

图3 诱导性多能干细胞(iPSCs)表达全能性蛋白免疫荧光标记结果(a:全能性蛋白OCT4 表达;b:全能性蛋白NANOG 表达;c:全能性蛋白TRA-1-81 表达;d:全能性蛋白TRA-1-60 表达;×200)

图4 诱导性多能干细胞(iPSCs)-神经干细胞(NSCs)中免疫荧光鉴定结果[a:iPSCs-NSCs 特征性标志物巢蛋白(Nestin)表达;b:iPSCs-NSCs 中微管蛋白(β-tubulin Ⅲ)表达;c:iPSCs-NSCs 中胶质纤维酸性蛋白(GFAP)表达;×100]
2.4 3D 打印支架 3D 打印技术联合真空冷冻干燥法制造的3D 打印支架具有完美的内部三维立体多孔结构,扫描电镜显示支架横截面呈疏松的多孔状,孔径大小在50 μm 左右(图5)。
2.5 3 组大鼠BBB 评分比较 干预2、4、6、8 周后,iPSCs-NSCs 组大鼠BBB 评分均高于模型组和支架模型组,差异均有统计学意义(均P<0.05);而模型组和支架模型组大鼠BBB 评分比较差异均无统计学意义(均P >0.05),见表1。

图5 3D 打印支架(a:3D 打印的支架;b-c:扫描电镜显示支架横截面呈疏松的多孔状,b×50,c×200)
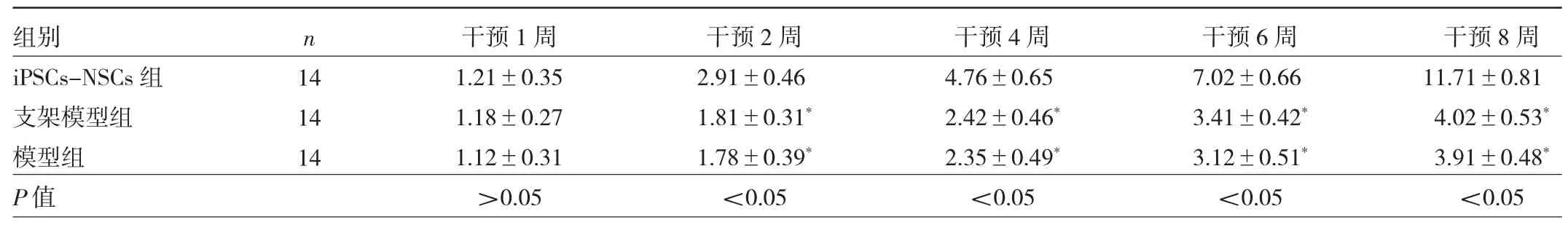
表1 3 组大鼠BBB 评分比较(分)
2.6 3 组大鼠Tarlov 和Rivlin 评分比较 干预8 周后,iPSCs-NSCs 组大鼠Tarlov 和Rivlin 评分均高于模型组和支架模型组,差异均有统计学意义(均P<0.05);而模型组和支架模型组大鼠Tarlov 和Rivlin 评分比较差异均无统计学意义(均P >0.05),见表2。

表2 3 组大鼠Tarlov 和Rivlin 评分比较(分)
2.7 3 组大鼠神经电生理检测结果比较 干预8 周后,iPSCs-NSCs 组大鼠运动和感觉诱发电位潜伏期均短于模型组和支架模型组,运动和感觉诱发电位振幅均大于模型组和支架模型组,差异均有统计学意义(均P<0.05);而模型组和支架模型组大鼠运动和感觉诱发电位潜伏期、振幅比较差异均无统计学意义(均P >0.05),见表3。

表3 3 组大鼠神经电生理检测结果比较
2.8 3 组大鼠脊髓组织病理学改变比较 干预8 周后,HE 染色显示模型组大鼠脊髓组织受损,组织水肿明显,细胞稀疏(图6a);支架模型组大鼠脊髓组织受损程度轻于模型组,组织水肿,细胞稀疏(图6b);iPSCs-NSCs 组大鼠脊髓组织生长良好,细胞致密,空泡减小,组织水肿消失(图6c)。
3 讨论
本研究发现,ASCI 大鼠经UC 来源重编程iPSCs-NSCs 联合3D 支架移植治疗后,BBB 评分、Tarlov 和Rivlin 评分均明显升高,提示UC 来源重编程iPSCs-NSCs 联合3D 打印支架移植可明显改善大鼠神经功能的恢复。ASCI 后造成上下行神经传导束中断及微环境受损是ASCI 后截瘫的根源。因此,如何促进上下行神经传导束连接及微环境的修复是治疗ASCI 的重点。近年来组织工程技术为ASCI 的治疗提供了新的思路:良好的生物相容性及合理的支架设计可以为受损轴突提供桥梁,种子细胞依附于桥梁上并增殖,为促进脊髓神经功能的恢复提供了良好的基础。本研究创新性地利用3D 打印支架将种子细胞修饰后移植于受损脊髓处,结果表明3D 打印支架+iPSCs-NSCs 联合能明显促进大鼠运动、感觉功能的恢复和神经元的恢复。
NSCs 是一种多能干细胞,有永久的增殖能力及分化多向性,是理想的种子细胞。NSCs 可分化成星型胶质细胞、少突胶质细胞和神经元,具有神经营养、免疫调节和修复的作用,能促进感觉和认知功能恢复,在治疗神经系统疾病中的前景较好[5]。但既往研究中,NSCs多来源于人类胎儿组织或者胚胎干细胞[6-7],受到伦理学限制难以在临床中广泛应用。随着iPSCs 的出现,研究者们发现iPSCs 可以作为NSCs 的来源,并且在动物实验中发现iPSCs-NSCs 同样可以改善ASCI 后运动功能障碍,iPSCs-NSCs 移植到大鼠脊髓受损区域后,在该区域大部分分化成神经元,但是这项技术仍然受制于iPSCs 本身提取效率的低下[8]。虽然目前iPSCs 可以从多种细胞[9-12]中通过重编程获得,但是大部分方法取样是损伤性的,导致收集样本较困难。Zhou 等[4]报道人UC可被诱导为iPSCs,具有无创、费用低的优点。这些细胞大部分保留正常的功能且容易获得,是进行体外研究的理想细胞来源。因此本研究收集UC 作为细胞来源,诱导iPSCs,并进行畸胎瘤检测及全能性蛋白免疫荧光检测,证实了UC 来源iPSCs 具有与胚胎干细胞相似的全能性。本体外实验中,NSCs 的特征性标志物Nestin表达,证实了iPSCs 向NSCs 的成功分化。GFAP 和βtubulin 分化良好,说明本实验成功将UC 重编程为iPSCs,并诱导UC 来源iPSCs 分化为NSCs。
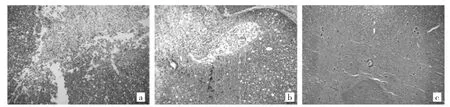
图6 干预8 周后各组大鼠HE 染色结果所见[a:模型组;b:支架模型组;c:诱导性多能干细胞(iPSCs)-神经干细胞(NSCs)组;HE 染色,×100]
生物支架在治疗中应确保种子细胞保留在脊髓损伤部位,调节微环境及填充病变腔并诱导其定向生长[13]。传统支架多采用高温烧制和模型注塑,精度难以掌控,且不能随意改变支架的孔隙。近年来3D 打印技术可以通过设置不同参数打印不同规格的支架,且具有成型迅速、个性化需求及规模量产等优点[14-15]。3D 打印支架为中空多孔的结构,为上下行传导束的重建和轴突生长提供通道并除去物理隔离,对改善受损组织物理微环境有着积极的作用;本研究打印的支架孔隙约为50 μm,不仅可以提供细胞的依附场所,还可以提供细胞增殖的空间。既往研究证实生物支架+种子细胞具有较好的相容性,能促进大鼠运动及感觉的恢复[16-17]。本实验中iPSCs-NSCs 能在支架孔中黏附、存活以及生长,表明生物支架为iPSCs-NSCs 提供了较好的微环境,促进了神经纤维的再生,因此支架和iPSCs-NSCs 具有较好的相容性,与上述研究结果基本一致。
综上所述,UC 来源iPSCs-NSCs 联合3D 打印支架能促进大鼠运动及感觉功能恢复,但目前仅处于基础实验阶段,应用于临床还需更多、更大的样本参与。UC来源iPSCs-NSCs 和3D 打印支架的联合应用为临床治疗ACSI 提供了更为简便的方法,且更容易通过伦理学审查。
