lncRNA TINCR靶向调控miR-221抑制大鼠心肌细胞凋亡的实验研究
2021-02-27李雨弥张文勇
李雨弥, 章 培, 唐 勇, 谷 子, 张文勇
(四川省成都市第二人民医院, 四川 成都 610017)
在慢性心衰、动脉粥样硬化和缺血性心脏病等心血管疾病发生发展过程中存在着心肌细胞凋亡现象,而它导致的心肌细胞数目减少是引起心肌结构异常、心脏功能紊乱的重要因素之一[1];因此,深入了解心肌细胞凋亡的分子机制对有效抑制其发生进而改善心血管疾病具有重要意义。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200个氨基酸的RNA分子,不具有编码蛋白质的功能,可作为微小RNA(microRNA,miRNA)的前体,可通过与miRNA竞争性结合靶基因信使mRNA(mRNA)的3'非翻译区(Untranslated Region,UTR)和“海绵效应”等机制调控miRNA的表达,在基因转录和转录后水平以及表观遗传学等方面发挥着重要作用,与心血管疾病的发生与发展密切相关[2,3]。近年来,有研究[4]指出,lncRNA组织分化诱导非蛋白编码RNA(tissue differentiation inducing non-protein coding RNA,TINCR)在糖尿病心肌病患者心肌活检和血清中表达下调,且具有抑制心肌细胞凋亡的作用,但具体的调控机制并不完全清楚。miR-221是一种在人类细胞和组织中发现较早和存在较为广泛的miRNA,除了与肿瘤的发生有关外,还可通过影响心肌细胞凋亡参与心血管疾病的发生[5]。本研究采用生物信息学软件预测发现TINCR 3'UTR与miR-221存在互补的结合位点,猜测TINCR可能通过靶向调控miR-221表达发挥抑制心肌细胞凋亡的作用。为了验证上述猜想,本研究开展体外细胞实验加以验证。
1 材料与方法
1.1主要材料:大鼠心肌细胞系H9c2(中科院细胞库),二甲基亚砜试剂(美国Sigma),逆转录试剂盒和荧光定量聚合酶链反应(Polymerase chain reaction,PCR)试剂盒(大连Takara),RNA提取试剂Trizol、脂质体(Lipofectamine)®3000转染试剂和DMEM培养基(美国Invitrogen),胎牛血清和胰蛋白酶(美国Gibco), B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)抗体、Bcl-2相关X蛋白(Bcl-2 Associated X Protein,Bax)抗体(美国Abcam)。总蛋白提取试剂盒(美国Sigma-Aldrich),膜联蛋白 V(Annexin V)-FITC/碘化丙啶(Propidium Iodide,PI)细胞凋亡双染试剂盒(上海复申生物),荧光素酶报告基因检测试剂盒(碧云天生物技术研究所)。psiCHECK-2荧光素酶报告载体(上海海吉浩格生物),pcDNA3.1-TINCR过表达质粒及其对照pcDNA3.1空载体质粒(上海吉满生物),miR-221模拟物及其阴性对照(negative control,NC)(上海吉玛生物),实时荧光定量PCR仪(美国ABI),二氧化碳细胞培养箱(美国Thermo Fisher),酶标仪(美国Molecular Devices),流式细胞仪(美国BD)。
1.2细胞培养、实验分组与脂质体转染:H9c2细胞使用DMEM培养基(含10%胎牛血清)、37℃、饱和湿度、5%二氧化碳条件下的培养箱内常规培养。TINCR影响心肌细胞实验:实验分为①对照组:正常培养;②pcDNA3.1组:转染pcDNA3.1空载体质粒;③TINCR组:转染pcDNA3.1-TINCR过表达质粒;④si-NC组:转染si-NC;⑤si-TINCR组:转染TINCR小干扰RNA si-TINCR。miR-221影响心肌细胞实验:实验分为①miR-NC组:转染miR-221模拟物阴性对照miR-NC;②miR-221组:转染miR-221模拟物;③anti-miR-NC组:转染miR-221抑制剂阴性对照anti-miR-NC;④anti-miR-221组:转染miR-221抑制剂anti-miR-221;⑤pcDNA3.1组:处理同上;⑥TINCR组:处理同上;⑦TINCR+miR-NC组:将pcDNA3.1-TINCR过表达质粒和miR-221模拟物阴性对照miR-NC共转染至心肌细胞;⑧TINCR+miR-221组:将pcDNA3.1-TINCR过表达质粒和miR-221模拟物共转染至心肌细胞中;其中,每组设置3个平行孔。当对数生长期的心肌细胞接种于6孔细胞板,2×105个细胞/孔,常规培养至融合度达75%左右时,根据实验分组参照转染试剂Lipofectamine®3000说明书将2μg pcDNA3.1空载体质粒和pcDNA3.1-TINCR过表达质粒或50nmoL/L miR-221模拟物或miR-NC转染至心肌细胞中。转染48h后,收集各组细胞,分别采用实时荧光定量PCR检测心肌细胞中TINCR和miR-221的表达水平以评价转染效果,MTT法和流式细胞术分别检测细胞活力和凋亡情况,免疫印迹法检测细胞中Bcl-2和Bax蛋白的表达。
1.3实时荧光定量PCR检测TINCR和miR-221的表达:通过Trizol法进行心肌细胞总RNA的提取,采用逆转录试剂盒将RNA进行逆转录;以逆转录产物为模板,根据实时荧光定量PCR试剂盒说明书进行PCR扩增。其中,反应条件为:94℃预变性5min后,进行40个循环阶段:94℃变性20s,60℃退火30s,72℃延伸30s。分别以甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)和U6为内参,根据2-△△Ct法计算心肌细胞中TINCR和miR-221的表达水平。PCR引物序列(合成自上海生工生物工程公司)见表1。

表1 PCR引物序列
1.4双荧光素酶报告基因实验检测TINCR和miR-221的靶向关系:运用DIANA-LncBase Predicted v.2软件预测到TINCR 3'UTR与miR-221存在互补的结合位点;为了进一步验证TINCR和miR-221的靶向结合关系,将TINCR 3'UTR片段克隆扩增至psiCHECK-2荧光素酶载体上,构建TINCR野生型(TINCR-WT)载体质粒;而将TINCR 3'UTR与miR-221结合位点定点突变后,克隆重组至荧光素酶载体上,构建TINCR突变型(TINCR-MUT)载体质粒;参照Lipofectamine®3000说明书将4.0 μg TINCR-WT和TINCR-MUT质粒分别与50 nmoL/L miR-221、miR-NC共转染到心肌细胞。遵循荧光素酶报告基因检测试剂盒说明书的指示,检测心肌细胞转染48h后的荧光素酶活性。
1.5噻唑蓝(Methylthiazolyldiphenyl-tetrazolium bromide,MTT)法检测细胞活力 将转染成功后的心肌细胞和正常培养的心肌细胞接种至96孔细胞板,105个细胞/孔,常规培养48 h后,每孔加入20 μL 0.5% MTT溶液孵育4 h;再以150 μL的二甲基亚砜摇床震荡反应10 min后,上酶标仪在490nm波长处检测各组细胞的吸光值。按照公式:细胞存活率(%)=(实验组吸光值/对照组吸光值)×100%计算各组细胞存活率。
1.6流式细胞术分析细胞凋亡:转染成功后的心肌细胞经磷酸盐缓冲液(Phosphate Buffered Saline,PBS)洗涤2次后,加入400 μL的结合缓冲液,将其浓度调整为105个/mL,吸取100 μL于离心管,依次加入5 μL Annexin-V-FITC、5 μL PI工作液,避光染色15 min。之后补加200 μL 结合缓冲液,置于流式细胞仪进行各组细胞凋亡的检测。
1.7免疫印迹法检测细胞中Bcl-2和Bax蛋白的表达:利用总蛋白提取试剂盒抽提提取心肌细胞的总蛋白,将蛋白样品进行12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,分离后的蛋白电转至聚偏二氟乙烯膜。膜以脱脂奶粉(5%)封闭,2h后加入以1∶1 000比例稀释的Bcl-2、Bax和内参GAPDH抗体,4℃孵育12h;次日,加入以1∶2000比例稀释的二抗,在室温下孵育,2h后滴加化学发光剂,显影、曝光,采用美国Bio-Rad的凝胶成像系统扫描分析心肌细胞中Bcl-2和Bax蛋白的表达水平。

2 结 果
2.1TINCR可与miR-221靶向结合:采用生物信息学软件预测到TINCR 3'UTR区域部分碱基序列可与miR-221互补配对,结果见图1。采用荧光素酶实验进行验证,miR-221模拟物与构建的TINCR-WT共转染后细胞的荧光素酶活性较相应对照miR-NC组明显降低(P<0.05);但miR-221与构建的TINCR-MUT共转染后细胞的荧光素酶活性与对照miR-NC组之间差异无统计学意义(P>0.05),结果见表2。qRT-PCR检测结果如表3所示,与si-NC组比较,si-TINCR组miR-221的表达水平明显升高(P<0.05);与pcDNA-NC组比较,pcDNA-TINCR组miR-221的表达水平显著降低(P<0.05)。

图1 TINCR 3'UTR区域存在与miR-221互补的结合位点
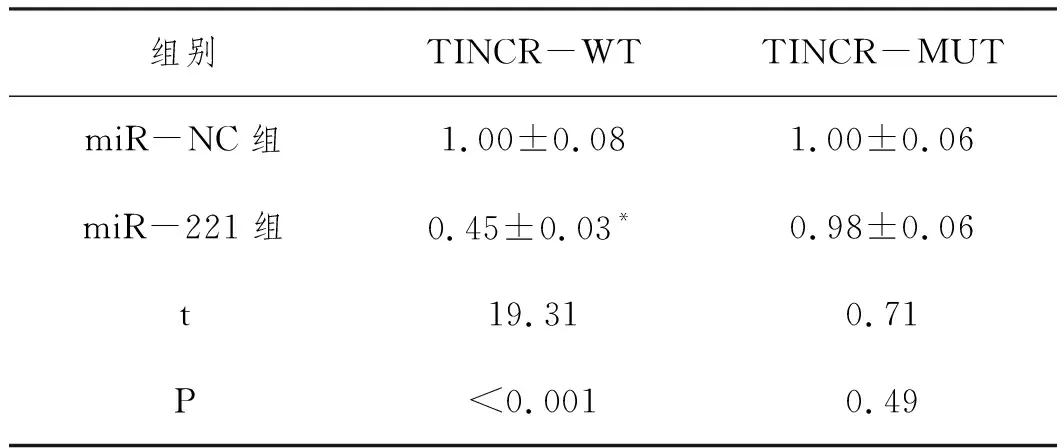
表2 各组细胞荧光素酶活性的比较
2.2TINCR过表达可抑制大鼠心肌细胞中miR-221的表达:实时荧光定量PCR检测TINCR过表达对miR-221的调控作用,结果见表4。与对照组比较,转染TINCR过表达质粒后心肌细胞中TINCR的表达水平明显升高,而miR-221的表达水平明显降低(P<0.05);但转染空载体的pcDNA3.1组细胞中TINCR和miR-221的表达水平与对照组之间差异均无统计学意义(P>0.05)。
2.3TINCR过表达可提高大鼠心肌细胞活力:采用MTT法检测TINCR过表达对大鼠心肌细胞活力的影响,结果见表5。与对照组比较,在TINCR表达上调的TINCR组中存活率明显增加(P<0.05),但细胞存活率在pcDNA3.1组与对照组两组之间的差异无统计学意义(P>0.05)。
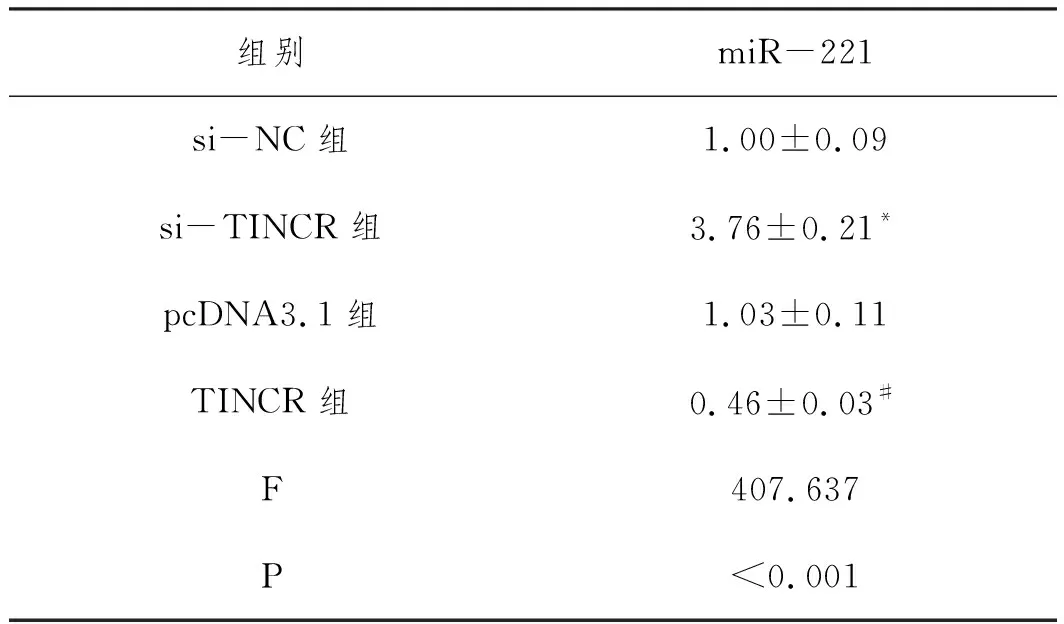
表3 qRT-PCR检测miR-221的表达
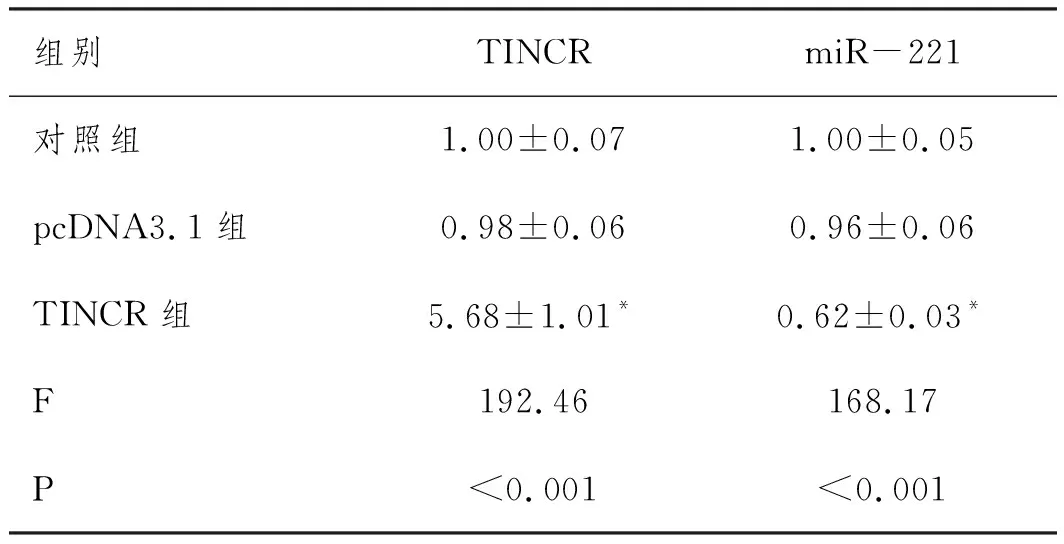
表4 转染后心肌细胞中TINCR和miR-221表达水平的比较
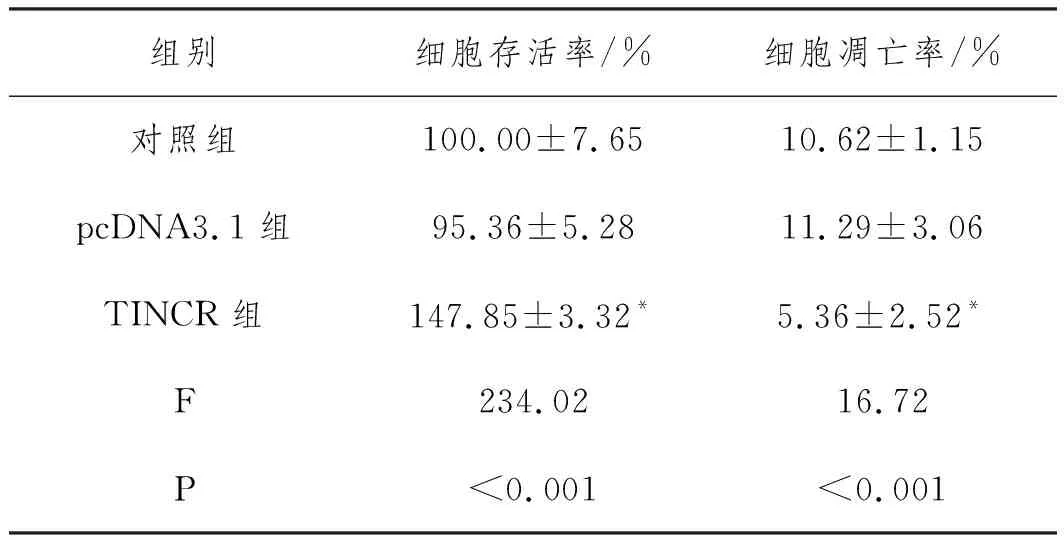
表5 各组细胞存活率的比较
2.4TINCR过表达可抑制大鼠心肌细胞凋亡:采用流式细胞术观察TINCR过表达对大鼠心肌细胞凋亡的影响,结果见图2和表5。与对照组比较,TINCR组细胞凋亡率明显降低(P<0.05),而pcDNA3.1组与对照组之间细胞凋亡率差异无统计学意义(P>0.05)。
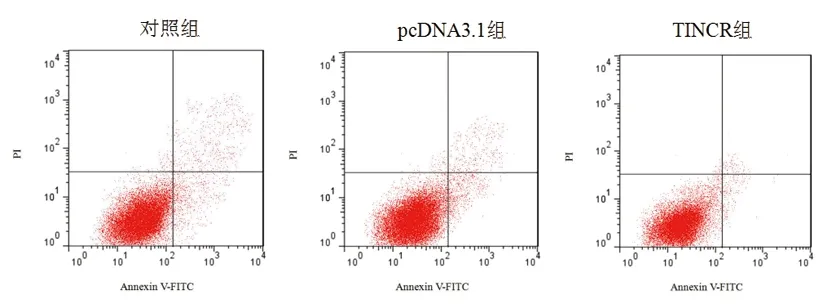
图2 流式细胞术检测TINCR过表达对大鼠心肌细胞凋亡的影响
2.5TINCR过表达上调大鼠心肌细胞凋亡中Bcl-2蛋白并下调Bax蛋白的表达:采用免疫印迹法进一步检测TINCR过表达对大鼠心肌细胞中凋亡相关蛋白Bcl-2和Bax的表达情况,结果见图3和表6。与对照组比较,TINCR组细胞中Bcl-2蛋白的表达水平明显升高,且Bax蛋白的表达水平明显降低(P<0.05);但pcDNA3.1组与对照组两组细胞中Bcl-2和Bax的蛋白表达差异均无统计学意义(P>0.05)。

图3 免疫印迹法检测Bcl-2和Bax蛋白的表达

表6 各组细胞中Bcl-2和Bax蛋白表达水平的比较
2.6miR-221对大鼠心肌细胞凋亡的影响:转染miR-221模拟物或抑制剂后观察miR-221对大鼠心肌细胞凋亡的影响,结果见图4和表7。与miR-NC组比较,miR-221组中miR-221表达水平、凋亡率和Bax蛋白表达水平明显升高,Bcl-2蛋白表达水平明显降低(P<0.05);相较于anti-miR-NC组,anti-miR-221组中miR-221表达水平、凋亡率和Bax蛋白表达水平明显降低,Bcl-2蛋白表达水平明显升高(P<0.05)。

图4 免疫印迹法检测各组中Bcl-2和Bax蛋白的表达
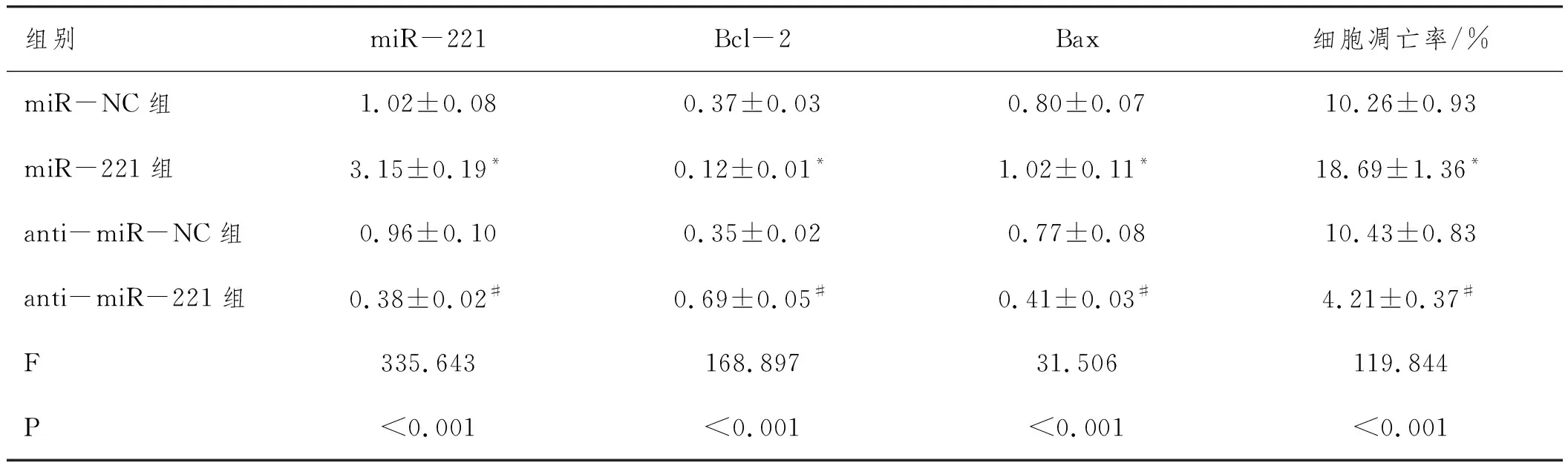
表7 miR-221对大鼠心肌细胞凋亡的影响
2.7上调miR-221表达可逆转TINCR过表达对大鼠心肌细胞凋亡的抑制作用:转染miR-221模拟物后观察miR-221表达对TINCR过表达的大鼠心肌细胞的影响,结果见图5和表8。与pcDNA3.1组比较,TINCR组中miR-221表达水平和凋亡率明显降低,而细胞存活率明显升高(P<0.05);与TINCR组比较,在转染miR-221模拟物的TINCR+miR-221组中miR-221的表达水平和细胞凋亡明显升高,而细胞存活率明显降低(P<0.05);但在转染阴性对照的TINCR+miR-NC组中miR-221表达水平、细胞存活率和细胞凋亡率与TINCR组比较差异均无统计学意义(P>0.05)。
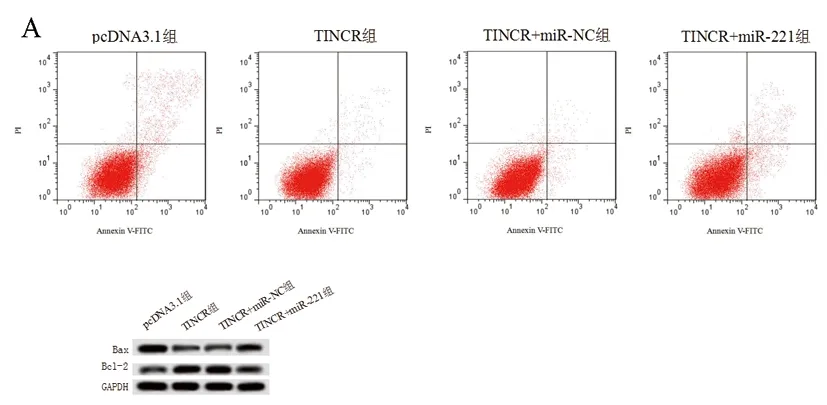
图5 miR-221对大鼠心肌细胞凋亡的影响
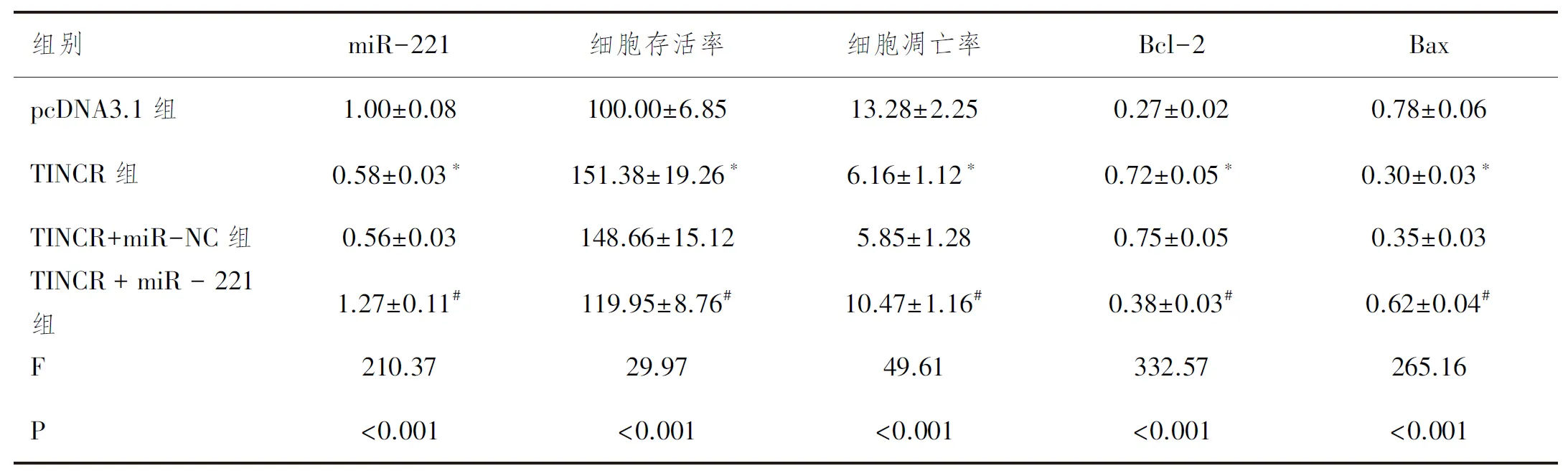
表8 各组细胞中miR-221表达细胞存活率和细胞凋亡率的比较
3 讨 论
心血管疾病是全球最大的公共卫生问题,我国该病的发病率和死亡率呈升高趋势,严重威胁着人们的身体健康[6];因此,深入探讨其发病的相关机制寻找有效的对策刻不容缓。心肌细胞凋亡是引起心力衰竭和心室重构等重要因素,抑制其发生对心肌损伤和心功能改善具有重要意义。在心血管疾病中存在着异常表达的lncRNAs,而这些lncRNAs可能在心肌细胞凋亡过程中发挥着重要作用,而特异性干扰其表达可能是改善心血管疾病的重要策略[7,8]。例如:在慢性心力衰竭患者血浆中生长停滞相关的lncRNA1(Growth arrest associated lncRNA 1,GASL1)表达下调,而上调GASL1表达可通过抑制转化生长因子β1(Transforming Growth Factor-β1,TGF-β1)的活化减少心肌细胞凋亡而改善慢性心力衰竭[9]。在缺血再灌注损伤和过氧化氢处理中lncRNA(five prime to Xist,FTX)呈现低表达,FTX表达增强可通过调控miR-29b-1-5p/BCL2L2表达抑制心肌细胞凋亡,其可能是治疗心肌细胞凋亡相关心脏疾病的新途径[10]。在临床心力衰竭样本和心肌梗死大鼠心肌组织中发现lncRNA母系表达基因3(maternal expressed gene3,MEG3)表达增加,功能实验揭示了MEG3具有促进心肌细胞凋亡的作用,以携带MEG3-shRNA的腺相关病毒9型系统注射心肌后,心力衰竭小鼠的心功能显著改善,特异性敲低MEG3被认为是一种很有前景的治疗心肌梗死策略。
TINCR是一种与表皮细胞分化密切相关的lncRNA,其异常表达可通过与多种分子相互作用,参与胃癌、乳腺癌和肝癌等多种肿瘤的发生发展。近年来,有学者[4]指出,TINCR在糖尿病心肌病患者心肌活检和血清中表达下调,且具有抑制心肌细胞凋亡的作用,但具体的作用机制并不完全清楚。miRNAs是一类长度约18~25个氨基酸的单链非编码RNA,可通过与lncRNA相互作用,参与包括心血管疾病在内的多种疾病的发生发展。miR-221是miRNAs家族成员,其异常表达除了与肿瘤的发生发展有关外,还可通过调控促凋亡蛋白Bax和抑凋亡蛋白Bcl-2的表达影响心肌细胞凋亡,与急性心肌梗死等心血管疾病的发生密切相关。本研究采用生物信息学软件预测到TINCR 3'UTR与miR-221存在互补的结合位点,采用双荧光素酶报告基因实验证实现TINCR 3'UTR可与miR-221靶向结合;同时,上调TINCR表达后发现,大鼠心肌细胞中miR-221表达水平明显降低,下调TINCR表达时miR-221表达水平显著升高。结果表明,TINCR可靶向调控miR-221表达。此外,上调TINCR表达后还发现,大鼠心肌细胞凋亡、Bax蛋白的表达被抑制,而细胞增殖、Bcl-2蛋白的表达被促进。该结果进一步验证了前人[4]所得出的TINCR具有抑制心肌细胞凋亡的作用;此外,还得出了该作用与TINCR上调Bcl-2和下调Bax蛋白的表达有关。另外,转染miR-221模拟物成功上调miR-221表达后发现,Bcl-2蛋白表达下调,而细胞凋亡率和Bax蛋白表达升高;转染miR-221抑制剂成功下调miR-221表达具有相反的结果。另外,上调miR-221表达后,TINCR表达上调对心肌细胞凋亡的抑制作用得到逆转。这提示,TINCR可通过靶向调控miR-221抑制心肌细胞凋亡。
综上所述,TINCR可以抑制心肌细胞凋亡过程中发挥着重要的抑制作用,其作用机制可能与靶向调控miR-221表达有关。该结果进一步阐述了TINCR调控心肌细胞凋亡中的分子机制,也为以TINCR为靶点的心肌细胞凋亡相关心血管疾病的治疗提供了新的参考依据。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
