原发性干燥综合征相关肺囊性病变的影像学特点及危险因素探讨
2021-02-27李德福祝婷婷庞颖
李德福,祝婷婷,庞颖△
原发性干燥综合征(primary Sjögren's syndrome,pSS)是一种进行性系统性自身免疫性疾病,其发病率仅次于类风湿关节炎[1]。该疾病以淋巴细胞浸润为特征,多伴有口干、眼干及角结膜炎等症状,可累及全身各个器官及系统[2],主要靶器官是外分泌腺体(如唾液腺等)。肺部是常见腺外受累器官,10%~20%的pSS 患者可发展为肺部疾病[3]。其相关肺部疾病表现多样,主要包括间质性肺疾病、气道疾病、淋巴增生性疾病[4]。pSS 相关肺囊性病变(cystic lung disease,CLD)发生率较高[5],且多不可逆,严重者可造成患者肺功能损害。目前对于pSS患者肺囊性病变的CT特点所知甚少,单纯针对pSS肺囊性变的危险因素研究也较少。本研究旨在评估pSS相关CLD 的胸部CT 特点及临床危险因素,为早发现、早干预、降低患者肺部受损风险提供更多的参考依据。
1 对象与方法
1.1 研究对象 选取华中科技大学同济医学院附属同济医院风湿免疫科与呼吸内科2012年1月1日—2019年12月30日住院的干燥综合征(Sjögren's syndrome,SS)患者1 228 例。纳入标准:(1)符合2002年国际SS分类标准[6]或2016年美欧共识小组(AECG)的SS 分类标准[7]。(2)胸部CT 检查患者肺部均有异常。排除标准:(1)继发性干燥综合征(secondary Sjögren's syndrome,sSS)患者,如继发于系统性红斑狼疮、类风湿性关节炎、硬皮病、皮肌炎等。(2)已有其他原因的肺部疾病患者,如肺部肿瘤、感染、慢性阻塞性肺疾病等。(3)未行胸部CT检查或胸部CT检查未见异常。最终共纳入pSS相关胸部CT 异常患者181 例,其中女155 例(85.64%),男26 例(14.36%),年龄16~81 岁,平均(52.19±11.70)岁,病程1~480个月,中位病程36(12,84)个月。根据肺部有无囊性病变,将患者分为有囊性变组51 例(28.18%)和无囊性变组130 例(71.82%)。
1.2 一般资料 所有pSS 患者的临床资料均从住院时电子病历中获取,包括性别、年龄、病程、主要症状和体征;实验室检查:C 反应蛋白(CRP)、白细胞计数(WBC)、抗核抗体(ANA)、抗SSA 抗体、抗SSB 抗体、抗Ro52 抗体、IgG、IgA、IgM、补体C3、补体C4 和类风湿因子(RF);肺功能测试(pulmonary function test,PFT)。
1.3 影像学评估 采用GE、Philips或东芝公司的64/128/256排螺旋CT扫描设备。患者均采取仰卧位吸气后屏气状态进行扫描,扫描范围上至肺尖,下至肺底。扫描参数:管电压120 kV,管电流80~250 mA,层厚5 mm,螺距1.0,采用标准算法及骨算法重建,重建层厚1 mm;肺窗位-600 HU,窗宽1 600 HU;纵隔窗位40 HU,窗宽350 HU。CLD 定义为囊壁厚度1~4 mm的含气病变[8],并根据Fleischner协会建议排除其他空腔病变[9],如空洞(壁厚>4 mm)、间隔旁肺气肿(壁厚<1 mm 并位于胸膜下)、肺气肿(无壁的扩大气腔)、肺大疱(壁厚≤1 mm)。从我院RIS 系统工作站提取pSS患者的胸部影像资料,并由2名具有多年胸部诊断经验的放射科医生各自独立阅片,结果有争议时经协商确定。记录CLD、磨玻璃影、实变影、结节、网格影、蜂窝影、支气管壁增厚、支气管扩张、马赛克灌注、树芽征等征象及分布情况,并对CLD的大小、分布及囊内特征做重点评估。部分CLD 患者进行了随访,随访时间平均20.72个月(范围1~84个月)。
1.4 统计学方法 使用SPSS 25.0软件包进行统计分析。连续变量以±s或M(P25,P75)表示,分类变量以例(%)表示。不符合正态分布连续变量组间比较采用Mann-Whitney U检验,符合正态分布连续变量采用独立样本t 检验,分类变量采用χ2检验或Fisher 确切概率法。CLD 的影响因素采用Logistic回归分析,将临床重要变量和单因素分析P≤0.1 的变量纳入多因素Logistic回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 临床特征及实验室检查 相比无囊性变组,有囊性变组的病程长,呼吸困难、口干症状患者的比例高,雷诺现象的比例较低(P<0.05)。2组间性别、年龄及发热、咳嗽、气促、胸闷等差异无统计学意义(P>0.05)。有囊性变组较无囊性变组RF、IgG、IgA、IgM 水平,抗Ro52 抗体和抗SSB 抗体阳性率较高(P<0.05),见表1。
2.2 PFT测试 行PFT的34例患者中,有囊性变组9 例,无囊性变组25 例。2 组间限制性通气功能障碍、阻塞性通气功能障碍、最大通气下降等比例差异均无统计学意义,见表2。
2.3 CLD 影像特征及患者随访 CLD 呈散在随机分布,在双肺各叶及肺内外带分布无显著差异,囊性病变数目不一(约1~107 个),大小不等(直径3.8~48.6 mm),以圆形为主,部分形态不规则,囊壁薄。大部分有CLD者伴随磨玻璃影、结节、小叶间隔增厚或实变等影像表现,有囊性变组与无囊性变组间各项伴随影像表现差异均无统计学意义(表3),仅有CLD 而不伴其他异常影像表现患者3 例(5.88%)。典型影像学表现见图1、2。29例(56.86%)有CLD者进行了随访复查,复查胸部CT平均2.5次(1~10次)。其中26 例(89.66%)复查CLD 病灶无明显变化,2 例分别于25个月和34个月后发现部分CLD病灶增大,见图3。1 例患者68 个月后复查发现肺囊性病变数目稍增多。随访期内20 例(68.96%)肺囊性病变患者予以激素及免疫抑制治疗。
2.4 pSS相关CLD多因素分析 以是否存在CLD为因变量(是=1,否=0),以性别(女性=1,男性=0)、病程、年龄、WBC、CRP、RF、IgG、IgA、IgM、C3、C4、ANA(阳性=1,阴性=0)、抗SSA 抗体(阳性=1,阴性=0)、抗SSB 抗体(阳性=1,阴性=0)、抗Ro52 抗体(阳性=1,阴性=0)为自变量,单因素Logistic 回归分析发现抗Ro52 和抗SSB 抗体是pSS 相关CLD 的影响因素(P<0.05),见表4。以单因素分析中P≤0.1 的指标为自变量,包括RF、病程、抗SSA抗体、抗SSB抗体、抗Ro52 抗体(赋值与单因素分析情况相同,由于2组间WBC、IgA平均绝对值均在正常范围内,因此在纳入多因素分析时被排除在外),进行Logistic 多因素回归分析,结果显示抗SSB 抗体阳性是pSS 相关CLD的独立危险因素(P<0.01),见表5。
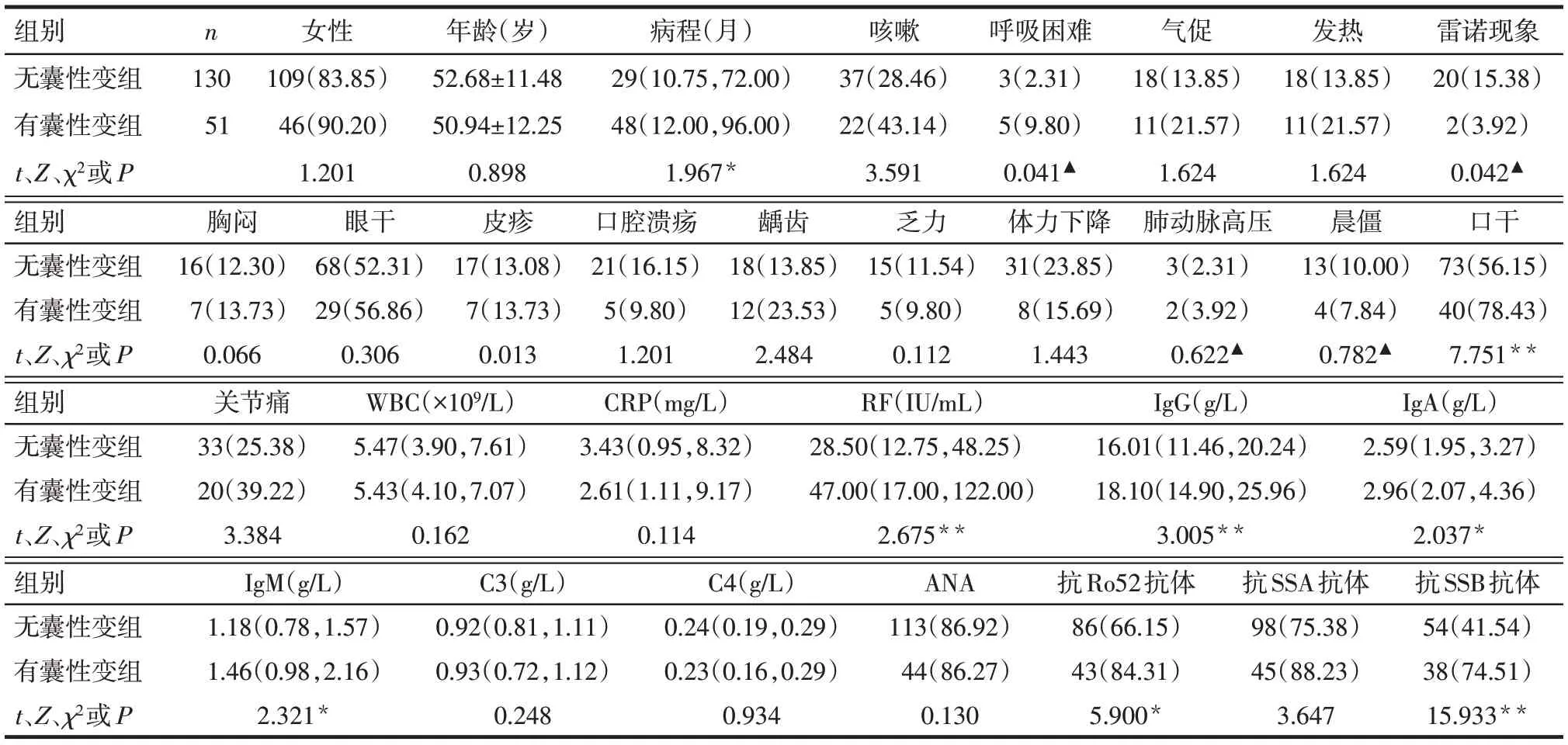
Tab.1 Clinical characteristics and laboratory test results of 181 patients with pSS表1 181例pSS患者的临床特征和实验室检查结果

Tab.2 Pulmonary function test results of 34 pSS patients表2 34例pSS患者肺功能测试结果 例(%)

Tab.3 Image manifestations of chest CT in two groups of patients表3 2组患者肺部CT影像表现 例(%)
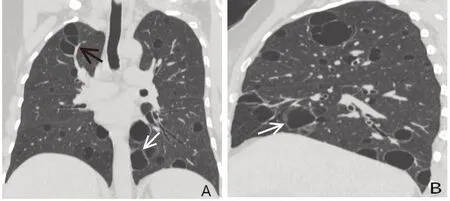
Fig.1 Imaging features of pulmonary cystic change in pSS图1 pSS肺囊性改变的影像学表现

Fig.2 Cystic changes of the lung in pSS and its accompanying signs图2 pSS的肺囊性改变及其伴随征象

Fig.3 Cystic changes and follow-up CT images图3 肺囊性变的CT随访

Tab.4 Analysis of risk factors of pulmonary cystic change of pSS表4 pSS肺囊性变单因素Logistic回归分析

Tab.5 Logistic regression analysis of multiple factors in pulmonary cystic changes of pSS表5 pSS肺囊性变多因素Logistic回归分析
3 讨论
pSS的发病机制较为复杂,可能与遗传、环境和激素因素有关,在遗传易感背景下,环境和激素被认为能够触发这种自身免疫性疾病[10]。肺部pSS存在包括肺部囊性病变等一系列的病理改变[11]。pSS相关CLD的形成机制目前尚不清楚。有学者认为CLD可能是由止回阀机制引起的,在这种机制中,由于血管阻塞后细支气管缺血或淋巴组织压迫细支气管导致其远端空气潴留和肺囊性病变形成[12];但也有学者认为可能与肺泡壁脆性有关[13]。pSS相关CLD危险因素的研究较少且研究结果不一致[8,14]。本研究通过对181 例pSS 的临床症状、肺部CT 影像及实验室检查进行分析,证实口干、呼吸困难、抗SSB 抗体阳性、抗Ro52 抗体阳性及IgG、IgA、IgM、RF 值升高是较常见的特征,同时pSS 相关CLD 患者的病程较长。因此,临床工作中对于长病程的pSS 患者应该全面评估是否有CLD。
pSS相关CLD发生率较高,多伴有磨玻璃影、微小结节及支气管壁增厚等影像学改变[15],而单纯囊性病变较少见(发生率约2.5%~9%)[8]。本研究CLD发生率为28.18%,与以往报道相符,其中单纯囊性变5.88%,伴随征象以磨玻璃影及微小结节多见。大部分报道CLD 以随机分布为主,偶有以双肺下叶或肺中区(研究者将肺等分为上、中、下三区)为主的报道[1,5,15]。本研究CLD呈随机分布,与部分文献[14]报道一致。
本研究根据29例有囊性变组的随访结果发现,绝大部分患者CLD 的数目、大小和内部结构基本稳定,仅2例体积增大,1例数目稍增多。pSS相关CLD动态观察较少有变化,这可能是由于机体自限,免疫抑制阻止其发展的结果[8]。本研究中68.96%的pSS有肺囊性病患者在随访期间予以激素及免疫抑制治疗,免疫抑制剂在某种程度上可能阻止了CLD发展,但CLD发展过程中免疫抑制的具体作用有待进一步研究。
目前未见直接证据表明CLD与PFT谱之间存在相关性[16]。本研究有囊性变组PFT以限制性肺通气功能障碍较多见,其次是肺弥散量下降和最大通气量下降,PFT 各项指标在有囊性变组与无囊性变组间无明显差异,但本次研究PFT测试样本量较小,可能会对结果产生影响。
抗SSA抗体和抗SSB抗体是pSS的标志性抗体,在50%~70%的pSS患者中存在,它们的表达可能与pSS 遗传易感性有关[17],还可能与更严重和进展的病程相关[18]。Zhao 等[19]对我国483 例pSS 患者的临床和免疫学特征研究后发现,抗SSB 抗体在肺受累患者中的检出率很高,认为抗SSB 抗体可能是我国pSS 患者肺受累的预测因素。本研究发现pSS 肺受累抗SSB 抗体阳性率50.83%(92/181),低于上述报道,但有囊性变组抗SSB 抗体、抗Ro52 抗体阳性比例较高,多因素分析抗SSB抗体阳性是pSS相关CLD独立危险因素。在评估SS 患者肺囊性变的危险因素的主要研究中,一项研究发现SS相关CLD的危险因素是高龄(OR=1.1,95%CI:1.0~1.16)、sSS(OR=12.1,95%CI:1.12~130.4)和抗SSA 抗体(OR=26.9,95%CI:1.44~93.61)[8];另一项研究发现pSS 相关CLD 与抗SSB 抗体(OR=12.76,95%CI:2.75~29.17)和淋巴增生性疾病(OR=6.02,95%CI:1.30~27.95)独立相关[14]。此外,有研究发现SS相关CLD患者的抗SSB抗体阳性率较无囊性变者高[5]。然而,这三项研究都是基于小规模的试点研究,且在纳入研究对象时,将sSS也纳入了研究范畴,而本研究SS相关CLD患者例数相对较多,同时剔除了sSS 患者。纳入病例数规模和研究对象范围不同,可能是结果偏差的主要原因。
此外,本研究发现有囊性变组IgG、IgA、IgM、RF值较无囊性变组升高明显,2 组补体C3、C4 水平无明显差异。pSS 相关CLD 与IgG、IgA、IgM、RF 相关研究少见报道。Watanabe等[14]仅将IgG在pSS与sSS间进行比较,但2 组间差异无统计学意义。Lechtman等[5]发现低补体水平在SS相关肺囊性变组与无肺囊性变组间亦无明显差异。这两项研究除样本量较小及研究对象不同外,各类免疫球蛋白或补体水平的数据也相对不完善,这可能使研究结果产生偏差。
综上所述,pSS 相关CLD 有一定的肺部CT 影像特征,抗SSB抗体阳性是其独立危险因素,对于该类患者,积极免疫治疗可能有利于阻止肺囊性病变进展。
