过表达miRNA-495联合替莫唑胺对神经胶质瘤细胞增殖和凋亡的影响
2021-02-27张园园朱淑霞张越华张燕燕
张园园,朱淑霞,张越华,张燕燕
神经胶质瘤是儿童和青少年时期最常见的中枢神经系统肿瘤[1]。替莫唑胺(temozolomide,TMZ)是临床治疗神经胶质瘤的一线药物,但患者对其耐药的情况大大降低了其治疗效果。微小RNA(microRNA,miRNA)-495表达与神经胶质瘤细胞的增殖和凋亡有关,参与神经胶质瘤的发生发展[2-5]。高迁移率族核小体结合域5(high-mobility group nucleosome-binding domain 5,HMGN5)是miRNA-495的直接靶基因之一[6],体外研究表明其可促进神经胶质瘤的发展,与神经胶质瘤的恶性程度相关[7-8],其亦是肿瘤化疗耐药的调控因子[9]。基质金属 蛋 白 酶-9(matrix metalloprotein-9,MMP-9)是HMGN5 的下游基因之一,抑制HMGN5 的表达可降低MMP-9基因的表达[6,10-11]。miRNA-495是否可通过影响HMGN5和MMP-9的表达参与神经胶质瘤的发生发展,并影响神经胶质瘤对TMZ的敏感性尚不明确。本研究通过分析过表达miRNA-495 对神经胶质瘤细胞HMGN5、MMP-9表达的影响,以及过表达miRNA-495联合TMZ对神经胶质瘤细胞增殖、凋亡的作用,并探讨其可能的作用机制。
1 材料与方法
1.1 主要材料 神经胶质瘤细胞株U251、A172由滨州医学院肿瘤分子生物学重点实验室保存;胎牛血清(fetal bovine serium,FBS)购自杭州四季青生物工程材料有限公司;RPMI-1640 购自美国Hyclone 公司;miRNA 类似物(miRNA mimics)和阴性序列(negative control,NC)由上海吉玛生物技术有限公司合成;转染试剂LipofectamineTM2000购自北京索莱宝科技有限公司,长期保存于-20 ℃冰箱,避免反复冻融;Annexin V-FITC/PI 细胞凋亡检测试剂盒购自南京凯基公司;CCK-8试剂盒由同仁化学研究所开发;BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所;细胞裂解液、反转录及扩增试剂盒购自日本TaKaRa 公司;HMGN5、MMP-9 单抗购自武汉三鹰生物技术有限公司,GAPDH兔抗人单克隆抗体、辣根过氧化物酶标记的山羊抗兔IgG 购自碧云天生物技术研究所。TMZ 购自江苏天士力帝益药业。流式细胞仪(Lter EpicsXL)购自美国Beckman-Coulter 公司;自动酶标分析仪(AT-858)购自美国热电Thermo 公司;电泳仪(DYY-8C)、荧光定量PCR 仪(CFX96)、扩增仪(Mastercycler 梯度+原位适配器)均购自美国Bio-Rad公司。
1.2 细胞培养和转染 自液氮罐内(约-196 ℃)取出冻存的U251细胞,于37 ℃恒温水浴箱中快速复苏,接种于含14%完全细胞培养基中,置于37 ℃恒温、5%CO2、饱和湿度的培养箱中培养,待细胞培养基颜色变黄时更换细胞培养基,时间为1~3 d,待细胞密度达80%以上且细胞状态良好时进行传代。取对数生长期U251细胞进行实验。将细胞按5×105/mL接种于12 孔板,依照LipofectamineTM2000 说明书分别转染miRNA-495 mimics(miRNA-495 mimics 组)和miRNA-495 NC(miRNA-495 NC 组),并设未转染U251 细胞组为空白对照组。转染条件:无血清,miRNA-495 mimics(μL)∶转染试剂(μL)=1∶1,转染6 h 后更换完全培养基,以保持细胞良好状态,培养24 h观察转染效率。同样的方法培养、转染A172细胞。
1.3 qPCR 法检测转染后细胞内miRNA-495、HMGN5 mRNA相对表达量的变化 取转染24 h 的U251、A172 细胞,用RNAiso Plus 试剂提取细胞总RNA,需检测RNA 的浓度和纯度。根据说明书配制反转录反应液,总体系为20 μL,合成cDNA反应条件为30 ℃10 min,42 ℃15 min,95 ℃5 min。根据说明书配制PCR反应液,总体系为25 μL,PCR反应条件为95 ℃30 s;95 ℃5 s,60 ℃30 s,共40个循环。引物均由上海生工生物技术公司合成,引物序列见表1。以U6 snRNA为内参,根据CT 值计算RNA 相对表达量变化,计算公式:目的基因 的 量=2-ΔΔCt,ΔΔCt=(Ct目的基因-Ct内参基因)试验组-(Ct目的基因-Ct内参基因)对照组。
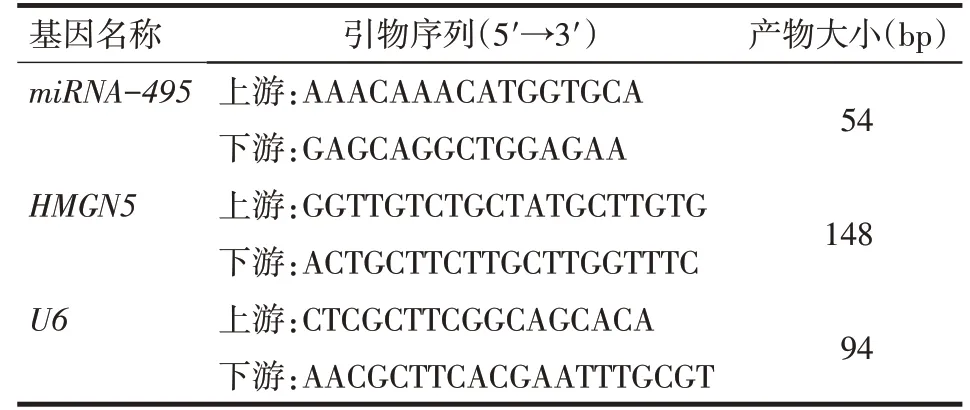
Tab.1 The sequence of primer for qPCR表1 qPCR引物序列
1.4 Western blot 法检测转染后细胞内HMGN5 及MMP-9 蛋白表达量的变化 分别收集转染48 h 后miRNA-495 mimics组、miRNA-495 NC 组、空白对照组的U251、A172 细胞,按照RIPA∶PMSF=16∶1配置蛋白裂解液提取蛋白,BCA 蛋白浓度试剂盒测定蛋白浓度。加入1/5体积的5×蛋白上样缓冲液,95 ℃煮沸10 min。配置SDS-PAGE 凝胶,每组取15 μL 蛋白上样后电泳,待Marker 完全分开时停止电泳,将蛋白转至PVDF 膜上,7%脱脂奶粉(TBST 配制)室温摇床上低速封闭2~4 h。加入兔抗人HMGN5 单抗(1∶500)、MMP-9 单抗(1∶1 000)、兔抗人GAPDH 单抗(1∶1 000),4 ℃冰箱封闭过夜。37 ℃暖箱复温后TBST清洗4次。1∶5 000辣根过氧化物酶标记的羊抗兔IgG二抗室温、摇床封闭2 h。TBST清洗4次。然后每条条带各加入200 μL 配制好的发光液。将PVDF 膜放置于荧光成像仪中,用Image J 软件进行条带灰度扫描,比较各组蛋白相对表达量变化。
1.5 CCK-8法检测转染及联合TMZ对细胞增殖的影响 取对数生长期的神经胶质瘤细胞,接种于96孔培养板上,调整每个孔中细胞数为1×104个,按照1.2 中转染条件转染细胞,实验分组为空白对照组(含有细胞的培养基)、miRNA-495 NC 组、miRNA-495 mimics 组、TMZ 组、TMZ+miRNA-495 NC组、TMZ+miRNA-495 mimics 组,每组均设置5 个平行复孔,非加药组转染后培养时间分别为24、48、72 h,加药组转染24 h后加入浓度为200 μmol/L TMZ,其溶剂为DMSO,并使其体积分数<0.1%,再培养24 h。在各培养时间点结束前斜贴培养板壁快速向每孔加入10 μL CCK-8 试剂,轻轻振摇,混匀CCK-8 试剂和培养基。分别于转染24、48、72 h 后和加药后将培养板放置于37 ℃,5%CO2,湿度100%的细胞培养箱中培养1.5 h,后用酶标仪测定在450 nm处的光密度(OD)值,分析细胞增殖情况。
1.6 Annexin V-FITC/PI 双染法检测miRNA-495 联合TMZ对神经胶质瘤细胞凋亡的影响 取对数生长期U251 细胞,调整细胞密度为5×105/mL,接种于12 孔板,置于37 ℃恒温、5%CO2、饱和湿度的培养箱中培养,按照1.2中转染条件转染细胞。实验分组为空白对照组、miRNA-495 NC 组、miRNA-495 mimics 组、TMZ 组、TMZ+miRNA-495 NC 组、TMZ+miRNA-495 mimics 组。转染完成24 h 后在相应组别中加入200 μmol/L TMZ,48 h 后用200 μL 不含EDTA 的胰酶消化收集各组细胞,PBS 洗涤细胞2 次,2 000 r/min 离心5 min,弃上清,加入500 μL Binding Buffer 使细胞重悬,加入5 μL Annexin V-FITC 溶液,用移液枪轻轻吹打混匀后,再加入5 μL Propidium Iodide溶液,再次用移液枪轻轻吹打混匀。放置于室温条件下避光反应5~15 min,1 h 内用流式细胞仪检测,计算细胞凋亡率。
1.7 统计学方法 采用SPSS 25.0 软件进行统计学分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(One-Way ANOVA),组间多重比较行LSD-t 检验。检验水准为α=0.05(双侧)。
2 结果
2.1 各组细胞miRNA-495、HMGN5 mRNA相对表达量的变化情况 在神经胶质瘤U251、A172 细胞中,miRNA-495 mimics 组miR-495 相对表达量较空白对照组和miRNA-495 NC 组升高,差异均有统计学意义(均P<0.05);miRNA-495 NC 组miRNA-495 相对表达量与空白对照组差异无统计学意义(均P>0.05),见图1。

Fig.1 The relative expression of miRNA-495 after the transfection in glioma cells detected by qPCR图1 qPCR法检测转染后神经胶质瘤细胞中miRNA-495的相对表达量
在神经胶质瘤U251、A172 细胞中,miRNA-495 mimics 组HMGN5 mRNA 相对表达量较空白对照组和miRNA-495 NC组下降,差异均有统计学意义(均P<0.05);miRNA-495 NC 组HMGN5 mRNA 相对表达量与空白对照组差异无统计学意义(均P>0.05),见图2。

Fig.2 The relative expression of HMGN5 mRNA after the transfection in glioma cells detected by qPCR图2 qPCR检测转染后神经胶质瘤细胞中HMGN5 mRNA的相对表达量
2.2 Western blot法检测转染后各组细胞HMGN5及MMP-9 蛋白表达的变化情况 在神经胶质瘤U251细胞中,miRNA-495 mimics 组HMGN5 及MMP-9 蛋白表达量较miRNA-495 NC 组和空白对照组下降(均P<0.05);miRNA-495 NC 组HMGN5 及MMP-9蛋白表达量与空白对照组差异无统计学意义(均P>0.05),见图3、4。在神经胶质瘤A172 细胞中,miRNA-495 mimics 组HMGN5 及MMP-9 蛋白表达量较miRNA-495 NC 组和空白对照组下降(均P<0.05);miRNA-495 NC 组HMGN5 及MMP-9 蛋白表达量与空白对照组差异无统计学意义,见图5、6。
2.3 转染后各组细胞的增殖变化情况 在神经胶质瘤U251、A172 细胞中,转染miRNA-495 mimics 24、48、72 h 后,miRNA-495 mimics 组细胞增殖能力较miRNA-495 NC 组和空白对照组明显减弱,差异有统计学意义(均P<0.05);miRNA-495 NC 组细胞增殖能力与空白对照组差异无统计学意义(P>0.05),见图7、8。

Fig.3 The protein expression levels of HMGN5 and MMP-9 in U251 cells detected by Western blot assay图3 Western blot法检测转染U251细胞后HMGN5、MMP-9蛋白表达变化
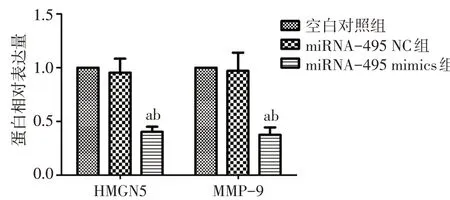
Fig.4 The relative expression levels of HMGN5 and MMP-9 protein in U251 cells图4 3组U251细胞中HMGN5、MMP-9蛋白的相对表达量

Fig.5 The protein expression levels of HMGN5 and MMP-9 in A172 cells detected by Western blot assay图5 Western blot法检测转染A172细胞后HMGN5、MMP-9蛋白表达变化
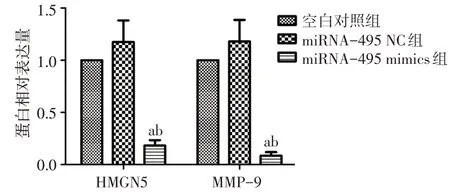
Fig.6 The relative expression levels of HMGN5 and MMP-9 protein in A172 cells图6 3组A172细胞中HMGN5、MMP-9蛋白的相对表达量
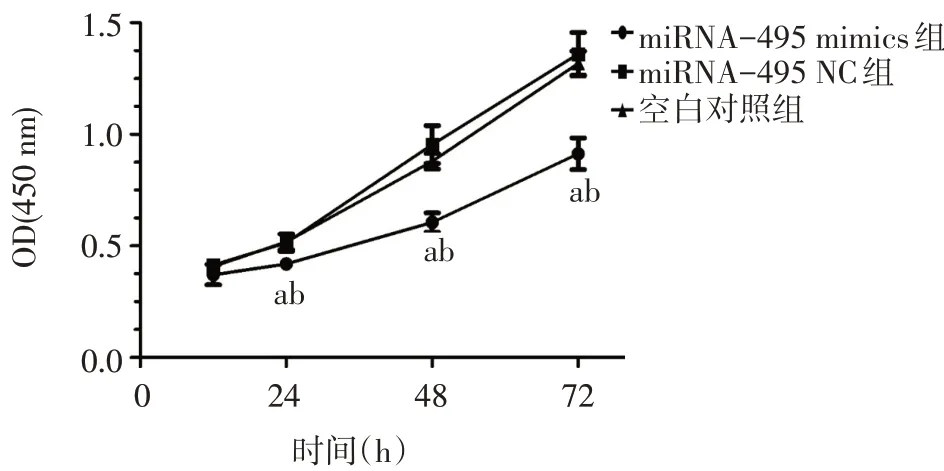
Fig.7 The effect of the transfection on proliferation of U251 cells detected by CCK-8图7 CCK-8法检测转染后对U251细胞增殖能力的影响

Fig.8 The effect of the transfection on proliferation of A172 cells detected by CCK-8图8 CCK-8法检测转染后对A172细胞增殖能力的影响
2.4 过表达miRNA-495 联合TMZ 对U251 细胞增殖的影响 在神经胶质瘤U251 细胞中,TMZ+miRNA-495 mimics 组细胞增殖能力明显低于miRNA-495 mimics组和TMZ组,差异有统计学意义(F=61.755,P<0.05);TMZ+miRNA-495 NC 组 与TMZ 组、miRNA-495 mimics 组与TMZ 组、miRNA-495 NC 组与空白对照组比较差异均无统计学意义(P>0.05),见图9。

Fig.9 The proliferation of U251 cells detected by CCK-8图9 CCK-8法检测U251细胞增殖能力的变化情况
2.5 过表达miRNA-495 联合TMZ 对U251 细胞凋亡的影响 在神经胶质瘤U251 细胞中,空白对照组、miRNA-495 NC 组、miRNA-495 mimics 组、TMZ组、TMZ+miRNA-495 NC 组、TMZ+miRNA-495 mimics 组 细 胞 凋 亡 率分 别 为(3.550±0.404)%、(3.737±0.466)% 、(10.110±0.303)% 、(10.437±0.330)% 、(10.530±0.384)% 、(16.720±0.315)% 。TMZ+miRNA-495 mimics 组细胞凋亡率明显高于miRNA-495 mimics组和TMZ组,差异有统计学意义(F=533.035,P<0.05),TMZ+miRNA-495 NC 组与TMZ组比较差异无统计学意义(P>0.05),见图10。

Fig.10 The apoptosis of U251 cells detected by flow cytometry图10 流式细胞术检测U251细胞凋亡的变化情况
3 讨论
神经胶质瘤是儿童和青少年时期最常见的中枢神经系统肿瘤[1],也是儿童癌症相关死亡的主要原因[12]。miRNA 可作为致癌基因或抑癌基因在肿瘤中异常表达,参与细胞增殖、凋亡、分化、代谢等过程。其中,miRNA-495在疾病的发生发展过程中通过不同的信号通路发挥着不同的生物学功能,在子宫内膜癌、前列腺癌、结直肠癌、肝癌、胃癌、乳腺癌、肾肿瘤中抑制肿瘤细胞的增殖、侵袭和转移;在非小细胞肺癌中降低了其抗药性;而在冠状动脉疾病、膀胱癌中促进人脐静脉内皮细胞、肿瘤细胞的生长、增殖和侵袭。在神经胶质瘤中,miRNA-495可通过调控细胞周期蛋白依赖性激酶6信号通路[2]、葡萄糖转运体1 型信号通路[3]、MYB 基因信号通路[4]、独立生长因子1 信号通路[5]等参与肿瘤细胞的增殖、凋亡、周期调控、新陈代谢及侵袭转移。
HMGN5是HMGN蛋白家族的一个新成员,它与肿瘤细胞的生长、细胞周期的调控、肿瘤细胞的转移和侵袭有关,是多种恶性肿瘤的潜在治疗靶点[13]。HMGN5在体外可促进神经胶质瘤的生成,其低表达可导致G1期细胞周期阻滞和细胞增殖延迟,诱导细胞凋亡。已有研究证实,miRNA-409-3p 可以通过靶向调控HMGN5抑制基质金属蛋白酶-2(MMP-2)和细胞周期蛋白D1(cyclin D1)的表达,从而抑制神经胶质瘤细胞的增殖和侵袭[10]。另有研究发现,HMGN5 的表达水平随着神经胶质瘤级别的增高而增加,并可作为神经胶质瘤复发的预测指标之一,提示神经胶质瘤的恶性程度可能与HMGN5 在胶质瘤细胞中的表达有关[7-8]。本研究结果显示,过表达miRNA-495 后,miRNA-495 mimics 组HMGN5 mRNA 和蛋白的相对表达量均较空白对照组和miRNA-495 NC 组降低,提示miRNA-495 可能通过调控HMGN5的表达参与神经胶质瘤的发生发展。
有研究表明,高表达HMGN5 可通过c-jun 信号通路上调MMP-2 和MMP-9,导致骨肉瘤细胞的侵袭和迁移能力增强[11]。Jiang等[6]研究发现,HMGN5是miRNA-495的直接靶基因之一,miRNA-495在骨肉瘤中表达下调,它通过与HMGN5 mRNA 的3'-UTR 靶向结合抑制HMGN5 的表达,从而抑制细胞周期蛋白B1(cyclin B1)、Bcl-2和MMP-9的表达,进而抑制骨肉瘤细胞的增殖、转移,并诱导其凋亡。MMP-9是HMGN5的下游基因之一,抑制HMGN5的表达,可以降低MMP-9基因的表达。本研究结果显示,过表达miRNA-495 后,miRNA-495 mimics 组神经胶质瘤细胞中MMP-9 mRNA 和蛋白的相对表达量均较空白对照组和miRNA-495 NC 组降低,提示miRNA-495 参与神经胶质瘤的机制可能是通过抑制HMGN5/MMP-9信号通路实现的。
关于过表达miRNA-495 后与化疗药物联合作用抑制细胞增殖、促进细胞凋亡的作用机制逐渐成为研究热点。有研究表明,下调HMGN5的表达可以增加食管鳞状细胞癌对顺铂的敏感性,这与调控多药耐药因子1(MDR1)、cyclin B1 和Bcl-2 基因有关[9]。另有研究指出,下调HMGN5的表达在不影响多药耐药相关蛋白1(MRP-1)的情况下,可抑制P-糖蛋白的表达,从而增加脑膜瘤细胞对替莫唑胺的化学敏感性[7]。本研究采用脂质体转染技术过表达miRNA-495 与化疗药物TMZ 联合作用于神经胶质瘤细胞,结果显示,TMZ+miRNA-495 mimics 组细胞增殖能力明显低于miRNA-495 mimics组和TMZ组,细胞凋亡率明显高于miRNA-495 mimics 组和TMZ组,提示过表达miRNA-495可增强TMZ对神经胶质瘤的增殖抑制和凋亡诱导作用。其机制可能是过表达miRNA-495 后可下调HMGN5 基因的表达,而HMGN5 又可调控多药耐药因子1、P-糖蛋白等,进而提高神经胶质瘤细胞对TMZ的敏感性。
综上所述,过表达miRNA-495与化疗药物TMZ联合应用可协同抑制细胞增殖、促进神经胶质瘤细胞凋亡;其机制可能是通过抑制HMGN5/MMP-9 信号通路实现的。
