叶黄素通过SIRT1/NLRP3信号通路提高人视网膜色素上皮细胞存活率的机制研究
2021-02-27万芳马利方
万芳,马利方
糖尿病是一种与糖代谢异常相关的严重代谢综合征,可引起血管、心脏、神经、眼、肝脏和肾脏等多种组织和器官的慢性损伤和功能障碍。其中,糖尿病视网膜病变(diabetic retinopathy,DR)和黄斑病变是糖尿病的微血管并发症,可致视力永久性受损乃至失明[1]。视网膜色素上皮细胞(retinal pigment epithelial cells,RPECs)在视网膜中具有许多重要的功能,包括光感受器外段的吞噬作用、类视黄醇的异构化以及各种代谢和神经营养支持功能[2],并与视网膜病变密切相关。血糖过高是DR 发病的关键因素。研究表明,高糖可诱导促炎性细胞因子过度生成,同时可增加细胞内活性氧(reactive oxygen species,ROS)的产生,从而诱导炎症反应与氧化应激反应[3-5]。叶黄素,又称植物黄体素,是一种类胡萝卜素,在蔬菜、水果、花卉等植物中广泛存在[6],也是存在于人眼视网膜黄斑区的主要色素[7]。叶黄素具有防止光氧化和光破坏的保护作用,被认为是一种有效的抗氧化剂。据报道,叶黄素具有多种药理特性,包括抗氧化[8-9]、抗炎[10]和抗癌[11-12]等。此外,叶黄素还能通过调节抗氧化活性等信号通路来预防因衰老诱发的视网膜功能下降[13],但目前尚不清楚叶黄素是否对DR 起治疗作用。本研究以RPECs 为研究对象,旨在探讨叶黄素对高浓度葡萄糖环境中RPECs的潜在影响,包括炎症因子的表达、ROS的产生及其分子机制,为叶黄素治疗DR提供理论依据。
1 材料与方法
1.1 细胞株、主要试剂与仪器 人视网膜色素上皮细胞ARPE-19 购于武汉普诺赛生命科技有限公司。RPMI-1640培养基(美国Thermo公司,C22400500BT),胎牛血清(FBS,以色列BI 公司,04-001-1-A),叶黄素(美国Sigma 公司,07168),CCK-8 试剂盒(北京博奥森生物技术有限公司,BA00208),RNA 提取试剂盒(美国Thermo 公司,12183020),实时荧光定量聚合酶链式反应(qPCR)试剂盒(武汉优博生物技术有限公司,DN001),肿瘤坏死因子-α(TNF-α)酶联免疫吸附试验(ELISA)试剂盒(ab181421)、白细胞介素(IL)-1β ELISA试剂盒(ab100562)、IL-6 ELISA试剂盒(ab46027)、IL-18 ELISA 试剂盒(ab215539)均购自英国Abcam 公司,5-(和-6)-氯甲基-2,7-二氯二氢荧光素二乙酸酯(CMH2DCFDA)探针(美国Sigma公司,D6883)。CO2培养箱(日本SANYO公司,MCO-15AC),倒置显微镜(CX41)、激光共聚焦显微镜(日本Olympus公司),核酸蛋白检测仪、qPCR仪(美国Thermo 公司),SDS-PAGE 微型凝胶电泳及转膜设备(美国BIO-RAD 公司),全自动化学发光图像分析系统(上海天能科技有限公司,Tanon-5200),低温高速离心机(德国Sartorius公司,3k30),Multiskan酶标仪(美国Thermo公司)。
1.2 方法
1.2.1 实验分组 为确定葡萄糖对RPECs 活性的影响及处理条件,在ARPE-19细胞培养基中添加不同浓度的葡萄糖,即15、30、60、90 mmol/L 葡萄糖组,并设对照组(未添加葡萄糖),最终确定在后续实验中使用的葡萄糖处理组被命名为葡萄糖组;为确定叶黄素对RPECs 活性的影响及处理条件,在葡萄糖组ARPE-19 细胞培养基中添加不同浓度的叶黄素,即5、10、20 μmol/L 叶黄素组、葡萄糖组(未添加叶黄素)和对照组(未添加叶黄素和葡萄糖),最终确定在后续实验中使用的叶黄素处理组被命名为叶黄素组。
1.2.2 细胞培养 ARPE-19 细胞复苏后,使用添加10%FBS、1%青霉素/链霉素的RPMI-1640 培养基,置于5%CO2、饱和增湿、37 ℃恒温培养箱中培养。约1~2 d换液1次,细胞生长融合至85%时,使用0.25%胰蛋白酶消化细胞,用完全培养基终止消化后,以1∶3 比例传代,取对数生长期的4~6代细胞用于实验。实验前,将ARPE-19 细胞在37 ℃、1%FBS的RPMI-1640培养基中培养12 h。
1.2.3 CCK-8检测细胞增殖活性 在96孔板中接种ARPE-19 细胞悬液(每孔100 μL,约5 000 个细胞),置于37 ℃、5%CO2培养箱中培养。24 h 后,向各孔中加入10 μL 不同浓度的葡萄糖溶液、叶黄素溶液,并设置空白对照组,每组设4 个平行复孔。将培养板置于培养箱孵育48 h 后,每孔加入10 μL CCK-8溶液,加液过程中避免产生气泡。培养板放培养箱孵育2 h 后,用酶标仪测定450 nm 处的吸光度(A)值。计算公式:细胞存活率(%)=[A(加药)-A(空白)]/[A(对照)-A(空白)]×100%。
1.2.4 ELISA 检测炎性细胞因子水平 将ARPE-19 细胞以(1.0~1.5)×104个/mL 的密度接种在96 孔板中,并在37 ℃、5%CO2培养箱中培养。12 h后,收集培养基,使用ELISA试剂盒,根据说明书对培养基中TNF-α、IL-1β、IL-18 和IL-6 的含量进行测量。
1.2.5 CM-H2DCFDA 探针法检测细胞内ROS 水平 在用细胞渗透性CM-H2DCFDA 孵育ARPE-19 细胞后,检测细胞内的ROS 水平。检测原理为:在ROS 存在的条件下,CMH2DCFDA 将转化为2’,7’-二氯荧光素(DCF)。将细胞以(1.0~1.5)×107个/mL 的密度接种在6 孔板中。30 mmol/L 葡萄糖或24.4 mmol/L 甘露醇处理细胞12 h 后,添加10 μmol/L CM-H2DCFDA 和1 μg/L DAPI,在不含FBS 的RPMI-1640 培养基中培养20 min。使用添加10%FBS 的RPMI-1640 培养基清洗细胞后,用激光扫描共焦显微镜进行拍摄。在6个随机视野中测量荧光强度,并使用Image J 1.41进行分析。
1.2.6 qPCR检测mRNA水平 收集各组ARPE-19细胞,使用RNA提取试剂盒提取细胞总RNA,并使用核酸蛋白检测仪测定RNA的质量和浓度。使用逆转录试剂盒将mRNA合成为cDNA后,分别使用SIRT1与NLRP3的特异性引物进行PCR扩增,反应体系为:cDNA 1 μL,上下游引物各1 μL,2×Green Mix 10 μL,去离子水7 μL。反应条件设置为:94 ℃2 min;94 ℃10 s,58 ℃15 s,72 ℃10 s,40个循环。以GAPDH为内参,使用相对定量2-ΔΔCt法计算各组ARPE-19细胞中SIRT1与NLRP3的相对表达水平。SIRT1引物:上游5'-GGAGCAGATTAGTAGGCGGC-3';下游5'-CCTCAGCGCCATGGAAAATG-3',产物大小80 bp。NLRP3引物:上 游5'-GGCAACACTCTCGGAGACAA-3' ;下 游5'-GGAAAGATCCCAGCAGCAGT-3',产物大小126 bp。GAPDH引物:上 游5'-GTCAAGGCTGAGAACGGGAA-3' ;下 游5'-GCCTTCTCCATGGTGGTGAA-3',产物大小146 bp。
1.3 统计学方法 使用GraphPad Prism 6.0 进行统计分析。所有数据均为4 次独立重复实验的平均值,以x±s表示,多组间比较采用单因素方差分析,组间多重比较采用Tukey-Kramer检验。以P<0.05为差异有统计学意义。
2 结果
2.1 高浓度葡萄糖诱导对ARPE-19 细胞增殖活性的影响 15、30、60、90 mmol/L 葡萄糖组和对照组ARPE-19 细 胞 存 活 率 分 别 为(92.10±3.60)% 、(69.06±1.83)%、(44.22±0.73)%、(42.18±0.68)%和(96.20±2.39)%,多组间比较差异有统计学意义(F=566.072,P<0.01)。15 mmol/L葡萄糖组与对照组比较差异无统计学意义(P>0.05),而30、60 与90 mmol/L 葡萄糖组较对照组显著降低(P<0.05)。选取30 mmol/L葡萄糖作为高糖实验浓度。
2.2 高浓度葡萄糖对ARPE-19细胞炎症因子、ROS水平及细胞存活率的影响 葡萄糖组IL-1β、IL-6、IL-18、TNF-α 和ROS 水平均显著高于对照组(P<0.05),而细胞存活率低于对照组(P<0.05),见表1。
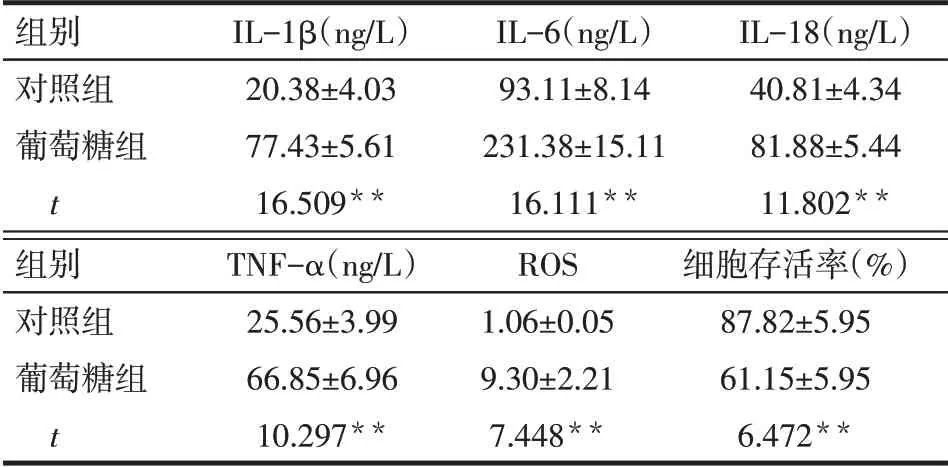
Tab.1 Comparison of inflammatory factors,ROS levels and cell viability between glucose treatment group and control group表1 对照组与葡萄糖组炎症因子、ROS水平及细胞存活率的比较 (n=4,x±s)
2.3 叶黄素对ARPE-19细胞炎症因子、ROS水平的影响 与葡萄粮组相比,5 μmol/L 的叶黄素处理无法改善细胞内炎性细胞因子水平和ROS 水平(P>0.05)。10 μmol/L叶黄素组与葡萄糖组相比较,仅细胞内的ROS 水平显著降低(P<0.05)。20 μmol/L 叶黄素组较葡萄糖组IL-1β、IL-6、IL-18、TNF-α 和ROS 水平均显著降低(P<0.05),见表2。选取20 mmol/L叶黄素作为后续实验浓度。
2.4 叶黄素对ARPE-19 细胞SIRT1/NLRP3 信号通路和细胞存活率的影响 与对照组相比,葡萄糖组细胞中的NLRP3mRNA 表达水平显著升高,细胞存活率降低(P<0.05),而SIRT1mRNA 表达水平差异无统计学意义(P>0.05)。与葡萄糖组比较,叶黄素组SIRT1mRNA 表达水平和细胞存活率显著上调,而NLRP3mRNA 表达水平显著下调(P<0.05),见表3。

Tab.2 Comparison of inflammatory factors and ROS levels between the five groups表2 各组中炎症因子和ROS水平的比较(n=4,x±s)

Tab.3 Comparison of SIRT1,NLRP3 mRNA and cell viability between the three groups表3 各组中SIRT1、NLRP3 mRNA和细胞存活率的比较(n=4,x±s)
3 讨论
3.1 高浓度葡萄糖促进RPECs 炎症因子产生 DR已经成为糖尿病最常见的微血管并发症之一,其中RPECs功能障碍被认为与DR的发病密切相关[14-15]。其病理机制可能是高血糖诱发视网膜炎症和氧化应激,导致RPECs 活性显著降低,诱导细胞凋亡发生[16-17]。DR 患者普遍存在炎性细胞因子水平显著增加的情况[18]。研究发现,高浓度的葡萄糖会增加RPECs中炎性细胞因子的产生[19-20]。与上述报道一致,本研究结果表明,高糖处理人视网膜色素上皮细胞ARPE-19 可以诱导细胞TNF-α、IL-1β、IL-6 和IL-18分泌显著增加。
3.2 氧化应激调控炎症反应 过氧化应激是炎症反应的重要诱发因素。在人类多种炎症疾病中均可以观察到高水平的ROS 生成,细胞处于过氧化应激状态,诱导炎症反应发生。糖尿病时高血糖状态下的多种合并症,包括糖尿病足,神经、肾、骨骼、心血管等系统的并发症均与过氧化应激及炎症反应密切相关[21-23]。本研究显示,高血糖诱导RPECs 过氧化应激与炎性细胞因子表达显著增高,与既往在糖尿病患者视网膜病变的研究结果一致[24]。
SIRT1是Sirtuin家族成员之一,可以通过调控线粒体的生物合成等调节细胞内ROS 水平[25]。而NLRP3是炎症小体家族成员,可以通过激活促炎性细胞因子IL-1β 等诱发炎症反应,促进炎性细胞凋亡[26]。SIRT1在多个组织中被证明可以负调控NLRP3[27-28],但是两者在RPECs 中的关系还未被揭示。本研究结果表明,SIRT1可以抑制NLRP3的激活,从而改善高糖环境中RPECs的活性。
3.3 叶黄素提高RPECs活性 有证据表明,叶黄素对人体健康尤其是眼的健康具有多种有益作用[29]。叶黄素可以预防和改善与年龄有关的黄斑疾病。本研究表明,叶黄素可以通过激活SIRT1降低氧化应激水平,下调NLRP3表达,抑制炎性细胞因子,改善RPECs活性。尽管当前研究仅在细胞水平上证明了叶黄素对高糖环境中RPECs 活性的改善作用,但是既往已经有小鼠或大鼠模型研究证明,补充叶黄素可显著改善视网膜的血运重建,提高视力,并对光损伤有明显保护作用,其可能的机制是淬灭氧自由基以及抑制脂质的过氧化[30-32],这与体外细胞水平研究结果一致。
综上所述,高浓度葡萄糖在RPECs 中通过激活过氧化应激与炎症反应降低RPECs 活性,叶黄素可以通过SIRT1/NLRP3通路改善细胞内氧化应激与炎性细胞因子水平,提高高糖环境RPECs活性,本研究结果为DR提供了一种潜在治疗策略。
