miR-186-5p靶向TrkB-T1抑制食管癌细胞迁移、侵袭的机制研究
2021-02-26王捷张亚楠张瑜高旭辉
王捷 张亚楠 张瑜 高旭辉
食管癌(esophageal cancer)是我国最常见的消化道恶性肿瘤之一,其为中国癌症死亡的第四大原因[1]。尽管由于诊断、手术和放化疗技术的不断进展,但其化学抗性和转移倾向仍是影响食管癌预后的主要原因[2]。随着对癌症生物学的进一步研究,越来越多的研究人员开始探索新的治疗方法,miRNA、siRNA或核酶的寡核苷酸疗法的特异性和安全性得到关注。miRNA是长度在18~24个核苷酸之间的短链非编码内源性微小RNA,其参与人类多种疾病的发生发展[3]。miR-186-5p在多种癌症中均下调,发挥抑制癌症进一步恶化的作用[4],但是其在食管癌中的作用及机制尚未十分清楚。神经营养因子受体B(TrkB-T1)是一种145 kDa受体酪氨酸激酶,是人类癌症中肿瘤发生发展的关键调节因子[5]。失调的TrkB-T1在多种癌症的进程中均具有重要作用[6,7]。本研究以食管癌细胞ECA109为研究对象,检测其中miR-186-5p、TrkB-T1的表达,观察过表达miR-186-5p、敲减TrkB-T1、过表达TrkB-T1对食管癌细胞迁移侵袭及EMT的影响,揭示其机制与miR-186-5p靶向TrkB-T1相关,为食管癌的治疗提供新靶标。
1 材料与方法
1.1 材料 人正常食管上皮细胞HEEC、食管癌细胞ECA109、TE1、KYSE150均购自ATCC;DMEM培养基、胎牛血清、胰蛋白酶均购自美国GIBCO公司;LipofectamineTM2000、BCA蛋白定量试剂盒、逆转录试剂盒购自大连TaKaRa;Matrigel基质胶、Transwell小室购自美国Coming公司;PVDF膜购自德国罗氏诊断有限公司;SDS-PAGE 试剂盒、ECL发光液和RIPA蛋白裂解液均购自碧云天生物技术公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司。
1.2 方法
1.2.1 细胞培养:将人正常食管上皮细胞HEEC、食管癌细胞ECA109、TE1、KYSE150,用含10%胎牛血清的DMEM培养基,置于37℃、5%CO2的恒温培养箱中常规培养,待细胞生长至融合度75%左右,用胰蛋白酶消化,按照1∶3的比例更换培养基,传代。
1.2.2 细胞转染与分组:将miR-NC、miR-186-5p mimics、si-NC、si-TrkB-T1、miR-186-5p+pcDNA、miR-186-5p+pcDNA-LRIGl按照脂质体Lipofectamine TM2000说明书操作步骤要求转染至EJ细胞,分别标记为miR-NC组、miR-186-5p组、si-NC组、si-TrkB-T1组、miR-186-5p+pcDNA组、miR-186-5p+pcDNA-LRIGl组,转染48 h后,用qRT-PCR检测转染效率。转染成功后,用于后续试验。
1.2.3 qRT-PCR实验检测细胞中miR-186-5p、TrkB-T1的mRNA表达:取适量对数生长期1.2.2各组细胞,遵照RNA抽提试剂盒说明书要求操作提取RNA,进行定量,然后按逆转录试剂盒按照说明书操作合成cDNA。最后按qRT-PCR试剂盒说明书操作进行miR-186-5p、TrkB-T1检测。用2-ΔΔCt计算miR-186-5p、TrkB-T1的表达。
1.2.4 Western blot实验检测细胞中TrkB-T1、Twist、N-cadherin、E-cadherin的蛋白表达:收集细胞,加入裂解液,冰上裂解30 min。12 000 r/min离心10 min,取上清置于EP管,加入5×SDS上样缓冲液,沸水煮沸10 min。电泳后用转膜仪将蛋白转移至PVDF膜;5%脱脂奶粉将膜封闭2 h,洗膜,加入Ⅰ抗,4℃过夜孵育,洗膜,加Ⅱ抗,4℃ 2 h。加发光液,曝光。
1.2.5 Transwell小室检测细胞的迁移侵袭:将细胞以106个/孔接种于细胞6孔板,培养至融合度75%时,更换无血清培养基培养过夜。调整细胞密度至105个/ml,取100 μl加入上室内,600 μl含血清的培养基加入下室,培养过夜。取出小室,用棉签擦去上室内的细胞,PBS洗涤,甲醇固定30 min,0.1%结晶紫染色20 min,PBS洗涤。显微镜下观察小室下表面附着的迁移细胞数,随机选5个视野计数,取平均值。将Transwell小室上表面铺适量厚度的基质胶,然后按照上述操作方法操作。最后显微镜下观察小室下表面附着的侵袭细胞。
1.2.6 双荧光素酶报告基因检测实验检测细胞的荧光活性:采用在线靶基因预测库targetscan(http://www.targetscan.org/)检测到miR-186-5p与TrkB-T1 3’UTR存在结合位点,为验证这一预测,构建TrkB-T1 3’UTR-WT(含TrkB-T1 3’UTR片段)和TrkB-T1 3’UTR-MUT(含TrkB-T1 3’UTR片段突变体)的荧光素酶报告载体,采用LipofectamineTM2000分别将TrkB-T1 3’UTR-WT和TrkB-T1 3’UTR-MUT与miR-186-5p、miR-NC共转染,转染24 h后,按双荧光素酶报告基因检测试剂盒技术手册操作,记录萤火虫荧光素酶和海肾荧光素酶激发值,以二者的比值评价TrkB-T1基因的荧光活性。
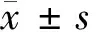
2 结果
2.1 miR-186-5p、TrkB-T1在食管癌细胞中的表达 与HEEC比较,食管癌细胞ECA109、TE1、KYSE150中miR-186-5p的mRNA表达显著降低,TrkB-T1的mRNA和蛋白表达均显著升高(P<0.05)。见表1,图1。

表1 miR-186-5p、TrkB-T1在食管癌细胞中的表达
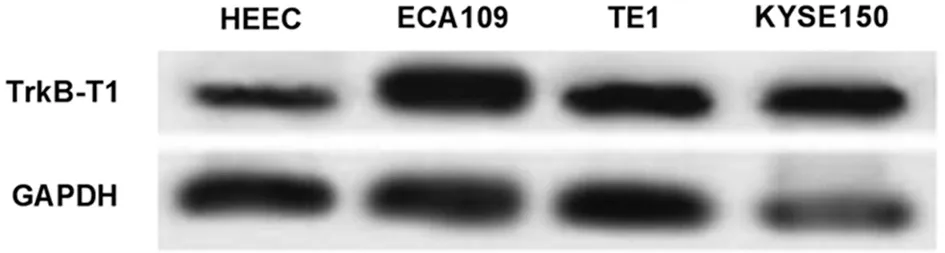
图1 TrkB-T1在食管癌细胞中的蛋白表达
2.2 过表达miR-186-5p对食管癌细胞迁移侵袭及EMT相关蛋白表达的影响 与miR-NC组比较,miR-186-5p组ECA109细胞中miR-186-5p表达显著升高,迁移细胞数和侵袭细胞数均显著降低,Twist、N-cadherin蛋白表达显著降低,E-cadherin蛋白表达显著升高(P<0.05)。见表2,图2。

表2 过表达miR-186-5p对食管癌细胞迁移侵袭及EMT相关蛋白表达的影响
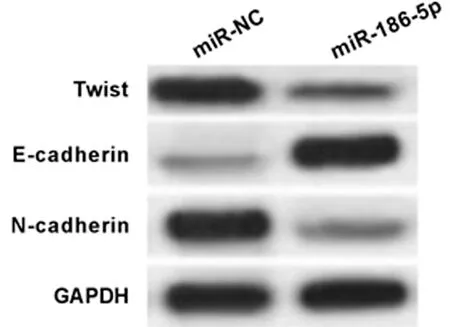
图2 过表达miR-186-5p的食管癌细胞中EMT相关蛋白的表达
2.3 miR-186-5p靶向TrkB-T1 采用target scan数据库预测到miR-186-5p与TrkB-T1 3’UTR存在结合位点;双荧光素酶活性检测结果显示,与miR-NC组相比,miR-186-5p组WT-TrkB-T1细胞中荧光活性显著降低,MUT-TrkB-T1细胞中荧光活性不受影响;与anti-miR-NC组比较,anti-miR-186-5p组细胞中TrkB-T1表达显著升高,与miR-NC组比较,miR-186-5p组细胞中TrkB-T1表达显著降低(P<0.05)。见表3、4,图3、4。

表3 双荧光素酶报告基因检测实验结果

表4 miR-186-5p对TrkB-T1蛋白表达的影响

图3 miR-186-5p与TrkB-T1的靶向结合位点

图4 TrkB-T1蛋白的表达
2.4 敲减TrkB-T1对食管癌细胞迁移侵袭及EMT相关蛋白表达的影响 与si-NC组比较,si-TrkB-T1组ECA109细胞中TrkB-T1表达显著降低,迁移细胞数和侵袭细胞数均显著降低,Twist、N-cadherin蛋白表达显著降低,E-cadherin蛋白表达显著升高(P<0.05)。见图5,表5。

表5 敲减TrkB-T1对TrkB-T1细胞迁移侵袭的影响

图5 敲减TrkB-T1的食管癌细胞中TrkB-T1蛋白表达
2.5 过表达TrkB-T1逆转miR-186-5p对食管癌细胞迁移侵袭、EMT的抑制作用 与miR-186-5p+pc DNA组比较,miR-186-5p+pc DNA-TrkB-T1组ECA109细胞中miR-186-5p表达显著降低,迁移细胞数和侵袭细胞数均显著升高,Twist、N-cadherin蛋白表达显著升高,E-cadherin蛋白表达显著降低(P<0.05)。见表6,图6。

表6 过表达TrkB-T1逆转miR-186-5p对食管癌细胞迁移侵袭、EMT的抑制作用

图6 过表达TrkB-T1逆转miR-186-5p对食管癌细胞EMT相关蛋白表达的影响
3 讨论
miRNA通过与靶基因的3’UTR发生特异性结合,抑制靶基因的转录或翻译,进而发挥调控作用[8]。miR-186在人类的多种癌症中均表现出失调,其中包括食管癌。Liu等[9]在食管癌的研究中通过高通量miRNA芯片检测发现,miR-186为表达异常降低的miRNA之一。Yan等[10]在研究中也有报道,miR-186是食管癌中差异最显著的miRNA之一。He等[11]在研究中报道,miR-186是食管癌中的低表达与癌症的分期、分化程度及淋巴转移具有显著的相关性,并且过表达miR-186可抑制癌细胞的增殖、迁移侵袭,促进凋亡,其机制与靶向SKP2有关,提示miR-186具有作为食管癌治疗的潜在靶点。本研究采用qRT-PCR检测了食管癌细胞中 miR-186-5p的mRNA的表达发现,miR-186-5p表达异常降低,这与前人的研究结果均相一致,再次验证了miR-186-5p在食管癌中的异常下调;进一步研究发现,过表达miR-186-5p可抑制食管癌细胞的迁移侵袭,下调促EMT标志蛋白Twist、N-cadherin的表达,上调抑EMT标志蛋白E-cadherin,证实了miR-186-5p抑制食管癌细胞迁移侵袭的功能,其机制可能与抑制细胞的EMT化密切相关;深入研究,通过生物信息学预测、双荧光素酶报告基因检测实验、Western blot实验发现,miR-186-5p可靶向负调控TrkB-T1的表达,推测miR-186-5p在食管癌中的功能可能与TrkB-T1的表达具有相关性。
TrkB-T1是TrkB-T1的可变剪接转录变体,具有独特的COOH-末端12-氨基酸序列,具有酪氨酸激酶的活性,主要位于细胞质[12]。Zhou等[13]发现,TrkB-T1在所有鳞状细胞癌中的表达均出现明显的上调,但是这种高表达与喉鳞癌的存活率低呈负相关,与肺癌的存活率呈正相关,其机制与调节hedgehog基因通路相关蛋白及Nfe2l2应答、Tp63、Keap1和p62/SQSTM1蛋白具有显著的相关性。Kupferman等[14]在头颈部鳞状细胞癌的研究中发现,用BDNF(TrkB的配体)体外刺激上调头颈部鳞状细胞癌细胞的迁移和侵袭,并且TrkB的瞬时和稳定抑制导致组成型和配体介导的迁移和侵袭的显著消除。此外,强制性过表达TrkB导致EMT的分子介质表达的改变,如E-钙粘蛋白的下调和Twist的上调,在头颈部鳞状细胞癌小鼠模型显示TrkB的下调抑制肿瘤生长,暗示TrkB参与EMT和头颈部鳞状细胞癌的侵袭,并且与头颈部鳞状细胞癌中TrkB的体内过表达相关。本研究通过qRT-PCR、Western blot实验检测了食管癌细胞中TrkB-T1的mRNA和蛋白表达发现,TrkB-T1异常升高,这与Zhou[13]的实验结果相呼应;进一步研究发现,敲减TrkB-T1可抑制食管癌细胞的迁移侵袭,下调Twist、N-cadherin,上调E-cadherin,这揭示了TrkB-T1在食管癌中的促进转移的功能,为深入探索TrkB-T1在食管癌的中功能提供新的参考;重要的是过表达TrkB-T1可逆转miR-186-5p对食管癌细胞的迁移侵袭和EMT的抑制作用,说明不仅miR-186-5p可靶向调控TrkB-T1,相反,TrkB-T1也可负向调控miR-186-5p在食管癌细胞中的表达和功能。
综上所述,miR-186-5p抑制食管癌细胞迁移侵袭和EMT,其机制与靶向负调控TrkB-T1有关,为食管癌的治疗提供新的作用靶点。
