miR-148a-3p对LPS诱导的肾小球系膜细胞增殖、凋亡及炎症因子的影响*
2021-02-26姜楠陈钰王卓娜于晓瑜
姜楠 陈钰 王卓娜 于晓瑜
(葫芦岛市中心医院龙湾院区血液透析室,辽宁 葫芦岛 125001)
系膜增生性肾小球肾炎(mesangial proliferative glomerulo nephritis, MsPGN)是威胁公众健康的常见疾病,其中炎症在MsPGN中起着至关重要的作用[1],其中肾小球系膜细胞(glomerular mesangial cells, GMC)增生是MsPGN、糖尿病肾小球硬化等多种人类肾脏疾病的主要病变[2]。微小RNA(miRNA)是短的非编码RNA,已被确定为一类新的内源调节因子[3]。研究发现,许多miRNA在肾脏中高表达,异常表达可导致许多肾脏疾病,包括糖尿病肾病和肾癌。研究显示,miR-148a-3p在狼疮性肾炎小鼠模型及肾小球中细胞均呈现高表达状态,减少miR-148a-3p表达能改善狼疮性肾炎小鼠的肾功能[4]。本研究旨在探讨miR-148a-3p是否对LPS诱导的肾小球系膜细胞增殖、凋亡及炎症因子的产生影响,为临床上治疗系膜增生性肾小球肾炎提供新的理论依据。
1 材料与方法
1.1 材料 大鼠肾小球系膜细胞(HBZY-1)系购自中科院细胞库。RPMI-1640培养基、胎牛血清(FBS)和TRIzol试剂均购自美国Gibco公司。LPS购自美国Biosharp公司。逆转录试剂盒购自promega公司。TB GreenTMPremix Ex Taq II试剂盒购自TaKaRa公司。RIPA裂解液购自北京索莱宝公司。NF-κB p65、IκB和GAPDH抗体和山羊抗兔(鼠)IgG二抗购自美国Cell Signaling Technology公司。miR-148a-3p inhibitor由Genepharma(中国上海)合成。LipofectamineTM2000购自上海吉玛公司。Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京Vazyme公司。酶联免疫试剂盒购自美国BOSTER公司。PVDF膜购自Millipore公司。
1.2 方法
1.2.1 细胞培养 HBZY-1细胞用含10%胎牛血清的RPMI-1640培养基,置于37℃、5% CO2的培养箱中培养,传代时用0.25%胰蛋白酶进行消化,2天更换一次培养基,以保证细胞所需的营养成分。
1.2.2 细胞分组 根据培养基是否添加miR-148a-3p inhibitor和LPS,可以分为3组:①对照组(简称control组):加入含有10%胎牛血清的RPMI-1640培养基;②LPS组[5]:加入LPS和含有10 %胎牛血清的RPMI-1640培养基,LPS的终浓度为10 μg/mL;③LPS+miR-148a-3p inhibitor组(简称miR-148a-3p inhibitor):转染100 nmol/L miR-148a-3p inhibitor后加入10 μg/mL的LPS刺激细胞。24 h后收集细胞用于后续实验研究。
1.2.3 细胞转染 HBZY-1细胞以1×105个/孔接种于24孔板,待细胞生长汇合率至70 %左右时,按照LipofectamineTM2000转染试剂说明书进行。各组细胞在37℃、5% CO2的培养箱中培养6 h后,更换新鲜的培养基继续培养。
1.2.4 克隆形成实验 培养24 h后的各组细胞以1×103个/孔接种于60 mm的细胞培养皿中。10天后,用结晶紫染色溶液染色细胞,并计数含有≥ 50个细胞的集落,用奥林巴斯荧光倒置显微镜拍摄具有代表性集落并统计。实验独立重复3次。
1.2.5 细胞凋亡实验 培养24 h后的各组细胞用冷的PBS清洗两次,然后在结合缓冲液中重悬并稀释至每1 mL液体中含1×105个细胞。严格按照Annexin V-FITC/PI 凋亡检测试剂盒说明书进行操作,用流式细胞仪检测细胞凋亡率。实验独立重复3次。
1.2.6 Hoeschst染色 各组细胞培养24 h后,弃去上清液,用缓冲液清洗细胞3次,加入适量的Hoechst染色液,全部覆盖底部细胞,并将各组细胞置于培育箱中培养30 min,用荧光显微镜观察细胞凋亡情况,计算细胞凋亡率。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.2.7 qPCR 使用TRIzol试剂提取各组细胞的总RNA,用Nanodrop 2000仪器检测样品RNA浓度。然后按照反转录试剂盒说明书将总RNA反转录成cDNA。按照qPCR试剂盒说明书配置相应的体系,每组设置3个复孔。使用TB GreenTMPremix Ex Taq II试剂盒进行qPCR。qPCR的条件如下:95℃ 30s(1循环),95℃ 5s、60℃ 30s(40循环)。使用StepOnePlus仪器完成实验后,采用2-△△Ct法分析数据。实验独立重复3次。其中使用的引物见表1。

表1 引物序列
1.2.8 Western blot 培养24 h后的各组细胞用蛋白酶抑制剂裂解液裂解细胞后提取蛋白,用BCA法测定总蛋白含量。取等量蛋白质样品上样,SDS-PAGE凝胶电泳分离蛋白质后转膜,用5 %脱脂奶粉封闭1 h,之后加入稀释后的NF-κB p65、IκB和GAPDH一抗,4℃摇床上孵育过夜。用TBST洗膜3次,每次10 mim,加入对应于一抗种属来源的稀释后HRP标记的二抗,在室温摇床上孵育1 h,用TBST洗膜3次,每次10 min。使用ECL化学发光液显色发光,凝胶成像系统拍照,Image Pro Plus图像分析系统对蛋白条带进行分析
1.2.9 酶联免疫检测各组细胞上清液中TNF-α、IL-1β、IL-10的含量 培养结束后收集各组细胞于离心管中,1000 r/min 离心5min,收集上清液,按酶联免疫试剂盒操作说明检测细胞上清中TNF-α、IL-1β和IL-10含量。
1.2.10 信号转导流程图
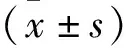
2 结果
2.1 miR-148a-3p在LPS诱导肾小球系膜细胞中的表达水平 与control组相比,LPS组中miR-148a-3p的表达显著上调(P<0.001);与LPS组比较,miR-148a-3p inhibitor组中miR-148a-3p的表达下调(P<0.001)。见图2。

图1 信号转导流程图。

图2 miR-148a-3p在LPS诱导肾小球系膜细胞中的表达情况
2.2 miR-148a-3p对LPS诱导肾小球系膜细胞增殖的影响 与control组相比,LPS组HBZY-1细胞增殖能力显著提高(P<0.001);与LPS组比较,miR-148a-3p inhibitor组HBZY-1细胞增殖能力下降(P=0.004),见图3。
图3 克隆形成实验检测LPS诱导肾小球系膜细胞增殖的情况
2.3 miR-148a-3p对LPS诱导肾小球系膜细胞凋亡的影响 细胞流式术检测结果和Hoechst染色实验结果显示:与control组相比,LPS组HBZY-1细胞凋亡能力显著下降(P=0.036);与LPS组比较,miR-148a-3p inhibitor组HBZY-1细胞凋亡能力提高(P<0.001),见图4。

图4 细胞流式术检测各组细胞的凋亡情况。
2.4 miR-148a-3p对LPS诱导肾小球系膜细胞中NF-κB、IκB表达的影响 与control组相比,LPS组HBZY-1细胞中NF-κB mRNA和蛋白的表达上调(P=0.003,P=0.004),且IκB mRNA和蛋白的表达下调(P=0.004,P<0.001);与LPS组比较,miR-148a-3p inhibitor组HBZY-1细胞中NF-κB mRNA和蛋白的表达下调(P=0.031),且IκB mRNA和蛋白的表达上调(P=0.037,P=0.005),见图5。

图5 qPCR和Western blot检测LPS诱导肾小球系膜细胞中NF-κB、IκB的表达情况
2.5 miR-148a-3p对LPS诱导肾小球系膜细胞上清液中TNF-α、IL-1β、IL-10含量的影响 与control组比较,LPS组HBZY-1细胞中TNF-α、IL-1β含量增加(P=0.003,P=0.035),IL-10含量减少(P<0.001);与LPS组比较,miR-148a-3p inhibitor组HBZY-1细胞中TNF-α、IL-1β含量减少(P=0.025,P=0.032),IL-10含量增加(P=0.038),见图6。
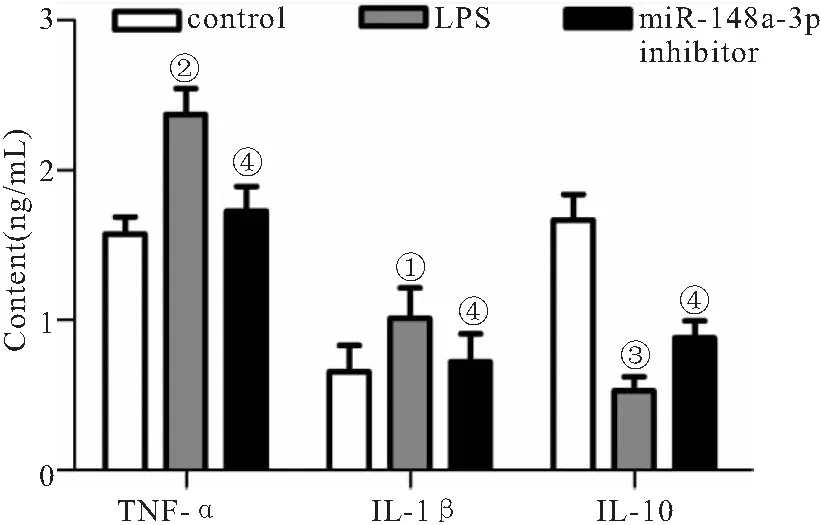
图6 酶联免疫法检测LPS诱导肾小球系膜细胞上清液中TNF-α、IL-1β、IL-10含量变化
3 讨论
系膜增生性肾小球肾炎(mesangial proliferative glomerulo nephritis, MsPGN)是临床常见的肾小球疾病,主要症状表现为系膜基质增多及肾小球系膜细胞增生[6-7]。MsPGN的发病机制复杂,主要与免疫功能紊乱、凝血机制异常、遗传、环境等因素相关[8]。肾小球细胞过度增生是肾小球硬化从而造成肾损伤最关键进程[9]。目前西医治疗MsPGN的主要手段是激素、免疫抑制剂等,至今仍然没有确切的药物来治疗该疾病。
脂多糖(Lipopolysaccharide, LPS)是内毒素的一种,能够促进细胞因子释放、趋化炎症细胞[10-11]。研究证实,LPS可以诱导肾小球系膜细胞增殖[12],已成为肾小球系膜细胞与肾纤维化研究的常用刺激物[13]。本实验中,我们使用LPS诱导诱导肾小球系膜细胞,发现细胞增殖能力增强,与上述文献报道一致。
微小RNA(microRNA,miRNA)是一类长度为 21~26个核苷酸的单链小分子非编码RNA片段,主要通过抑制蛋白质翻译及调节mRNA的剪切方式来调控靶基因[14-15]。研究发现,miRNA在细胞分化、细胞增殖、细胞凋亡、脂类代谢、等多种生理过程中发挥作用[16]。也有研究表明miRNA对炎症及其相关反应的发生具有一定的影响[17]。研究发现,miR-148a-3p在狼疮性肾炎小鼠模型及肾小球中细胞均呈现高表达状态[4],本实验中我们先确定了miR-148a-3p在系膜增生性肾小球肾炎的表达情况,结果表明LPS组中miR-148a-3p的表达显著上调,与上述文献报道一致。为了进一步研究miR-148a-3p是否对LPS诱导肾小球系膜细胞的增殖与凋亡产生影响,我们转染了miR-148a-3p inhibitor,结果发现miR-148a-3p inhibitor使HBZY-1细胞增殖能力下降,凋亡能力提高。
NF-κB是近年来研究较多的核转录因子,可调控细胞因子、免疫分子等多种基因的表达[18-19]。正常情况下NF-κB磷酸化位点被IκB封闭,处于无活性状态。在各种炎性损伤时,上游IKK激酶降解IκB后,使P65迅速转移至核内,P65能识别特定的DNA序列,与某些炎症因子基因启动区或增强子上的IκB位点结合,启动相关基因转录,诱导多种细胞因子过量表达,进一步反馈激活NF-κB,从而放大炎症级联反应[20]。在炎症发生中NF-κB可诱导炎症因子,如TNF-α、IL-1β、IL-6等在内的多种炎性介质的表达[21-22]。我们进一步探讨了miR-148a-3p与炎性因子表达的关系,进行了如下实验:qPCR和Western blot结果显示,与control组相比,LPS组HBZY-1细胞中NF-κB mRNA和蛋白的表达上调,且IκB mRNA和蛋白的表达下调,与LPS组比较,miR-148a-3p inhibitor组HBZY-1细胞中NF-κB mRNA和蛋白的表达下调,且IκB mRNA和蛋白的表达上调;ELISA结果显示,与control组比较,LPS组HBZY-1细胞中TNF-α、IL-1β含量均增加,IL-10含量减少,与LPS组比较,miR-148a-3p inhibitor组HBZY-1细胞中TNF-α、IL-1β含量均减少,IL-10含量增加。因此,下调miR-148a-3p的表达可以减轻LPS诱导的肾小球系膜细胞的炎症反应。
4 结论
miR-148a-3p在大鼠肾小球系膜细胞中高表达,下调miR-148a-3p的表达可能抑制肾小球系膜细胞的增殖,促进其的凋亡,并调控炎性因子表达,其可能的机制与炎性因子的表达活性调控有关。因此,miR-148a-3p可能成为有效治疗系膜增生性肾小球肾炎的潜在治疗靶点。
