枯草芽孢杆菌SB13产内切葡聚糖酶的促进因子筛选及条件优化
2021-02-26官雪芳王琦徐庆贤孙美玲林斌黄菊青
官雪芳 王琦 徐庆贤 孙美玲 林斌 黄菊青






摘 要:为提高枯草芽孢杆菌内切葡聚糖酶的分泌水平,对枯草芽孢杆菌SB13产内切葡聚糖酶的促进因子进行了筛选,并通过正交试验进行条件优化,结果表明:MgSO4、VB1、VB2和大豆多糖对菌SB13产内切葡聚糖酶均有显著的促进作用,各因子对菌SB13产内切葡聚糖酶的最佳促进浓度分别为(w/v):MgSO4 0.6%、VB1 0.2%、VB2 0.4%和大豆多糖 0.8%,正交试验法L934表明菌SB13最优促酶因子组合为VB1 0.2%、VB2 0.5%、Mg2+ 1.6%、大豆多糖0.4%,优化获得最优促进温度为30℃、pH值为7.0。通过对促进因子的筛选及条件优化,最终使菌SB13产内切葡聚糖酶活力分别提高了200%,为高内切葡聚糖酶水平的芽孢杆菌制剂生产及应用提供参考依据。
关键词:枯草芽孢杆菌;内切葡聚糖酶;大豆多糖;豆清水;维生素B2
中图分类号:TQ 920.6 文献标志码:A 文章编号:0253-2301(2021)12-0038-07
DOI: 10.13651/j.cnki.fjnykj.2021.12.007
Screening of the Promoting Factors and Optimization of the Conditions forthe Production of Endoglucanase by Bacillus Subtilis SB13
GUAN Xue-fang1,2, WANG Qi1,2, XU Qing-xian1, SUN Mei-ling1, LIN Bin1*, HUANG Ju-qing1,2
[1. Institute of Agricultural Engineering Technology, Fujian Academy of Agricultural Sciences,
Fuzhou, Fujian 350002, China; 2. Fujian Key Laboratory of Agricultural Products
(Food) Processing, Fuzhou, Fujian 350002, China]
Abstract: In order to improve the secretion level of endoglucanase from Bacillus subtilis, the promoting factors for the production of endoglucanase by Bacillus subtilis SB13 were screened, and the condition optimization was carried out by orthogonal test. The results showed that MgSO4, VB1, VB2 and soybean polysaccharides all had significant promoting effects on the production of endoglucanase by Bacillus subtilis SB13. The optimal promoting concentrations of each factor for the production of endoglucanase by Bacillus subtilis SB13 were (w/v): 0.6% MgSO4, 0.2% VB1, 0.4% VB2, and 0.8% soybean polysaccharides, respectively. The orthogonal test L934 showed that the optimal combination of enzyme-promoting factors for Bacillus subtilis SB13 was 0.2% VB1, 0.5% VB2, 1.6% Mg2+, and 0.4% soybean polysaccharides. The optimal promotion temperature was 30℃ and pH value was 7.0. By screening the promoting factors and optimizing the conditions, the activity of endoglucanase produced by Bacillus subtilis SB13 was increased by 200%, which provided reference for the production and application of Bacillus preparations with high level of endoglucanase.
Key words: Bacillus subtilis; Endoglucanase; Soybean polysaccharide; Soybean whey; Vitamin B2
內切葡聚糖酶(endoglucanase,EC 3.2.1.4)是纤维素酶的重要组成部分,该酶主要作用于纤维素的非结晶区域,通过随机切断β1,4糖苷键,从而降解纤维素释放出不同长度的短链低聚糖,如纤维寡糖、纤维三糖等[1-2]。在纤维素等物质的开发利用过程中,内切葡聚糖酶起着非常重要的作用[3],同时内切葡聚糖酶还可以应用于饲料生产、瓶酒及果汁等的生产加工中[4-5],是自然界纤维素类物质降解及食品工业中不可或缺的重要酶系。
内切葡聚糖酶主要由真菌和细菌分泌获得,细菌由于生长速度快,生长周期短而备受青睐,但有限的产酶活力一直是制约细菌广泛应用于工业生产的主要因素,因此提高细菌产内切葡聚糖酶的活力使其更适合于工业生产一直是研究的热点[6]。为提高各菌产内切葡聚糖酶效率,国内外学者进行了大量的研究,目前主要以驯化筛选、诱变育种、基因工程、化学修饰的方法居多[7-9],例如唐自钟等[10]采用易错PCR技术对枯草芽胞杆菌Bacillus subtilis C-36 的内切葡聚糖酶基因进行定向进化,获得比亲本酶活力提高4.2倍的大肠杆菌突变株 F-10;宝力德等[11]将菌Bacillus.sp.bs-1的内切葡聚糖酶进行克隆并在大肠杆菌中进行了诱导表达,获得酶活力较高的工程菌;陆宁等[12]采用定点突变技术对枯草芽孢杆菌celA 263丙氨酸残基位点进行了不同的替换,但替换后内切葡聚糖酶的活力较野生型显著下降。基因工程技术无疑是国内外近年来使用的提高菌酶活力的主流技术,在获得能分泌更高活力的内切葡聚糖酶的同时,加入内切葡聚糖酶产酶促进因子则可使相关高产菌株产酶效率更进一步提升,与高产菌种形成互补作用,目前关于内切葡聚糖酶促进因子的研究甚少,主要体现在添加特异金属离子或者表面活性剂等方法以提高酶活力[13],但提高的效率极其有限,因此寻找其他未知内切葡聚糖酶促进因子,以进一步提高酶的活力,可为其更好的应用于工业生产发挥无可替代的作用。
枯草芽孢杆菌Bacillus subtilis作为我国获得批准可用作饲料添加剂的一类益生细菌,由于其抗逆性强、营养要求低、易储存等独特的生物学特性已被广泛研究[14]。本研究通过前期筛选工作,获得可高产内切葡聚糖酶的枯草芽孢杆菌SB13,同时发现单独采用豆腐黄浆水即可培养菌SB13,且采用黄浆水为培养基时菌SB13产内切葡聚糖酶的活力都得到极大的提高[15],为了进一步提高菌产内切葡聚糖酶的活力,本研究以有益生特性的枯草芽孢杆菌SB13为研究对象,以离子、多糖及从豆腐黄浆水中提取获得的大豆多糖、大豆异黄酮等物质为对象进行内切葡聚糖酶促进因子的筛选,通过最优促进因子及组合筛选,获得枯草芽孢杆菌SB13产内切葡聚糖酶的促进因子。
1 材料与方法
1.1 试验材料
1.1.1 菌株来源 枯草芽孢杆菌Bacillus subtilis SB13(CGMCC No.8867)为实验室自有菌种,并保藏于中国微生物菌种保藏管理委員会普通微生物中心。
1.1.2 试剂与耗材 无水乙醇和丙酮(国药集团化学试剂有限公司);三氯乙酸(国药集团化学试剂有限公司);3,5二硝基水杨酸(国药集团化学试剂有限公司);VB1(天津市福晨化学试剂厂);VB2(湖北广济药业股份有限公司);MgSO4(天津市大茂化学试剂厂);羧甲基纤维素钠和KH2PO4(西陇化工股份有限公司);Na2HPO4·12H2O(西陇化工股份有限公司);酒石酸钾钠(国药集团化学试剂有限公司);苯酚(天津市大茂化学试剂厂);亚硫酸钠(联试化工试剂有限公司);Tween 20(天津市凯通化学试剂有限公司);Tween 80(国药集团化学试剂有限公司);香菇多糖、黄芪多糖、普鲁兰糖、壳聚糖和几丁质均来自北京索莱宝科技有限公司,即用型透析袋购自默瑞生物科技有限公司。
1.1.3 仪器 pH计 FE20[梅特勒托利多仪器(上海)有限公司],电热恒温水浴锅(上海精宏实验设备有限公司)、Neofuge 15R台式高速冷冻离心机(力康发展香港有限公司),双层小容量空气浴恒温摇床NS2102C(上海皓庄仪器有限公司),Cary50型紫外可见分光光度计(美国瓦里安技术中国有限公司),SW-CJ-1F超净工作台(苏净集团苏州安泰空气技术有限公司)。
1.1.4 试验材料 基础培养基:1%胰蛋白胨、0.5%牛肉膏、1% NaCl、纯净水调整至100%、pH 7.0、高压灭菌后保存待用。大豆多糖:取豆腐废水(自制)浓缩至10%,加入15%三氯乙酸晶体,混匀,4℃、8500 r·min-1离心5 min。去沉淀取上清液,加入4倍体积无水乙醇混匀,4℃、8500 r·min-1离心5 min,弃去上清液,向沉淀中加入适量丙酮混匀,洗涤2~3次,离心、风干获得粗多糖。大豆蛋白:取100 mL豆腐废水加入76.75 g硫酸铵固体,使其均匀溶解,在25℃、8500 r·min-1离心5 min,弃去上清液,向沉淀中加入5 mL磷酸缓冲液混匀,透析袋透析去除硫酸铵。
1.2 试验方法
1.2.1 促进因子筛选 以枯草芽孢杆菌SB13为对象,分别称取各种离子、维生素、大豆多糖、大豆异黄酮、大豆蛋白及Se等因子溶于含有50 mL基础培养基的锥形瓶中,以未加物质的基础培养基为对照,调pH至7.0,121℃、20 min高压灭菌,根据1%的量接种菌SB13母液,37℃、160 r·min-1恒温培养20 h,每一处理3个重复,即获得菌SB13发酵液。以发酵液内切葡聚糖酶相对活性为指标,分析各因子对菌SB13产内切葡聚糖的促进效果,其中内切葡聚糖酶活力检测方法为:吸取各样品发酵液2 mL,10000 r·min-1,4℃离心10 min获得胞外上清液,DNS法检测上清液中内切葡聚糖酶活力,酶活计算等参考Guan等[15]。基于多糖的种类繁多,研究同时分析香菇多糖、黄氏多糖、壳聚糖、普鲁兰糖和几丁质对菌SB13产内切葡聚糖酶的促进效果,最终确定最佳促进因子类型。
1.2.2 促进因子的浓度筛选 在基础培养基中分别加入VB1和VB2至终浓度分别为(w/v) 0.05%、0.1%、0.2%、0.4%、0.6%,Mg2+(w/v 0.6%、0.8%、1.0%、1.5%、2.0 %),多糖(w/v 0.1%、0.2%、0.4%、0.6%、0.8%),接种枯草芽孢杆菌SB13,160 r·min-1、37℃培养20 h,检测胞外液中内切葡聚糖胞外酶活力,确定最佳促进浓度。
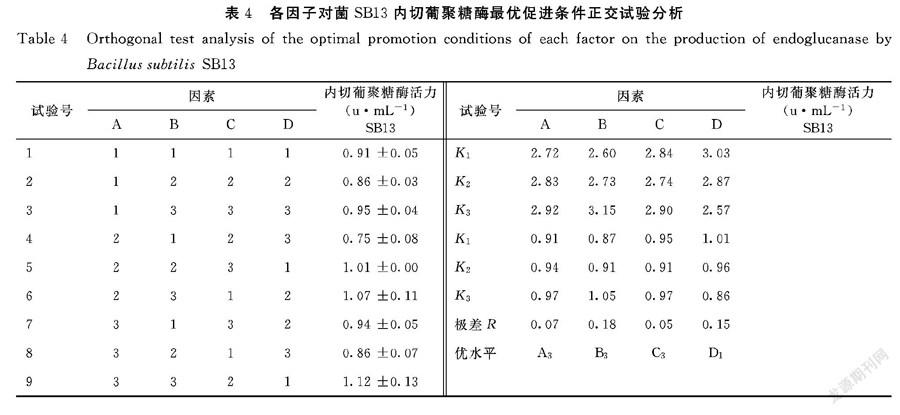
1.2.3 正交试验筛选最优促进组合 采用L934正交法对MgSO4、VB1、VB2、大豆多糖四因子及浓度进行枯草芽孢杆菌SB13产酶切葡聚糖酶活性检测分析,筛选出菌产内切葡聚糖酶的最优发酵条件组合,各因素添加浓度见表1。
1.2.4 枯草芽孢杆菌SB13产内切葡聚糖酶促进温度及pH值优化 根据最优促进浓度、分别在基础培养基中加入各促进因子,进行不同温度(15℃、20℃、25℃、30℃、35℃、40℃),不同发酵pH值(5~9)条件下菌SB13产内切葡聚糖酶的活力检测分析,筛选出最优产酶促进温度及pH值。
2 结果与分析
2.1 促进因子筛选
2.1.1 各因子对枯草芽孢杆菌SB13产内切葡聚糖酶的影响 从表2可知,MgSO4、VB1、VB2、大豆多糖对菌SB13产内切葡聚糖酶的相对酶活分别为114.66%、111.24%、165.72% 和152.61%,说明以上物质对菌SB13产内切葡聚糖酶有极好的促进作用,其中大豆多糖及VB2可提高对内切葡聚糖的产酶率达50%以上。
2.1.2 多糖类物质对菌产内切葡聚糖酶的影响 由图1可知,香菇多糖、黄氏多糖对菌SB13产内切葡聚糖酶有显著的促进作用,相对酶活分别达到197.44%和186.95%,与大豆多糖(194.07%)效果相当,最终挑选大豆多糖为产内切葡聚糖酶的最佳促进因子。
2.2 促进因子最优条件组合
2.2.1 各促进因子最适促进浓度优化 由图2可知,VB1(图2a)、大豆多糖(图2d)对菌SB13产内切葡聚糖酶的最佳促进浓度分别为0.2%和0.8%;VB2(图2b)、MgSO4(图2C)对菌SB13最佳促进浓度分别为0.4%和1.5%。由于浓度为0.6%~1.5%的MgSO4对菌SB13促进效果差异不显著,故选0.6%最为最佳促进浓度。
2.2.2 正交试验筛选因子最佳条件组合 正交法L934分析促进因子VB1、VB2、Mg2+、大豆多糖对菌SB13产内切葡聚糖酶最佳促进组合(表4)。极差R值大小可见,各因子对菌产内切葡聚糖酶的影响为B>D>A>C(菌SB13),即VB2影响最大,大豆多糖次之,VB1、镁离子影响最小;最优促进组合为A3B3C3D1(菌SB13),产内切葡聚糖酶的最优工艺条件为0.2%VB1、0.5%VB2、1.6%Mg2+、0.4%大豆多糖。
2.3 各因子对菌SB13产内切葡聚糖酶的最适发酵条件
2.3.1 最适温度优化 由图3可知,温度在30℃时,加入MgSO4、VB1、VB2、大豆多糖及最优组合后,菌SB13的内切葡聚糖酶活力分别为0.80、0.50、0.97、1.27和1.44 U·mL-1,均高于对照组的0.48 U·mL-1,各因子酶活力分别是对照的1.67、1.04、2.02、2.65和3倍,表现出极好的促进作用,故选取30℃作为各因子促进菌SB13的最佳促进温度。
2.3.2 最适pH值优化 分析不同pH值条件下,各促进因子对菌SB13的产酶效果,由图4可知,当pH值为7.0时,加入MgSO4、VB1、VB2、大豆多糖及最优组合后,菌SB13的内切葡聚糖酶活力分别为0.52、0.67、0.76、0.95和1.07(U·mL-1),均高于对照0.49 U·mL-1,各因子酶活力分别是对照的1.06、1.37、1.55、1.94和2.18倍,故选择7.0为最适促进pH值。
3 结论与讨论
本研究系统地分析了各种离子、各种维生素、大豆蛋白、大豆异黄酮、EDTA、大豆多糖及其他部分物质的多糖对枯草芽孢杆菌SB13产内切葡聚糖酶的影响,发现MgSO4、VB1、VB2、香菇多糖、黄氏多糖和大豆多糖对其产酶有促进作用,其中VB2、香菇多糖、黄氏多糖和大豆多糖促进效果极显著。为了进一步提高菌SB13等产内切葡聚糖酶的发酵工艺,本研究确定Mg2+、VB1、VB2和大豆多糖为主要内切葡聚糖酶促进因子进行了因子组合优化及条件优化分析。
通过对各因子加入量的优化,各因子对菌SB13促产内切葡聚糖酶的最佳促进浓度分别为(w/v):MgSO4 0.6%、VB1 0.2%、VB2 0.4%和大豆多糖 0.8%,采用正交法L934对四因子进行了最优条件组合分析,确定菌SB13的最优发酵条件组合为0.2 % VB1、0.5 % VB2、1.6% MgSO4、0.4% 大豆多糖,优化获得最优促进温度为30℃,最优促进pH值为7.0。本研究通过对促进因子的筛选及条件优化,最终使枯草芽孢杆菌SB13产内切葡聚糖酶的活力提高了200%,为枯草芽孢杆菌SB13更好的应用于工业生产提供研究基础。
已有研究表明各种氮源、金属离子、维生素的添加,会使纤维素分解酶的产生水平发生明显的变化[16],程旺开[17]研究金属离子对纤维素酶活性的影响,发现MgSO4对β葡萄糖苷酶活性具有一定的促进作用,本次研究发现Mg2+对菌SB13产内切葡聚糖酶有一定的促进作用,是否Mg2+也通过影响内切葡聚糖酶的活性而使内切葡聚糖酶活力得到提高,还需进一步研究。
已经发现纤维素的酶解产物之一纤维二糖能被吸收进入细胞内诱导诸多真菌产纤维素酶[18],这些水解的纤维二糖主要通过与定位于细胞膜上的纤维二糖转运蛋白Crtl相结合后形成纤维素酶诱导信号经下游信号途径的传递进入细胞核激活纤维素酶的表达[19]。除了纤维二糖,多种其他类型的二糖也被证实能直接诱导真菌产纤维素酶:Mandels等[20]发现,从含有杂质的试剂级的葡萄糖中分离出的槐糖(由2个葡萄糖分子经过β1,2糖苷键连接所形成) 可直接诱导里氏木霉产纤维素酶,其诱导活性是纤维二糖的2500倍,是微晶纤维素等其他诱导物的几十到几千倍,但槐糖却不能诱导其他菌如青酶、曲霉及枯草芽孢杆菌等产纤维素酶;乳糖(由葡萄糖及半乳糖经过β1,4糖苷键连接形成)也可以直接诱导里氏木霉和其他真菌产纤维素酶,该糖对里氏木霉的诱导能力弱于槐糖,但可显著促进丝状真菌Acremoniumcellulolyticus高效合成纤维素酶[21]。山梨糖则通过在转录水平上调控6种纤维素酶基因的表达,影响细胞壁蛋白的糖基化,降低细胞壁的形成来提高内切葡聚糖苷酶Ⅰ和外切葡聚糖苷酶Ⅱ的分泌和表达
[22-23]。本研究基于這样的启示,从豆腐黄浆水中提取分离了大豆多糖,并发现其同样对菌SB13产内切葡聚糖酶有极显著的促进作用,是否大豆多糖通过其酶解产物促进内芽孢杆菌对内切葡聚糖的分泌,其促进机理有待进一步探索。
参考文献:
[1]RAGOTHAMAN M,YENNAMALLI ANDREW J,RADER JEFFREY D,et al.Thermostability in endoglucanases is fold-specific[J].Bmc Structural Biology,2011,11:10-25.
[2]LIMA A O S,MARIA M C Q,FUNGARO M H P,et al.Molecular characterization of a beta1,4endoglucanase from an endophytic Bacillus pumilusstrain[J].Applied Microbiology & Biotechnology,2005,68(1):57-65.
[3]SREENA C P.Arecanut husk:A potential feedstock for enhanced production of endoglucanase by Bacillus subtilis MU S1[J].Environmental Technology & Innovation,2020,19:100989.
[4]WANG Y,YUAN H,WANG J,et al.Truncation of the cellulose binding domain improved thermal stability of endoβ1,4glucanase from Bacillus subtilis JA18[J].Bioresource Technology,2009,99(1):345-349.
[5]BIOTECHNOLOGY,NASSIRI M,BARZEGAR H,et al.Endoglucanase Isolated from Iranian Bacillus subtilis Recombinant Expression and Characterization of[J].Journal of Applied Biotechnology Reports,2021,8(2): 133-140.
[6]WEI K C,TEOH T C,KOSHY P,et al.Cloning,expression and characterization of the endoglucanase gene from Bacillus subtilis UMC7 isolated from the gut of the indigenous termite Macrotermes malaccensis in Escherichia coli[J].Electronic Journal of Biotechnology,2015,18(2):103-109.
[7]KL A,WS A,MMP C,et al.Enhancing the catalytic activity of a GH5 processive endoglucanase from Bacillus subtilis BS5 by site-directed mutagenesis[J].International Journal of Biological Macromolecules,2021,168:442-452.
[8]GHADIRI E,NAGHAVI N S,GHAEDI K.Gene Production and Characterization of Bacillus Subtilis Cellulase Collected from Central-Northern Iran Forests[J].Proceedings of the National Academy of Sciences,India Section B:Biological Sciences,2021:1-6.
[9]GHADIRI E,NAGHAVI N S,GHAEDI K.Molecular cloning and characterizing of Bacillus subtilis cellulase collected from central-northern Iran forests[J].Gene Reports,2020,20(2):100772.
[10]唐自鐘,刘姗,韩学易,等.易错PCR技术提高中性内切葡聚糖酶活性[J].食品与生物技术学报,2013(7):754-761.
[11]宝力德,秦伟,杨嘉萌,等.Bacillus.sp.bs-1的内切葡聚糖酶在大肠杆菌中表达条件的优化及其活性分析[J].内蒙古农业大学学报(自然科学版),2013(5):77-82.
[12]陆宁,柳帅,张玉洁,等.枯草芽孢杆菌内切葡聚糖酶Ala263位点突变对其活性的影响[J].中国酿造,2013,32(3):122-125.
[13]MIZUTANI C,SETHUMADHAVAN K,HOWLEY P,et al.Effect of a nonionic surfactant on Trichoderma cellulase treatments of regenerated cellulose and cotton yarns[J].Cellulose,2002,9(1):83-89.
[14]RENGPIPAT S,RUKPRATANPORN S,PIYATIRATITIVORAKUL S,et al.Immunity enhancement in black tiger shrimp (Penaeus monodon) by a probiont bacterium (Bacillus S11)[J].Aquaculture,2000,191(4):271-288.
[15]GUAN X F,XU Q X,LI L,et al.Identification of Endoglucanase-producing/xylanase-Producing Strains Cultivated in Beancurd (soybean) Wastewater Medium[J].J Pure Appl Microbio,2015,9:1-9.
[16]KSHIRSAGAR S,WAGHMARE P,SARATALE G,et al.Composition of Synthesized Cellulolytic Enzymes Varied with the Usage of Agricultural Substrates and Microorganisms[J].Applied Biochemistry and Biotechnology,2020,191(1):1695-1710.
[17]程旺开.金属离子对纤维素酶活性影响的研究[J].安徽农学通报,2011(5):27-28.
[18]WANG X,XUSHI X U,AMP W M,et al.Induction and regulation of cellulase of cellulaseforlilase formation in two trains of fungi by different carbon sources[J].Chinese Journal of Applied and Environmental Biology,2002,8(6):653-657.
[19]寇艳波.里氏木霉纤维素酶诱导表达过程中碳源感应机制的研究[D].济南:山东大学,2015.
[20]MANDELS M,REESE E T.Induction of cellulase in fungal by cellobiose[J].Bacteriol,1960,6(79):816-826.
[21]FANG X,YANO S,INOUE H,et al.Lactose enhances cellulase production by the filamentous fungus Acremonium cellulolyticus[J].Journal of Bioscience and Bioengineering,2008,106(2):115-120.
[22]COLLN A,SALOHEIMO M,BAILEY M,et al.Protein production and induction of the unfolded protein response in Trichoderma reesei strain RutC30 and its transformant expressing endoglucanase I with a hydrophobic tag[J].Biotechnology & Bioengineering,2010,89(3):335-344.
[23]LO C M,QIN Z,CALLOW N V,et al.Roles of extracellular lactose hydrolysis in cellulase production by Trichoderma reesei Rut C30 using lactose as inducing substrate[J].Process Biochemistry,2010,45(9):1494-1503.
(责任编辑:柯文辉)
收稿日期:2021-09-10
作者简介:官雪芳,女,1979年生,硕士研究生,助理研究员,主要从事微生物学应用研究。
通信作者:林斌,男,1964年生,博士研究生,研究员,主要从事农业废弃物资源化利用(E-mail:linbin591@126.com)。
基金项目:福建省科技计划项目——省属公益类科研院所基本科研专项(2019R1032-4);福建省农业科学院“十三五”食品加工科技創新团队(CXTD2021032)。
