阿帕替尼联合紫杉醇治疗晚期胃癌的临床效果及对血管生成抑制的影响
2021-02-25余炜范芳余辉陈玲谢瑞祥
余炜,范芳,余辉,陈玲,谢瑞祥
胃癌在我国患病率及病死率均居所有恶性肿瘤的第2位,尤其伴随目前人们生活节奏加快、饮食习惯的变化使得该疾病患病率不断升高[1-2]。胃癌早期无特异性表现,多数患者确诊时已至中晚期,延误了手术治疗的最佳时机,故化疗成为其主要治疗手段。目前晚期胃癌的一线方案多以氟尿嘧啶联合铂类为基础的2种或3种联合方案,但是一线方案依然缺乏统一标准[3]。对于Her-2阴性晚期胃癌患者二线指南推荐使用紫杉醇类药物延长生存时间,而血管生成靶向药物VEGFR-2酪氨酸激酶抑制剂阿帕替尼的应用给此类患者治疗带来新的希望[4]。本研究观察阿帕替尼联合紫杉醇治疗晚期胃癌的临床效果及对血管生成抑制的影响,报道如下。
1 资料与方法
1.1 一般资料 选取2017年4月-2018年4月福建省肿瘤医院收治的晚期胃癌患者85例,按照随机数字表法分为观察组43例和对照组42例。观察组男20例,女23例;年龄46~76(56.2±3.6)岁;ECOC评分为0~2(1.10±0.07)分;分化程度:低分化36例、中分化7例;病理类型:腺癌28例、印戒细胞癌11例、黏液腺癌4例。对照组男24例,女18例;年龄48~72(57.0±2.2)岁;ECOC评分为0~2(1.05±0.04)分;分化程度:低分化33例、中分化9例;病理类型:腺癌31例、印戒细胞癌7例、黏液腺癌4例。2组患者一般资料组间比较差异无统计学意义(P>0.05),组间可比。本研究获医院医学伦理委员会批准实施,患者及家属均知晓研究内容并签署知情同意书。
1.2 纳入及排除标准 纳入标准:(1)患者均经CT、病理等检查确诊为晚期胃癌,且IHC和FISH检查结果为Her-2阴性;(2)行一线化疗方案后病情进展的患者;(3)经实体瘤临床疗效评估标准,检测到靶病灶数量≥1个者。排除标准:(1)合并精神性、感染性疾病患者;(2)听力障碍,无法正常交流沟通者;(3)合并严重肝肾等重要脏器功能损伤患者。
1.3 方法 对照组仅予紫杉醇单独化疗,第1天给予紫杉醇135 mg/m2,滴注3 h,并予地塞米松和茶苯海明联合使用降低过敏反应,3周为1个周期。观察组在对照组基础上联合阿帕替尼治疗:患者午餐后30 min予阿帕替尼400 mg口服,每天1次。2组患者治疗期间定期检测肝、肾功能,可予托烷司琼、甲氧氯普胺防止呕吐反应;注射胸腺肽等调节机体免疫功能、磷酸肌酸钠护心、异甘草酸镁保肝等。化疗时间均≥2个周期,且给药时间≤6个周期。
1.4 观察指标 比较2组治疗效果,治疗前后血清中血管内皮生长因子(VEGF)、胃癌组织中肿瘤微血管密度(MVD)变化及不良反应发生情况。分别于治疗前后清晨空腹采集血清使用ELISA法测定血清VEGF水平;经内镜超声的胃镜活检钳穿刺至胃壁采集病灶组织,制作成5 μm连续切片,使用抗Ⅷ因子先关抗原的单克隆抗体(购自Dako公司的Anti F-Ⅷ RAg)对微血管内皮细胞染色,工作浓度为1∶250。MVD测定:参照刘霞等[6]报道的研究方法,找出染色为棕色的血管内皮细胞或细胞簇,若其与临近微血管、病灶细胞等分开即可视为一个微血管。本研究中以5个×200视野的血管数目表示(计算平均值)。
药物不良反应评估参照世界卫生组织(WHO)抗癌药物不良反应分级标准[7],其中0~Ⅱ级为轻度;Ⅲ~Ⅳ级为重度。
1.5 疗效评定标准 以治疗前的肿瘤影像学检测结果为基准,参考《实体瘤临床疗效评估标准(RECIST1.1)》[5]中的内容对临床疗效进行评估:(1)完全缓解(CR):治疗后肿瘤病灶完全消失且持续时间≥4周;(2)部分缓解(PR):治疗后肿瘤病灶最大径较治疗前减少>1/2,持续4周无新病灶出现;(3)稳定(SD):肿瘤病灶最大径减少不足1/2,持续4周未发现新病灶;(4)进展(PD):靶病灶最大径增大>1/4,或出现新的病灶。总有效率(RR)=(CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。
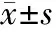
2 结 果
2.1 治疗效果比较 观察组患者治疗总有效率为20.93%,病情控制率为55.81%,对照组分别为16.67%、38.10%,2组比较差异无统计学意义(P>0.05)。见表1。
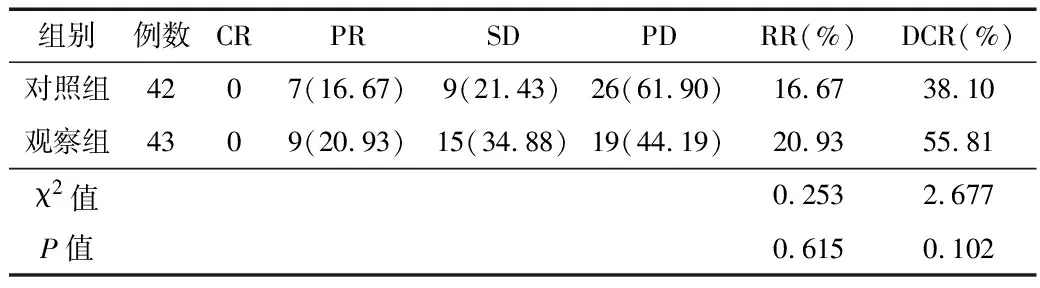
表1 2组患者治疗效果比较 [例(%)]
2.2 血清VEGF及病灶组织中MVD表达情况比较 治疗后2组患者血清VEGF及病灶组织中MVD表达量均显著下降,其中对照组治疗前后差异无统计学意义(P>0.05);观察组治疗后2项指标均显著低于治疗前(P<0.05);治疗后观察组血清VEGF水平及MVD表达量低于对照组,组间比较差异无统计学意义(P>0.05)。见表2。
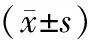
表2 2组患者治疗前后血清VEGF及病灶组织中MVD表达情况比较
2.3 不良反应发生情况比较 观察组不良反应总发生率为20.93%,对照组为11.90%,2组间比较差异无统计学意义(χ2=1.258,P=0.262)。见表3。
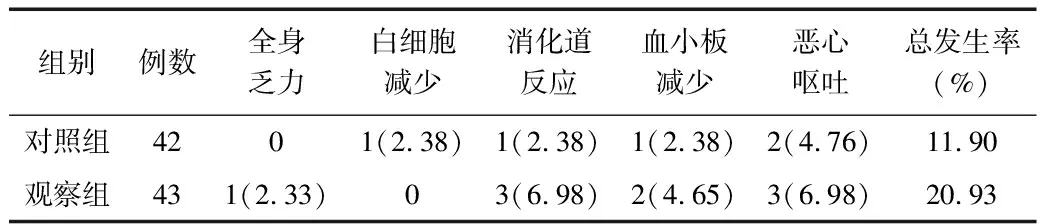
表3 2组患者不良反应发生情况比较 [例(%)]
3 讨 论
胃癌是消化系统常见的恶性肿瘤,该病症早期无特异性表现,首诊确诊时大多已进展至中晚期,延误了手术治疗的时机,只能采用以化疗为主的综合治疗方案延长患者的生存时间[8-9]。近年来,随着国内外生物学技术的不断进展,人们对恶性肿瘤的认知和治疗也有了新的进展。分子靶向治疗是一种疗效显著的新型治疗方案,即在分子水平上针对已明确的致癌位点(蛋白分子、基因片段),使药物进入体内后特异性选择该位点发生作用起到杀灭癌细胞的作用[10]。
紫杉醇是一种细胞度活性物质,在诱导胃癌细胞死亡的同时也会杀灭中性粒细胞,从而诱发多种不良反应。单纯使用紫杉醇剂量会增多,导致不良反应加剧,甚至影响化疗的进展。阿帕替尼是我国自主研发的口服小分子VEGFR-2酪氨酸激酶抑制剂,亦是首个在化疗失败后通过抑制肿瘤血管生成的靶向治疗药物,现已批准可以用于以往接受过至少2种化疗的晚期胃癌患者。该药物在进入患者体内后能够针对性阻断介导肿瘤生长与血管生成信号通路,通过抑制肿瘤血管的生成来抑制肿瘤进展[11]。从药理学角度分析,阿帕替尼通过阻断下游信号传导作用,特异性选择细胞中的受体位点相结合,抑制肿瘤组织新生血管及酪氨酸激酶的生成,促使肿瘤细胞快速凋亡[12]。既往有研究者将二线化疗失败的胃癌及胃食管结合部腺癌Ⅲ期患者273例进行双盲随机对比,结果显示采用阿帕替尼治疗组患者mPFS为2.6个月,明显长于安慰剂组的1.8个月,且阿帕替尼组不良反应发生率较轻[13]。
本研究结果显示,观察组患者疾病控制率高于对照组,2组不良反应总发生率无明显统计学差异,提示阿帕替尼联合紫杉醇治疗晚期胃癌的疗效可有所提升,且同时可确保用药的安全性。究其原因:(1)阿帕替尼是一种高选择性VEGFR-2酪氨酸激酶抑制剂选择性作用于受体位点,减少对其他细胞的损伤;(2)联合化疗方案会减少紫杉醇使用剂量,减少2种药物对患者机体的刺激。同时,2组患者治疗后血清VEGF水平及胃癌组织中MVD均显著下降,提示经治疗后2组肿瘤血管生成均得到一定程度的抑制。而观察组患者血清VEGF及MVD表达量均显著低于对照组,提示阿帕替尼联合紫杉醇治疗可更好地抑制病灶血管生成。
虽然阿帕替尼在肺癌、肝癌等其他恶性肿瘤治疗的应用多有报道且显著疗效,但对于一线化疗方案耐药的晚期胃癌患者,采用阿帕替尼二线方案的证据并不充分。因本研究选取样本量相对较少,未来仍需扩大样本量以进一步研究,提供更为准确的研究结果。
综上所述,阿帕替尼联合紫杉醇治疗晚期胃癌的临床效果良好,可通过抑制肿瘤血管生成来促使癌细胞凋亡,且安全性高,值得推广使用。
