1例疑难克罗恩病诊疗思维分析
2021-02-25崔伯塔朱建国张发明
温 泉,崔伯塔,张 慧,朱建国,张发明
0 引 言
克罗恩病(Crohn′s disease, CD)是一种可累及全消化道的慢性进展免疫性疾病。其发病机制复杂,与遗传、环境、饮食、肠道菌群等多因素相关。近年来,国内CD的发病率与患病率呈逐年上升趋势。CD患者往往病情复杂,病程长,并发症多,致残率高,早期起病隐匿,容易误诊。不同个体严重程度、治疗决策、结局差别大。本文报道一例CD的诊疗决策过程,强调整合医学的临床思维在个体化诊疗策略中的运用[1]。
1 病例资料
患者,男,37岁,因“反复腹痛、腹泻16年”于2019-08-28入院。患者于入院前16年无明显诱因出现反复脐周阵发性隐痛,腹泻,1~2次/d。10年前患者因肛门疼痛于外院行肛周脓肿手术。8年前患者突发右下腹疼痛,外院行阑尾切除手术。7年前患者因饮食不当出现脐周持续性疼痛,伴恶心呕吐,伴腹泻,解稀便4~5次/d,无黏液脓血,查腹部X线提示不全性肠梗阻;腹部CT提示肠系膜弥漫性水肿,腹膜后多发小淋巴结;血结核杆菌抗体阳性。外院考虑腹腔结核可能性大,于2011-08-19开始行诊断性抗结核治疗半年,仍间断有腹痛、腹泻。6年前外院查胃肠镜未见明显异常。4年前患者再次因肛门疼痛于外院行肛周脓肿手术。近1年患者自觉腹痛、腹泻频率较前增加,5~6次/d,间断便后有鲜血,体重下降约10 kg。
1.1体格检查生命体征平稳,神志清,精神可,心肺未查见阳性体征,腹平坦,右下腹可见一长约5 cm的手术瘢痕,全腹无压痛、肌紧张,双下肢不肿。
1.2临床初步诊断CD,小肠狭窄或肠内瘘待排,营养不良。
1.3临床检验血常规、肝肾功电解质、甲状腺功能、自身抗体、肿瘤标志物、凝血常规、输血常规未见明显异常;粪便隐血(+);TORCH(-);T-SPOT(-);超敏C反应蛋白28.4 mg/L;血沉18 mm/h;免疫球蛋白IgE 286 IU/ml。
1.4临床诊疗患者整体营养状况评估(scored patient-generated subjective global assessment, PG-SGA)12分,重度营养不良[2]。患者有肠内营养的需求,同时加入医院研究CD患者肠道准备方法的临床试验[3]。置入鼻空肠管,遂完成胃镜检查;同时行中消化道途径经内镜肠道植管术(transendoscopic enteral tubing, TET),后顺利经TET管(FMT-DT-N-27/1350, 2.7 mm×135 cm, 南京法迈特科技)内注入肠道充盈对比剂,完成磁共振肠道成像(magnetic resonance enterography,MRE)和肠镜肠道准备[4]。MRE提示远段回肠肠壁增厚,肠腔狭窄,病灶呈跳跃性分布,见图1a、b。根据MRE结果,结肠镜插入末端回肠约30 cm处,见肠腔偏心性狭窄,局部溃疡,内镜不能通过,回盲瓣口见溃疡,见图2a、b。根据中国炎症性肠病诊治共识诊断为CD(蒙特利尔分型A2、L1、B2p)、重度营养不良,疾病活动Harvey-Bradshaw (HBI)指数9分[5]。肠镜结束后2 h,开始经中消化道TET管给予肠内营养治疗。第2天经此管给予单次洗涤菌群移植(washed microbiota transplantation, WMT)治疗[6-7]。患者腹痛、腹泻症状逐渐好转,7 d后出院。出院前将患者中消化道TET管拔到胃内,出院后患者继续鼻饲完全肠内营养,2个月后开始加用沙利度胺100 mg口服。完全肠内营养治疗3个月再次入我院复诊,评价HBI 0分。复查MRE提示末端回肠病变长度及肠壁周围新生的系膜血管病变较3个月前明显减轻,见图1c、d。复查肠镜,结肠镜插入末端回肠见瘢痕修复改变、肠腔狭窄环及炎性息肉,见图2c、d。考虑患者治疗有效,再次经胃镜下中消化道行WMT,以维持治疗,出院后继续口服沙利度胺,并过渡到普通饮食。2020-06-15随访患者体重增加5 kg,无腹痛、腹泻等不适,HBI维持0分。

a(冠状位)和b(横断位):治疗前,远段回肠肠壁增厚,肠腔狭窄,肠壁周围新生的系膜血管明显(箭);c(冠状位)和d(横断位):治疗后,末端回肠病变长度及肠壁周围新生的系膜血管病变较3个月前明显减轻(白色箭头处)
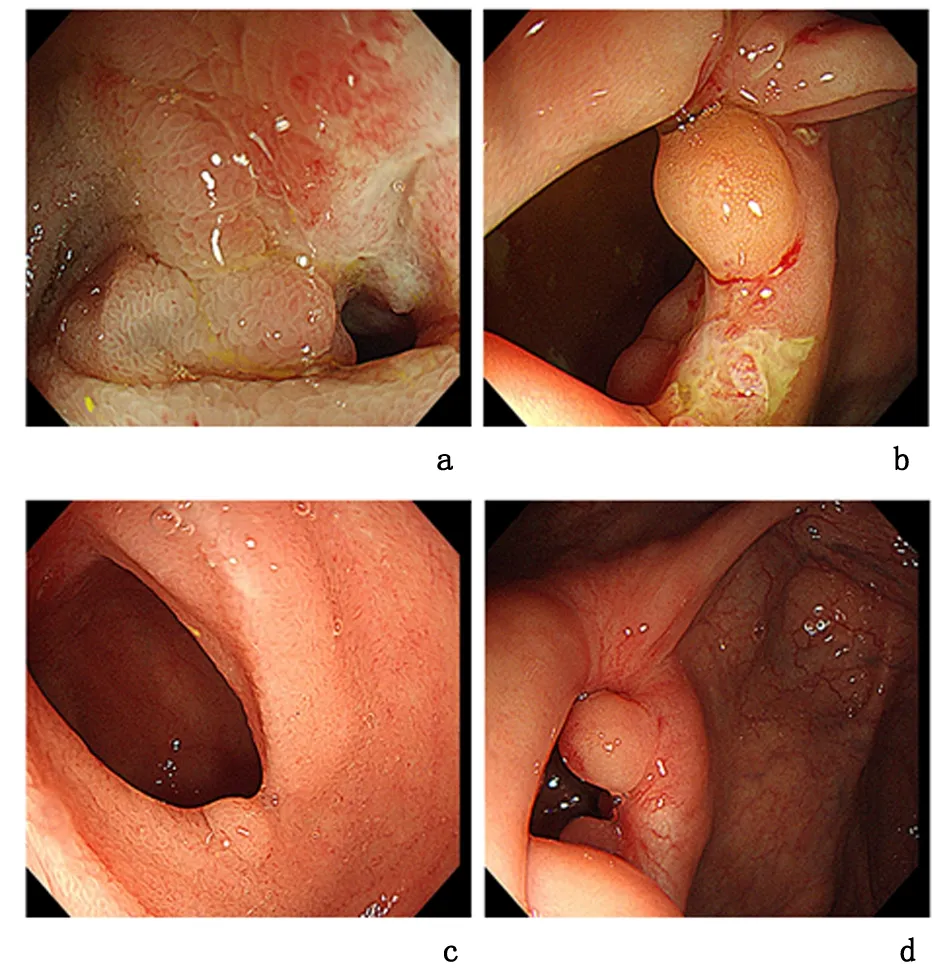
a:治疗前,末端回肠距回盲瓣约30 cm处见肠腔偏心性狭窄,眺望见口侧狭窄段炎性增生,局部溃疡,内镜不能通过;b:治疗前,回盲瓣口变形,其上可见一枚炎性息肉和一大小约0.6 cm×1.0 cm不规则溃疡;c: 治疗后,末端回肠距回盲瓣30 cm处见肠腔狭窄环,其上可见炎性息肉及白色瘢痕,未见糜烂溃疡;d:治疗后,回盲瓣口变形,其上可见炎性息肉,未见糜烂溃疡
2 病例讨论
消化内科崔伯塔主治医师:本例患者病程长,主要表现为反复腹痛、腹泻伴消瘦,有肛周脓肿、阑尾切除及不全肠梗阻病史,曾行抗结核治疗无效,高度怀疑CD,同时合并营养不良,考虑病变位于小肠可能性大。需MRE和胃肠镜评估消化道病变程度和范围。MRE检查前肠道准备包括肠道清洁和肠道充盈。但患者院外有口服泻药出现腹胀、恶心呕吐的痛苦经历,拒绝口服泻药。另外,考虑患者合并肠道狭窄可能性大,肠道准备困难。因此,在患者入院后安排胃镜排除上消化道病变,同时完成中消化道TET植管。中消化道TET植管具有快捷、安全、高效的优势,插管时间最短1.4 min,平均植管时间(4.2±1.9)min,无需口鼻交换,无需X线引导及确认,前期研究显示植管成功率98.8%,无严重不良反应发生,患者满意度达96.5%[4]。患者TET植管成功后,顺利经此管完成肠道准备、充盈,避免了饮用大量液体泻药和对比剂溶液可能产生的不良症状。同时,也为后期肠内营养和WMT治疗创造了途径。
临床营养科张慧主治医师:炎症性肠病患者在初诊时应常规进行营养风险筛查,对筛查出有营养风险的患者应进行营养状况评定,确定营养治疗方案,并给予营养支持治疗[2]。根据共识推荐PG-SGA作为营养状况主观评定工具[2]。此患者PG-SGA评分12分,营养状况处于重度营养不良,24 h持续管饲肠内营养治疗为最佳选择。肠内营养对CD不仅有营养支持作用,同时可以诱导并维持缓解。在治疗期间需动态监测患者的营养状况,并根据病情及监测结果及时调整营养支持治疗方案。
影像科朱建国副主任医师:CD可累及全消化道。对于疑似CD的患者,应进行肠道影像学检查评估肠道病变部位和炎症的严重程度。MRE检查具有无创、无辐射的优势,应用磁共振弥散加权成像和动态增强成像等功能性技术对CD内瘘和狭窄的检出率较高[8-9]。肠镜检查前安排MRE有助于有创检查前风险评估,指导肠镜进镜深度。此例患者MRE提示病变位于末端回肠,指导肠镜向末端回肠深部进镜成功发现病变,避免了再次行小肠镜的痛苦及医疗费用。
消化内科张发明主任医师:患者诊断CD合并营养不良,在无梗阻、无瘘的情况下可选择内科治疗,以及肠内营养、WMT、激素、生物制剂诱导缓解。目前的治疗目标是避免手术或为手术创造更好的条件。本例采用WMT升阶治疗策略。患者肠镜结束后2 h即开始经中消化道TET管行肠内营养治疗。然后择期经TET管实施WMT,腹痛等症状快速消除。前期研究表明WMT可有效诱导和维持CD缓解,并且可有效降低CD患者医疗及社会成本,提高生活质量[10-11]。对于不适合、不接受或使用激素、免疫抑制剂、生物制剂效果不佳的CD患者可考虑WMT治疗。患者第1个WMT疗程治疗后3个月复查病变明显好转,故结合既往研究,推荐于距第1次WMT后3个月进行第2个疗程WMT维持治疗[12]。患者依从WMT后联合肠内营养治疗3个月,HBI持续降低,择期加用沙利度胺维持治疗,恢复常规饮食,随访10个月,HBI维持0。中国菌群移植平台将持续对患者进行十年长期随访的疗效及安全性评估[13]。患者总体治疗方案的选择是基于WMT升阶梯个体化的整合治疗策略,可获得比单纯治疗更有效的临床反应[13]。虽然目前尚缺随机对照研究证据,但本例治疗经验对于启发真实世界临床个体化诊疗很重要。
综上,本例CD患者在诊疗方案选择上整合了可应用的新技术,及时实施合理的诊疗方案获得了满意的疗效。作者希望能启发广大同道在临床实践中重视并运用整合医学临床思维,实现满足治疗疗效,并兼顾减轻患者痛苦的医疗目标。