脂筏依赖性内吞途径对轮状病毒感染细胞表面NHE3蛋白的调控作用
2021-02-25秦红霞田一博李萌萌焦佳伟孙艺文王世广
王 鹏,秦红霞,田一博,李萌萌,焦佳伟,孙艺文,王世广
0 引 言
造成5岁以下小儿重症腹泻的主要原因之一为轮状病毒(rotavirus, RV)感染,且在发展中国家发生率更高,威胁着全世界婴幼儿的健康甚至生命[1]。肠道分泌与吸收之间的平衡失调即会导致腹泻的发生[2]。钠-氢交换蛋白(Na+/H+exchanger,NHE)3型参与多种肠道生理病理学过程,哺乳动物肠道上皮细胞刷状缘膜表面为其主要表达部位,与肠道Na+和水的吸收密切相关。当小鼠NHE3基因敲除后,肠道Na+和水的吸收减少,产生腹泻症状[3],与之相似,霍乱毒素或炎性肠病也可明显抑制NHE3蛋白的量和生物活性,诱发腹泻[4]。研究发现,细胞内吞和/或胞吐率的改变可急性调控NHE3蛋白的量和生物活性,且50 %NHE3的转运调控是胆固醇依赖性,属于Rho蛋白家族的Cdc42分子,参与调控胆固醇依赖性的细胞内吞/胞吐进程[5-6]。本研究利用脂筏破坏剂甲基-β-环糊精(methyl-β-cyclodextrin,MβCD),在表达NHE3单层极化Caco-2细胞模型的基础上,研究RV感染对细胞表面NHE3蛋白的量连同生物活性是否与脂筏介导的Cdc42依赖性内吞通路的调控有关,从而为实现RV感染性腹泻的靶向治疗和药物开发提供实验基础和理论依据。
1 材料与方法
1.1 试剂抗鼠Cdc42抗体、抗鼠HA抗体、抗兔GAPDH抗体、HOE694和BCECF-AM均购自Santa Cruz生物科技公司,FBS、DMEM细胞培养液购自Thermo Fisher 科技公司。Goat Anti-Mouse IgG H&L (Alexa Fluor® 790)和Goat Anti-Rabbit IgG H&L(Alexa Fluor® 680)抗体购自Abcam公司。TRIzol试剂购自Invitrogen公司,Transwell细胞培养盘购自Corning 公司。Caco-2细胞购自中国科学院细胞库,其他实验用品购自Sigma-Aldrich 公司。
1.2方法
1.2.1 表达NHE3 的单层极化Caco-2细胞模型的构建HEK 293细胞内扩增腺病毒载体HA-NHE3,梯度CsCl纯化收集HA-NHE3腺病毒[7]。在装有聚碳酸酯膜的细胞培养插件的Transwell 培养盘内以1.2×105cells/cm2的浓度接种Caco-2 细胞,37 ℃,5%CO2培养12 d 后转染腺病毒HA-NHE3,继续培养48 h 构建表达HA-NHE3的单层极化Caco-2细胞。
1.2.2细胞分组表达HA-NHE3 的单层极化Caco-2细胞分别加入等体积无血清培养液、RV 病毒液(1×104TCID50/mL)、脂筏破坏剂MβCD(10 mmol/L)和MβCD+RV液,分别设为对照组、RV 组、MβCD组和MβCD+RV组,各组细胞37 ℃,5%CO2培养箱孵育60 min后进行下列试验。
1.2.3细胞内和细胞表面NHE3蛋白量测定各组细胞加入相应试剂37℃,5%CO2培养箱孵育60 min后,弃去培养基并加入硼酸缓冲液(NHS-SS-biotin),冰上孵育60 min,Quenching 缓冲液清洗后收集细胞,加预冷裂解缓冲液500 μL,1mL注射器针头抽吸裂解10次后旋转裂解30 min,4 ℃,14 000×g离心15 min后,将上清液0.9 mL与链霉抗生物素蛋白-琼脂糖珠混合液于4 ℃孵育3 h。4 ℃低温4000×g离心3 min,清洗后加90 μL loading buffer,煮沸,离心后,将收集到的上清液(细胞膜蛋白成分)60 μL与细胞总裂解液30 μL(细胞总蛋白)进行上样,SDS-PAGE分离、转膜、封闭后,低温4 ℃下抗鼠HA抗体和抗兔GAPDH抗体孵育过夜,清洗后相应荧光二抗孵育2 h,检测并分别计算细胞内和细胞表面NHE3与GAPDH的比值。
1.2.4NHE3生物活性测定在自制带有聚碳酸酯膜的塑料盖玻片膜上以1.2×105cells/cm2的浓度接种 Caco-2细胞,5% CO2,37 ℃培养12 d 后,转染腺病毒HA-NHE3后继续培养48 h,培养液更换为Na+/NH4Cl 溶液(40 mmol/L),加入荧光探针BCECF-AM(10 μmol/L)后,分为对照组、RV 组、MβCD组和MβCD+RV组,各组加入相应试剂孵育60 min后,加入50 μmol/L HOE694,NH4Cl酸化法测定NHE3生物活性[8]。
1.2.5免疫印迹法检测Cdc42蛋白对照组、RV 组、MβCD组和MβCD+RV组分别加入相应试剂孵育60 min后,裂解细胞,Bradford法测定并调节上清液蛋白浓度为1 μg/μL后30 μL点样,SDS-PAGE分离、转膜、封闭后,低温4 ℃下抗兔GAPDH抗体和抗鼠Cdc42抗体孵育过夜,清洗后相应荧光二抗孵育2 h,检测Cdc42和GAPDH蛋白水平并计算Cdc42/GAPDH的比值。
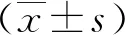
2 结 果
2.1 RV感染对NHE3生物活性的影响与对照组细胞NHE3的生物活性(0.261±0.006)相比,RV组(0.107±0.016)显著降低(P<0.01),而MβCD+RV组(0.243±0.011)和MβCD处理组(0.255±0.012)差异无统计学意义(P=0.214)。
2.2RV对NHE3在细胞内总量及细胞表面蛋白水平的影响生物素化法检测各组细胞,结果发现NHE3蛋白总水平没有显著变化(F=3.056,P=0.092),见图1。与对照组细胞表面NHE3的表达水平(0.600±0.025)对比,RV组(0.274±0.028)显著降低(P<0.01),而MβCD组(0.609±0.015)和MβCD+RV组(0.577±0.014)差异无统计学意义(P=0.220),见图2。

1:对照组;2:RV组;3:MβCD组;4:RV+MβCD组

1:对照组;2:RV组;3:MβCD组;4:RV+MβCD组
2.3RV对细胞Cdc42蛋白水平的影响Western blot法检测发现,与对照组细胞Cdc42蛋白表达水平(0.213±0.009)比较,RV组(0.421±0.020)显著提高(P<0.01),而MβCD+RV组(0.196±0.007)差异无统计学意义(P=0.172),见图3。
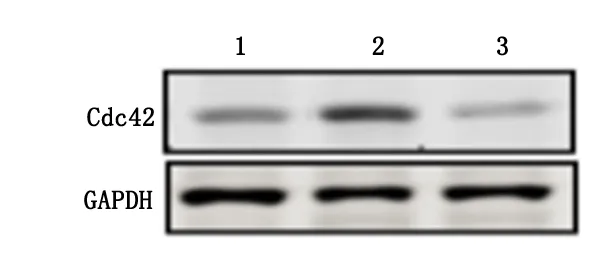
1:对照组;2:RV组;3:RV+MβCD组
3 讨 论
关于RV感染的腹泻机制尚不明确,过去认为主要是由于RV感染破坏小肠黏膜,对上皮细胞造成功能性影响,缩小了吸收面积,最终引起肠道吸收不良;也有人认为RV感染可引起肠道乳糖酶缺乏,从而造成乳糖吸收障碍,与此同时乳糖分解,产物堆积增高肠腔渗透压也是导致腹泻的发生机制之一[9]。然而,进一步通过病理学研究,发现RV感染的病变大多局限于小肠,而此时肠道黏膜无显著变化,炎症症状也不明显[6],因此上诉理论不能解释RV感染早期无肠道病理损害者和未见肠道黏膜损伤者的腹泻症状,因此可能还有其他致泻机制参与RV感染性腹泻的发生。因此进一步深入探索RV感染性腹泻的发生机制至关重要,是寻找更为有效的治疗药物和作用靶点的关键环节。
NHE家族归于SLC9A基因家族,其中NHE3蛋白主要表达于肠道上皮细胞刷状缘膜表面,参与腹泻的发生发展过程[10-11]。在正常消化生理过程和腹泻的病理生理过程中均可发生NHE3蛋白的急性调控。免疫共定位研究发现NHE3蛋白不仅分布于细胞表面,也在细胞内存在,并在细胞内和细胞表面之间进行快速转运,这种特殊的分布特点影响着NHE3蛋白的活性及调节[12]。细胞内吞和/或胞吐作用可调控NHE3蛋白在顶膜和胞内池之间的转运,从而实现调控NHE3蛋白的量及生物活性[13]。基于已有研究的基础上,本研究通过细胞表面NHE3生物素检测发现,虽然RV感染对Caco-2细胞NHE3蛋白总量没有明显影响,但是细胞表面NHE3水平明显下降,与此同时,显著抑制了NHE3的生物活性,此现象提示RV感染不是通过调控基因转录和翻译过程,而是通过调控NHE3蛋白的转运来降低细胞表面NHE3的量及活性。
脂筏是细胞膜中一类特殊的脂质微结构域,富含胆固醇和磷鞘脂,在细胞膜上呈岛状散布,如漂浮在甘油磷脂海洋上的木筏,因此被称为 “脂筏”。 近年来发现脂筏参与了顶膜蛋白定位和上皮细胞的内吞和胞吐作用,与机体内物质的跨细胞运输、胆固醇的运送等多项生理活动密切相关。内吞和胞吐是维持细胞功能的两个重要方面[14]。Clathrin依赖性和Clathrin 非依赖性内吞途径均需脂筏的参与[15]。胆固醇在脂筏的组成中起支架作用,是形成脂筏、保持脂筏结构和功能稳定所必需的。脂筏破坏剂MβCD不影响细胞膜的完整性,但可通过破坏胆固醇而破坏细胞表面的脂筏结构[16],从而抑制脂筏介导的细胞内吞和胞吐作用,已知NHE3的转运调控有50%为脂筏依赖性[5]。为探讨RV感染是否通过脂筏依赖性转运途径调控细胞表面NHE3的量及生物活性,本研究利用MβCD破坏细胞膜脂筏,通过对细胞表面NHE3蛋白检测和Na+-H+交换活性检测,结果发现,MβCD可有效拮抗RV对细胞表面NHE3蛋白的量及活性的抑制甚至恢复至正常水平,这一现象提示RV可通过脂筏依赖性转运途径抑制细胞表面NHE3蛋白的量及活性。在前期研究中,研究组发现与对照组相比,RV感染可以引起细胞表面NHE3的量和生物活性降低,但此抑制作用不能被clathrin的拮抗剂CPZ完全抵消,提示RV感染对NHE3的量及其生物活性的调控与clathrin依赖性内吞途径有一定的关系,但可能还受到其他内吞途径的影响[9]。Cdc42为RhoGTP激酶家族成员,参与CLIC/GEEC内吞途径,既不依赖Caveolae,也不依赖Clathrin,而是脂筏依赖性[14]。在本研究中发现RV感染可以上调Cdc42蛋白水平,推测RV干扰对细胞表面NHE3蛋白的抑制可能与调控Cdc42蛋白介导的内吞途径有关。此外本研究还发现这一作用可被脂筏破坏剂MβCD所拮抗,提示RV 对 NHE3 蛋白的调控机制可能与脂筏依赖性内吞途径有关。综上所述,NHE3蛋白与腹泻症状的发生发展密切相关。RV感染可能通过Cdc42介导的脂筏依赖性内吞通路调控细胞表面NHE3的量及活性,但其他的内吞途径在RV感染对NHE3蛋白调控机制中发挥的作用值得进一步探索,这一研究结果为探索RV感染性腹泻的发生机制提供新理论依据,也为RV感染性腹泻治疗药物的开发提供新的研究思路。