NOD样受体家族蛋白3调控子宫内膜间质细胞催乳素分泌的作用机制
2021-02-25王淑娴马汝钧
张 瑜,程 茜,王淑娴,戈 榭,马汝钧,姚 兵
0 引 言
子宫内膜间质细胞蜕膜化是胚胎植入的关键,有效的蜕膜化是建立和维持正常妊娠的前提,蜕膜化的间质细胞从成纤维细胞转变为上皮样细胞,并分泌蜕膜化标志性激素催乳素(decidual prolactin,dPRL),具有调节滋养细胞侵袭、抵抗炎症和氧化应激以及抑制母体局部免疫反应的独特能力[1],蜕膜的程度和质量对后续滋养细胞的侵袭、胎盘的形成和胎儿宫内生长有着显著影响[2]。
正常妊娠的建立和维持需要子宫内膜中促炎和抗炎介质的动态平衡[3]。在胚胎早期种植中,促炎过程占主导位置。窗口期的子宫内膜在雌孕激素的调控下,发生一系列高炎症反应,子宫内膜定植免疫细胞富集,间质细胞发生间充质-上皮转化(mesenchymal-epithelialtransition, MET)过程,分泌大量炎症因子,包括集落刺激因子-1、IL-8等,这些免疫细胞、炎症介质和炎症因子共同构成子宫内膜的“免疫微环境”,促进蜕膜化的发生,为正常妊娠提供了合适的营养和支持[4-5]。
NOD样受体家族蛋白3(NOD-like receptor protein 3,NLRP3)属于NLRs蛋白家族成员,是重要的细胞内模式识别受体。可通过与CARD结构域的凋亡相关颗粒蛋白(apoptosis-associated speck-like protein,ASC)及含半胱氨酸的天冬氨酸蛋白水解酶1(cysteine protease-1,Caspase-1)组装形成经典炎症小体,促进Caspase-1前体的自我剪切,继而增强细胞因子IL-1β、IL-18的成熟与分泌,而后启动和参与炎症反应的核心环节[6]。利用Thehumanproteinatlas数据库进行搜索,可发现NLRP3的蛋白和mRNA含量在子宫内膜组织中呈现相对较高水平,提示该分子对内膜细胞的调控潜能。但仅发现NLRP3和内膜异位症、子宫内膜炎、产褥感染等疾病的蝇报道[7-9],NLRP3在子宫内膜中的生理性功能研究较少。本研究旨在探讨NLRP3在围种植期子宫内膜的时空表达情况及其对间质细胞蜕膜化过程的影响,为下一步研究子宫内膜容受性及胚胎着床调控机制提供新的思路。
1 资料与方法
1.1 人子宫内膜标本的获取选取2020年4月至6月在东部战区总医院生殖中心20例不孕症患者子宫内膜样本。标本经病理证实为增殖期(10例)或蜕膜期(10例)样本。本研究经东部战区总医院伦理委员会批准(批件号:2020DZGZRZX-089),患者及家属均已签署知情同意书。
1.2实验动物模型的构建及标本的获取实验选用SPF级30只6~8周龄ICR雌鼠和10只雄鼠,购自于北京维通利华实验动物技术有限公司,合格证号为No.201614328。饲养条件:温度(22±2)℃,24 h明暗交替。适应性喂养1周后,按雌雄小鼠2∶1合笼交配,次日检查雌鼠阴道栓,交配后见栓天数(days post coitus, dpc)记为dpc0.5。分笼喂养怀孕雌鼠1~7 d,于当日清晨8点,颈椎脱臼法处死小鼠,解剖出子宫,分别记为dpc0.5、dpc1.5、dpc2.5、dpc3.5、dpc4.5、dpc5.5、dpc6.5和dpc7.5。取其中2~3 cm子宫立即放入4%的多聚甲醛中固定,石蜡包埋,切片以备免疫组织化学使用。其余子宫采用挤压法(用弯曲30°的针头,沿输卵管端向宫颈挤压滑动)取得内膜,获取的子宫内膜组织分别用于后续的qRT-PCR和Western blot实验。
1.3主要试剂RNA提取试剂盒购自于中国BEI-BEI生物公司;PrimeScriptRTmastermix及SYBRRPremixExTaq试剂盒购自于日本TaKaRa公司;RIPA裂解液购自于德国Sigma公司;ECL发光液购自于美国Bioworld公司;PMSF、BCA蛋白浓度测定盒购自于中国碧云天生物技术有限公司;小鼠抗兔NLRP3抗体购自于美国Abcam公司;兔抗小鼠caspase-1抗体购自于美国Novus Biologicals公司;兔抗小鼠β-actin抗体购自于美国Cell Signaling Technology公司;小鼠抗兔、兔抗小鼠二抗均购自于美国invitrogen公司,NLRP3siRNA及阴性对照siRNA由上海吉玛基因生物有限公司合成,LipofectamineTM3000 Transfection Reagent购于赛默飞世尔科技公司,Vidas prolactin kits购于法国bio Merieux公司。
1.4实验方法
1.4.1 免疫组织化学取小段新鲜子宫组织(2~3 cm),4%的多聚甲醛固定,脱水、透明、浸蜡、包埋、切片,脱腊水化,用柠檬酸缓冲液高温修复,TBS缓冲液冲洗。采用3%H2O2阻断内源性过氧化物酶,PBS冲洗,再用10%的山羊血清37 ℃封闭40 min,NLRP3抗体用PBS按1∶100稀释后于4 ℃冰箱孵育过夜。次日复温后,TBS冲洗,室温孵育二抗40 min后滴加DAB显色,苏木精复染后用乙醇溶液脱水,中性树脂封固,镜检。
1.4.2实时荧光定量PCR(qRT-PCR)提取子宫内膜组织的RNA,反转录成cDNA,反应条件为37 ℃15 min,85 ℃5 s。qRT-PCR反应体系为:SYBRGreenMix5 μmol/L,0.5 μmol/L上游引物(10 μmol/L), 0.5 μmol/L下游引物(10 μmol/L),2 μmol/LcDNA产物和2 μmol/LddH2O,循环条件为:95 ℃10 s 酶活化,95 ℃5 s 变性,60 ℃20 s 退火,72 ℃ 30 s延伸,40 个循环。对扩增反应产物进行融解曲线分析。引物设计序列如下:人NLRP3上游5′-GATCTTCGCTGCGATCAACAG-3′,下游5′-CGTGCATTATCTGAACCCCAC-3′;人β-actin上游5′-AGAAGCTGTGCTATGTTGCTC-3′,下游5′-GAGCCTCAGGGCATCGGA-3′;人PRL上游5′-AAGACAAGGAGCAAGCCCAA-3′,下游5′-GCTCCTCAATCTCTACAGCTTT-3′;小鼠NLRP3上游5′-TCTGCACCCGGACTGTAAAC-3′,下游5′-CATTGTTGCCCAGGTTCAGC-3′;小鼠β-actin上游5′-GTTGGAGCAAACATCCCCCA-3′,下游5′-CGCGACCATCCTCCTCTTAG-3′。每个样本重复检验3次。通过2-ΔΔCt方法计算NLRP3和PRLmRNA的相对表达量。
1.4.3Western blot子宫内膜组织加入RIPA裂解液,经组织破碎仪破碎后离心(12 000×g,15 min,4 ℃),收集上清液即为提取到的蛋白,用BCA法测定蛋白浓度。配置8%SDS-PAGE凝胶电泳,100 V恒压电泳,待溴酚蓝刚出胶时,关闭电泳,转移凝胶至PVDF膜上,275 mA转移90 min,后置于5%BSA中室温封闭1 h,按比例稀释一抗(NLRP3 1∶1000、Caspase-1 1∶1000、β-actin 1∶2000)孵育,4 ℃摇床过夜,次日用TBST洗膜,室温孵育对应二抗,TBST洗膜后曝光、显影、定量。采用ImageJ进行灰度值测定分析,计算各组子宫内膜NLRP3蛋白的比值。
1.4.4人工诱导间质细胞蜕膜化T-HESCs(Human endometrial stromal cell) 购自 ATCC (CRL-4003TM)。T-HESCs采用含10%的碳吸附胎牛血清无酚红的 DMEM/F12 培养基(D2906,Sigma)于95% 湿度、37 ℃、5% CO2的培养箱中培养。待T-HESCs生长到50%~70%汇合度时,换成 2% 碳吸附胎牛血清培养基,培养基中加入1 μmol/L对羟基苯甲酸甲酯(methylparaben, MPA) 和 0.5 mmol/L 8-溴-环腺苷酸(8-Br-cAMP)以构建体外蜕膜化模型[10]。48 h后在显微镜下观察到增大的圆形细胞,然后收集细胞及其培养液,通过qRT-PCR测定细胞中PRL mRNA的表达,证实体外人工诱导蜕膜化模型构建成功。
1.4.5细胞转染待T-HESCs生长到50%~70%汇合度时,按照转染试剂说明书,使用Opti-MEMTM培养基分别稀释转染试剂LipofectamineTM3000 Transfection Reagent(混合液A)和50 nmol/L NLRP3siRNA(5′-GGAGAGACCUUUAUGAGAAT-3′)和阴性对照siRNA,(5′-UUCUCCGAACGUGUCACGUTT-3′)(混合液B),混合液A和B按1∶1体积充分混匀,室温孵育10~15 min后分别滴入细胞培养液中,轻摇混匀后放入培养箱。在转染后6 h,用或不用1 μmol/L MPA 和 0.5 mmol/L 8-Br-cAMP 处理,siNC作为对照组。48 h后收集细胞用于分析 NLRP3的表达,收集细胞培养液。
1.4.6细胞培养液中dPRL的测定取人工诱导T-HESCs蜕膜化的各组细胞培养液,1000 r/min离心5 min后去除细胞碎片,收集上清。采用Vidas prolactin kits(Mini-Vidas)酶联免疫法检测细胞培养液中dPRL。
2 结 果
2.1 NLRP3在人子宫内膜不同时期的表达情况免疫组化结果显示,在蜕膜期人子宫内膜中,可见大量NLRP3阳性细胞,细胞质棕黄色深染,主要在子宫内膜蜕膜化的间质细胞及上皮细胞中;且较增殖期子宫内膜,蜕膜期NLRP3的表达量显著上升,见图1。Western blot结果所示,人蜕膜期子宫内膜较增殖期NLRP3显著高表达,见图2。
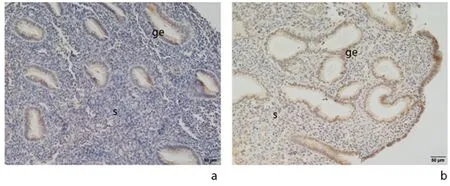
a:增殖期;b:蜕膜期 s:间质;ge:腺上皮
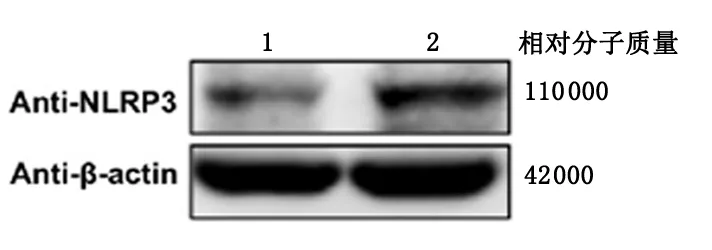
1:增殖期;2:蜕膜期
2.2NLRP3在小鼠妊娠早期子宫内膜中的表达情况免疫组化结果所示,NLRP3在小鼠妊娠早期上调,dpc 3.5天表达最高,可见大量NLRP3阳性细胞表达,细胞质棕黄色深染,而后下降,见图3。Western blot结果所示,在小鼠妊娠早期,随着妊娠时间增加,NLRP3表达量先上升后下降,dpc 3.5天达到峰值,与 dpc 0.5天和dpc 7.5天比较差异有统计学意义(P<0.01),见图4。
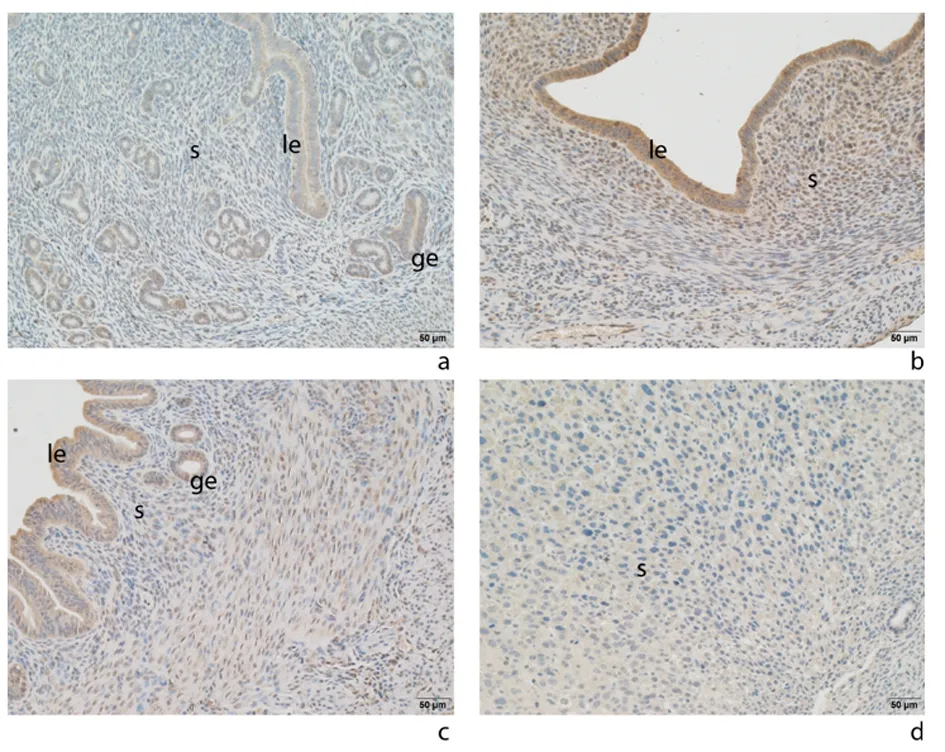
a-d:分别为小鼠交配后见栓0.5、1.5、3.5、7.5 d子宫内膜 s:间质;ge:腺上皮;le:腔上皮 图示dpc 3.5天NLRP3表达最高
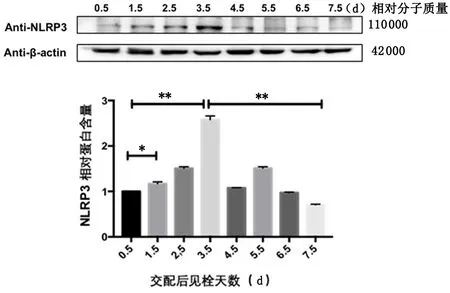
*P<0.05,**P<0.01
2.3干扰NLRP3表达对蜕膜化的影响转染siNLRP3后NLRP3 mRNA水平较siNC下调65%。siNLRP3的PRL表达量较siNC明显下降(P<0.01),见图5。
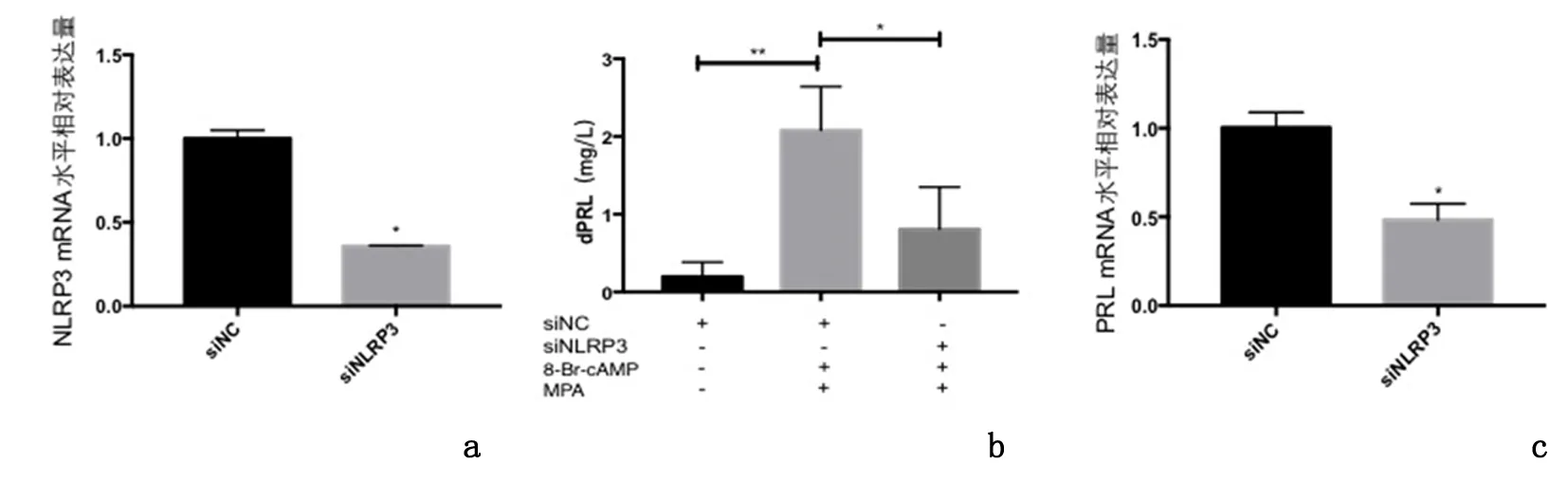
a:qRT-PCR检测siNLRP3干扰效率;b:各组细胞培养液上清中dPRL;c:qRT-PCR检测细胞PRL mRNA水平相对表达量
2.4NLRP3在间质细胞蜕膜化过程中的表达水平Western blot结果所示,随着诱导人间质细胞蜕膜化时间延长,NLRP3及caspase-1表达量显著升高。与12 h NLRP3、caspase-1蛋白表达量(1.76±0.04、1.28±0.02)比较,0 h(1.00±0.01、0.98±0.01)明显降低,24 h(2.26±0.03、1.95±0.05)明显升高(P<0.05)。见图6。
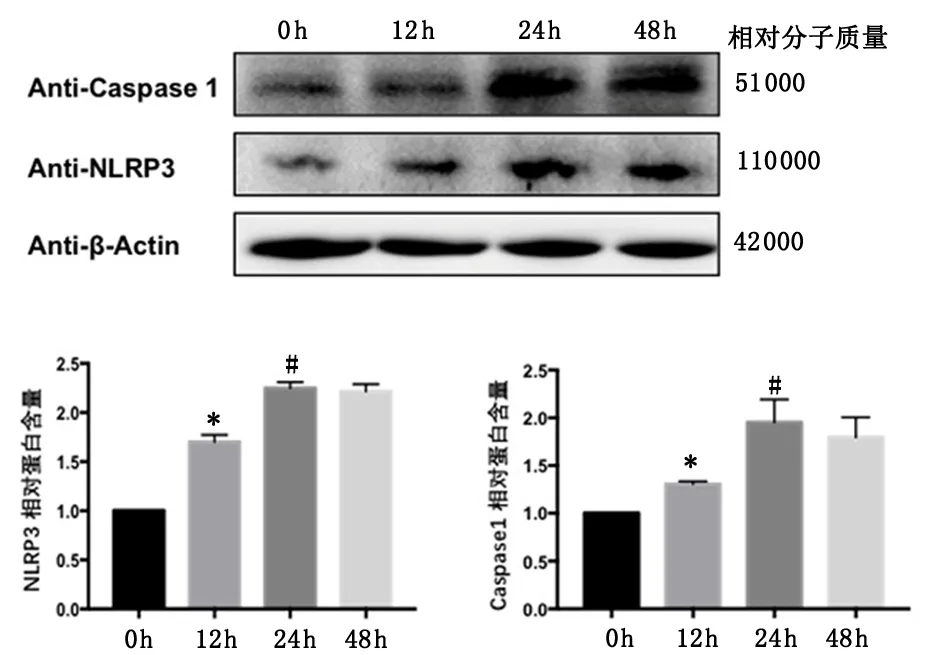
与0 h比较,*P<0.01; 与12 h比较,#P<0.05
3 讨 论
子宫内膜容受性对于建立和维持妊娠十分重要。为了使子宫内膜变得易于接受,间质细胞必须分化为能够分泌胚胎存活和胎盘发育所需要因子的蜕膜细胞,该过程称之为间质细胞蜕膜化[11]。蜕膜化是一个复杂的生理过程,受到多因素的调控,包括激素、细胞因子、炎症因子等。他们之间复杂的相互作用促进了蜕膜化的过程,间质细胞获得上皮样特征,如扩增的细胞质和粗面内质网,更大的分泌能力,连接蛋白的表达增加,以增加细胞间通讯,为胚胎植入及其生长发育创造了有利环境[2]。子宫内膜间质细胞蜕膜化决定了子宫内膜对胚胎信号的响应,在胚胎生物信号传感、选择和植入过程都发挥了至关重要的功能[12]。在生殖组织中,类固醇(如孕酮和雌二醇)和局部细胞信号分子(如细胞因子)具有免疫功能。 在一些研究中,已报告雌二醇-17β和孕酮分别在多个器官中具有促炎和抗炎功能[13]。近年来,子宫内膜炎症和免疫反应在胚胎植入中的作用逐渐被人们所探讨,越来越多的证据表明炎症的平衡在调节蜕膜化中的重要性。
NLRP3属于NLRs蛋白家族成员,一旦激活,会招募衔接子和Caspase-1组装到炎症小体上,然后通过活化Caspase-1对细胞因子IL-1β前体和IL-18前体进行剪切,使之形成成熟体并分泌到细胞外发挥炎症反应功能。已有文献报道,与可育女性相比,RIF患者的子宫内膜样本显示NLRP3明显减少,这表明可能与植入问题有关[14]。本课题组首次系统性研究NLRP3在人子宫内膜中的表达,发现人蜕膜期内膜NLRP3的蛋白较增殖期显著升高。我们对内膜组织进行免疫组化染色,定位NLRP3的潜在功能细胞。读片显示:在人蜕膜期的子宫内膜组织中,间质细胞的NLRP3染色均呈现上升趋势。为了研究NLRP3在围种植期的潜在作用,本研究利用小鼠妊娠模型,检测其妊娠早期子宫内膜中NLRP3的表达情况,发现NLRP3蛋白在dpc0.5~2.5主要表达于子宫内膜腔上皮及腺上皮,dpc3.5子宫间质细胞中NLRP3表达量增加,dpc4.5~7.5 NLRP3主要表达于蜕膜化的间质细胞中,且表达量随妊娠天数增加逐渐上升。NLRP3蛋白在小鼠子宫内膜两种细胞的表达总量在胚胎种植窗口期(dpc3.5)达到高峰(P<0.05),而后逐渐下降。我们推测,NLRP3在小鼠妊娠早期于子宫内膜上皮细胞的表达,可能上皮细胞发生上皮间质转化过程相关。子宫内膜腔上皮细胞是胚胎着床过程的第一道屏障,随着胚胎接触子宫内膜的过程,上皮细胞屏障被破坏,伴随着结构和功能的变化,并且会分泌特异性蛋白来调节子宫内膜间质细胞的蜕膜化过程。因此,在某种因子的介导下,NLRP3的表达定位由上皮细胞逐渐趋向于发生蜕膜化的间质细胞中。
类固醇介导的蜕膜作用可以平衡母胎界面的促炎和抗炎反应[15],为了探究NLRP3在子宫内膜间质细胞中的表达是否具有意义,因此本研究通过8-Br-cAMP和MPA联合诱导构建体外蜕膜化模型,在短时间内诱导T-HESCs蜕膜化[10],以探究NLRP3是否受雌孕激素诱导并参与间质细胞蜕膜化过程。人体子宫内膜中,间质细胞蜕膜化相关的形态表现大约出现在排卵后9 d[16]。本研究发现了蜕膜化的T-HESCs的上皮样改变,并且在蜕膜化的过程中NLRP3表达上调。上述研究提示,炎症小体NLRP3参与在正常妊娠的蜕膜化过程中。为了进一步探讨NLRP3是否在间质细胞蜕膜化过程发挥作用,本研究利用NLRP3siRNA转染T-HESCs,然后联合8-Br-cAMP和MPA诱导其体外蜕膜化,结果表明干扰NLRP3明显降低了蜕膜化标志物PRLmRNA的表达和PRL蛋白的分泌。以上结果提示NLRP3受雌孕激素调控,参与子宫内膜间质细胞蜕膜化过程。
在胚胎早期种植中,促炎过程占主导地位,子宫内膜发生MET过程中,分泌大量炎症因子。免疫细胞、炎症介质和炎症因子共同构成的子宫内膜“免疫微环境”,不但促进蜕膜化发生,还为胚胎种植提供种植土壤。当胚胎着床后,滋养层细胞将突破子宫内膜上皮细胞和间质细胞的屏障,相应植入部位的子宫内膜组织要发生修复和重塑,类似于“损伤/愈合”,局部将发生剧烈的TH1型免疫反应,白血病抑制因子LIF,白细胞介素IL-6/8,单核细胞趋化蛋白-1以及肿瘤坏死因子-α等参与此过程,从而进一步促进胚胎粘附/血管发生,有利于妊娠事件的发生[17]。而在妊娠的中期,抗炎因子过程占主导地位,防止母体对胎儿的排斥,维持平衡妊娠。妊娠后期,促炎过程又占据主导,胎盘、血管一过性分泌大量促炎因子,促进子宫收缩,利于分娩胎儿。
NLRP3在胚胎-母体界面具有双重作用,母体子宫内膜中的持续血管生成需要IL18,但是IL18的过表达可能有助于增加自然杀伤细胞的局部募集和活化,从而导致种植失败[18]。因此我们猜测,NLRP3在早期妊娠阶段,子宫内膜中的表达定位及水平的异常可能与异常的细胞因子IL1β、IL18等影响血管生成和组织重塑有关,从而影响间质细胞蜕膜化过程中催乳素的表达。NLRP3在子宫内膜“窗口期”的高表达,提示 NLRP3触发的炎症通路能为提高子宫内膜容受性提供新的治疗靶点。
综上所述,截止投稿,本研究首次发现并证实了NLRP3可促进间质细胞蜕膜化过程中dPRL的表达和分泌,为研究NLRP3在子宫内膜围种植期调控间质细胞蜕膜化奠定基础,为下一步研究子宫内膜容受性及胚胎着床调控机制提供新的思路。