心肌梗死后室间隔穿孔患者预后及介入治疗效果分析
2021-02-25蒋亚鹏孙子瑞陈同峰刘煜昊
蒋亚鹏,孙子瑞,陈同峰,刘煜昊,韩 艳,韩 宇
0 引 言
心肌梗死后室间隔穿孔(post-infarction ventricular septal rupture,PIVSR)是急性心肌梗死(acute myocardial infarction,AMI)的一种少见但致死性并发症。单用药物治疗患者1个月内病死率为94%,传统认为外科手术修补是唯一的治疗方法[1]。近年来随着介入技术发展,介入封堵也成为一种新的治疗措施。在急性期穿孔附近的心肌出现水肿、变薄、易碎等特征;且坏死组织周围无瘢痕形成,立即行封堵治疗容易造成穿孔进一步增大进而导致循环崩溃、封堵器脱落等事件[2]。研究证实,2~3周可使穿孔部位附近的心肌机化形成瘢痕组织,从而获得更佳的效果[3-4]。本文回顾性分析PIVSR患者临床特点、预后及介入治疗对预后的影响,以期为该病的诊疗提供参考。
1 资料与方法
1.1 研究对象回顾性分析2013年1月1日至2019年12月31日在河南省人民医院及阜外华中心血管病医院112例诊断PIVSR患者的临床资料。其中,男50例、女62例,年龄47~94岁,平均(68.5±9.1)岁。AMI诊断符合2016年中华医学会心血管病学分会制定的《急性冠脉综合征急诊快速诊疗指南》关于非ST段高型心肌梗死的诊断标准[5]或2019年中华医学会心血管病学分会制定的《急性ST段抬高型心肌梗死诊断和治疗指南(2019)》关于ST段抬高型心肌梗死的诊断标准[6]。VSR诊断主要依据超声心动图:室间隔可见连续性回声中断,彩色多普勒可见室水平左向右的分流信号。排除标准:①行介入封堵治疗,但手术未成功患者;②行外科修补手术。根据短期内(2周)是否存活将患者分为短期死亡组(n=42)及短期存活组(n=70)。依据进一步治疗方法对短期存活患者分为保守治疗组(n=19)及介入封堵治疗组(n=51)。
1.2观察指标
1.2.1 一般资料记录患者年龄、性别,既往高血压、糖尿病、冠心病、脑梗死等疾病病史,吸烟史、饮酒史,包括心室率、呼吸频率、收缩压、舒张压及平均压等在内入院基本生命体征,心电图,有无心原性休克[符合2019年中华医学会心血管病学分会制定的《急性ST段抬高型心肌梗死诊断和治疗指南(2019)》关于心原性休克的定义][7]。穿孔前再灌注治疗包括溶栓及经皮冠状动脉支架植入术(percutaneous coronary intervention,PCI),且溶栓及介入治疗均在心肌梗死后24h内完成。再灌注治疗后罪犯血管均达到前向血流TIMI Ⅲ级。
1.2.2超声心动图及化验室指标室间隔穿孔部位及穿孔直径大小、左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左心室射血分数(left ventricular ejection fraction,LVEF)、NT-proBNP等。
1.3治疗情况对于所有患者均给予AMI及心衰的规范化治疗,包括阿司匹林、替格瑞洛(或氯吡格雷)抗血小板治疗,抗凝,控制心室率,抑制心肌重构,降脂,并应用利尿剂、必要的血管活性药物及辅助机械设备。急性期内未行再灌注治疗患者若情况耐受于心肌梗死后7~10 d行冠状动脉造影术及经皮冠状动脉支架植入术。对于短期存活的患者根据其及家属意见进一步选择继续保守治疗或经皮介入封堵治疗。两组患者均行严格的药物治疗及应用必要的辅助机械设备。本研究中所有介入封堵手术均于穿孔2周后完成。
2 结 果
2.1 短期死亡组与短期存活组比较112例患者中,42(37.5%)例患者2周内死亡,其中6例死于脑梗死、1例死于消化道出血、1例死于脓毒血症、14例死于恶性心律失常、20例死于心力衰竭。与存活组相比,死亡组患者年龄、LVEDD、肺动脉收缩压、血肌酐峰值、NT-proBNP峰值、CRP峰值、MYO峰值、入院时的心率与呼吸频率、穿孔直径值更大,心尖部穿孔、前壁心肌梗死、应用人工肾脏替代治疗(continuous renal replacement therapy,CRRT)及呼吸机、合并心源性休克比例更高,穿孔前行再灌注治疗、合并室壁瘤比例更低,入院时的舒张压与平均压、LVEF值更小,差异均有统计学意义(P<0.05),见表1。存活组与死亡组患者在病变血管数量、罪犯血管类型及再灌注治疗方式方面差异无统计学意义(P>0.05),见表2。
2.2短期死亡影响因素的Logsitic回归分析Logsitic回归分析结果显示,短期死亡的危险因素为年龄、入院时心率快、心尖部穿孔;LVEF数值高、合并室壁瘤为短期存活的获益因素(P<0.05)。见表3。
2.3随访期死亡组与存活组比较对短期存活的70例患者随访1年。随访期内28列均死于心脏事件,其中16例死于心力衰竭、12例死于恶性心律失常。与随访期死亡患者相比,存活患者行介入封堵治疗比例更高(P<0.001),余资料差异均无统计学意义(P>0.05)。见表4。
2.4介入治疗与保守治疗比较随访期内:行介入治疗的51例患者中,死亡10例;行保守治疗的19例患者中,死亡18例。Kaplan-Meier生存曲线显示行介入治疗患者的生存预后明显优于行保守治疗患者(P<0.001)。见图1。
2.5随访期死亡危险因素的Cox回归分析多因素Cox回归分析结果显示,随访期死亡的危险因素为穿孔直径;行介入治疗、LVEF数值高为随访期存活的获益因素(P<0.05),见表5;且通过交互作用分析,治疗方式与穿孔直径及LVEF数值间均无交互影响。
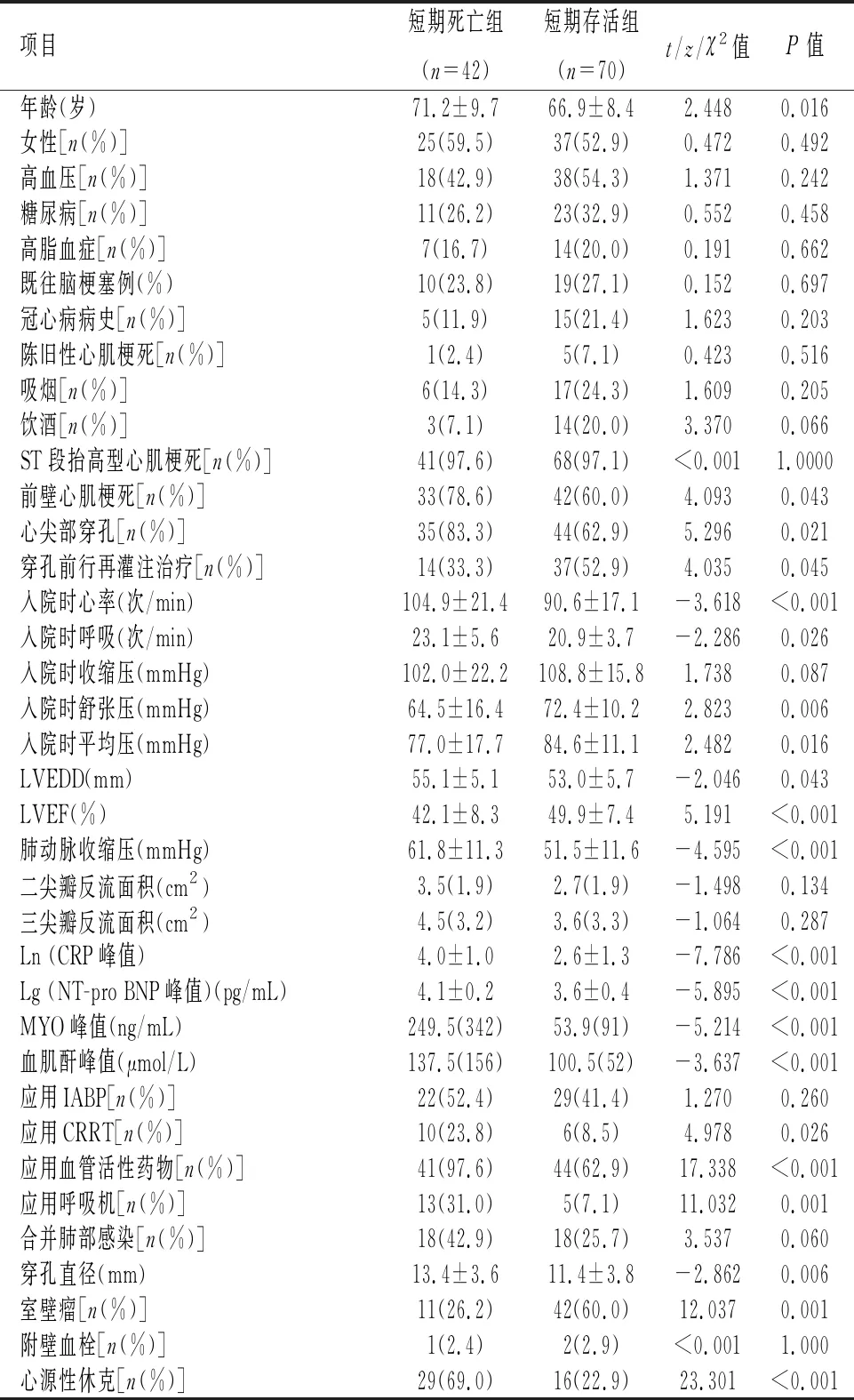
表 1 PIVSR短期死亡组与短期存活组临床资料对比
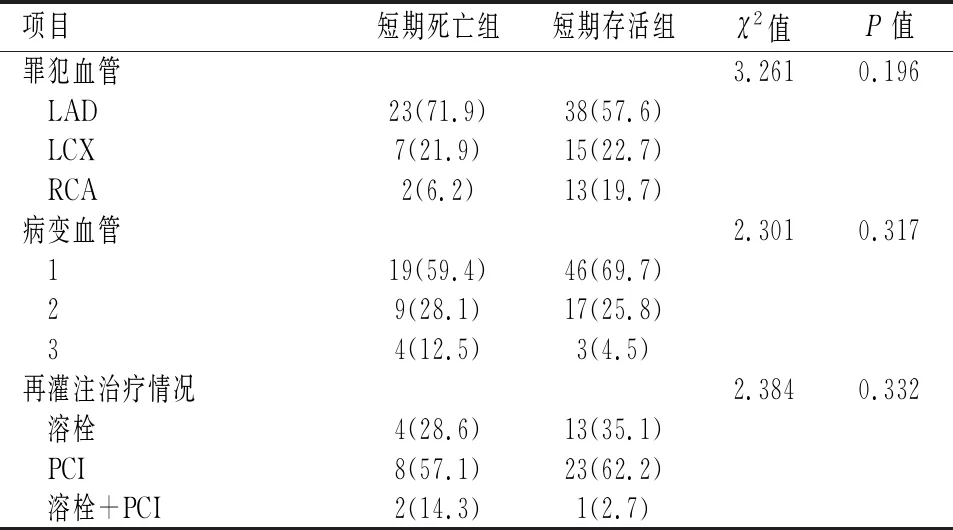
表 2 PIVSR短期死亡组与短期存活组穿孔前再灌注治疗及冠脉造影情况[n(%)]
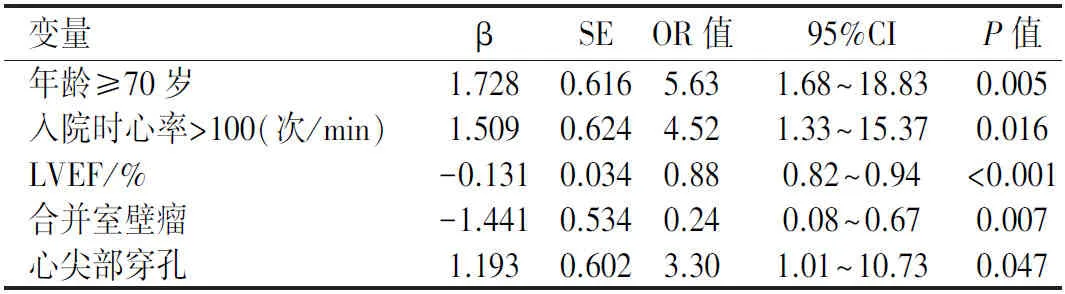
表 3 PIVSR患者短期死亡危险因素的多因素Logistic回归分析
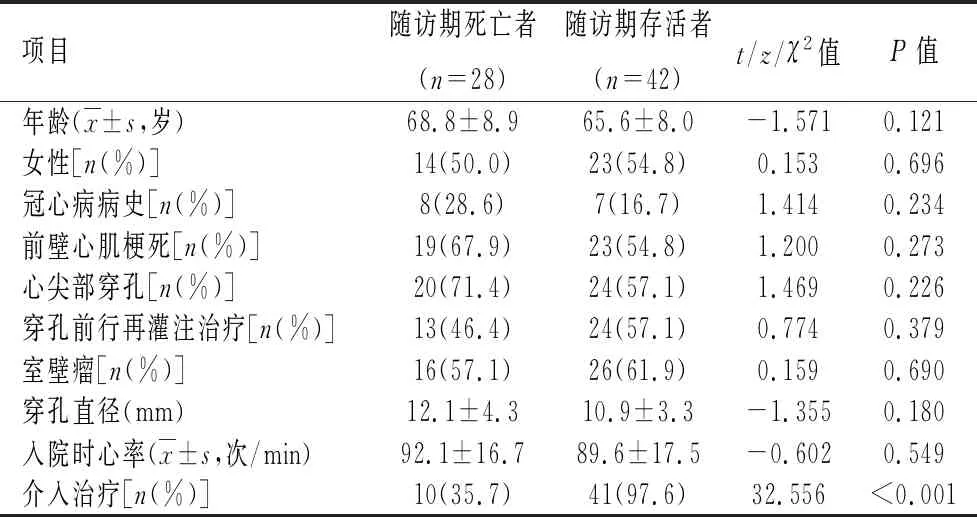
表 4 随访期死亡与存活患者临床指标比较
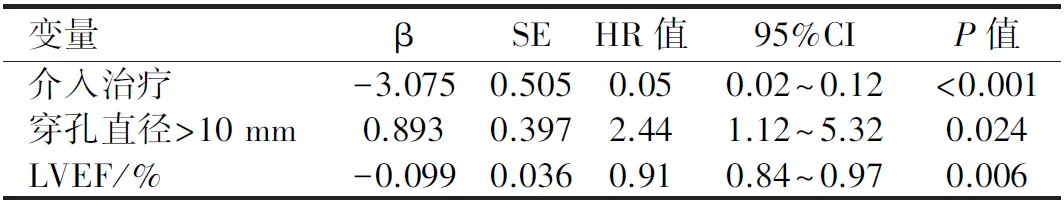
表 5 随访期死亡危险因素的Cox回归分析
3 讨 论
近年来随着PCI技术的普遍开展,PIVSR的发病率降低0.17%~0.31%[7];但患者一旦出现此类并发症仍将会有较差的预后。目前主要治疗方法为外科修补及经皮介入封堵。有文献研究显示两种治疗方式对预后影响无差异[8];但因外科手术修补与介入封堵治疗选择患者标准不一致,外科手术往往更倾向于选择血流动力学更加稳定,一般情况更好的患者,故本研究未将两者进行对比。
虽然所有患者均已给予阿司匹林、氯吡格雷(或替格瑞洛)双联抗血小板治疗及抗凝治疗,短期内死亡患者中,仍有6例直接死于脑梗死,且均未发现房颤及附壁血栓情况。心衰可以激活交感神经系统及肾素-血管紧张素-醛固酮系统出现高凝状态,血小板聚集增加,纤溶功能降低,还可能出现内皮功能障碍、大脑功能紊乱,均为引起缺血性脑卒中的原因[9]。本组患者中共3例出现消化道出血,2例改用氯吡格雷单抗治疗后消化道出血停止,1例为结肠息肉切除术后1d突发急性心肌梗死,给予急诊PCI治疗后发生室间隔穿孔,PCI术后第2天出现消化道出血,完全停用抗凝及抗血小板药物后出血仍不能停止,最终导致死亡。短期死亡组与短期存活组患者相比应用血管活性药物、呼吸机、CRRT比例更高。原因在于此类患者基础情况更差,需要血管活性药物及辅助机械设备应用来维持循环稳定。由于体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)及左心室辅助设备价格较为昂贵本中心未常规应用其治疗PIVSR。本研究中短期存活组与短期死亡组病人应用主动脉球囊反搏(intra-aortic balloon pump,IABP)比例差异无统计学意义。但在本中心另一项通过对心导管数据分析发现IABP可在不影响全身灌注的前提下,降低室间隔穿孔患者的左心室后负荷,从而降低左心室收缩压,减少左向右分流,进一步降低左心室前负荷,改善心功能[10]。对于辅助机械设备的合理应用可以保证患者渡过穿孔急性期,待穿孔附近心肌机化形成瘢痕后行进一步的干预措施以提高预后。
对于PIVSR患者由于每搏输出量的减少,为维持心输出量会代偿的引起心率增快。在心衰急性期,心率增快是一种代偿机制。心率的增快一部分原因是心衰代偿引起的,另一部分原因对于PIVSR患者往往低血压需要血管活性药物来维持血压,这些药物的应用会增快心率。心率不仅是一个生理指标,而且可以反应入院时血流动力学损害的严重程度,在窦性心律的心衰患者中心率超过70次/min将会增加死亡[11]。一项研究表明,心衰患者入院时心率与住院死亡率呈J型关系[12]。急性心肌梗死后坏死的心肌由纤维组织替代可形成室壁瘤,形成室壁瘤的地方心脏丧失收缩能力甚至出现反常运动。在VSR患者中室壁瘤可以使左、右心室间的压差变小,左向右的分流量减少,起到“压力缓冲”作用,减轻血流对缺血心肌进一步损害,从而改善早期预后[13]。虽然早期(2周内)行封堵手术死亡率较高,但对于那些仅行保守治疗早期高死亡风险患者仍需权衡手术[4]。
穿孔直径越大造成心室左向右分流越大,每搏输出量越少;且使右心室负荷越重,特别对于合并右心室梗死的患者,更易出现心原性休克等致死性事件。对于穿孔直径过大的患者,无论行外科手术治疗还是行介入封堵治疗,均会大大增加手术难度,且都更易形成较大的术后残余分流,对长期预后造成影响。
对于PIVSR患者仅行保守治疗预后很差。本研究中所有行保守治疗患者1年的死亡率为98.4%(60/61)。行介入封堵治疗是一项行之有效的治疗措施。本中心共有55例患者尝试行介入封堵治疗,成功51例,手术成功率为92.7%,且手术均在局部麻醉下完成,封堵器均应用“A7B3高10 mm”室间隔穿孔封堵器(上海形状记忆),封堵器直径一般较穿孔直径大10 mm,输送鞘选择14F房间隔缺损封堵输送鞘,封堵方法采用Amplatz法,类似于室间隔缺损封堵方法。本组患者除1例出现术中心脏游离壁破裂,1例出现术后大量二尖瓣反流外,余均无术中及术后并发症(如封堵器脱落、机械性溶血等)发生。术后住院期间病死8例,病死率为15.7%(8/51)。美国胸外科医师学会研究数据显示,1999-2010年间共2876名成人行心肌梗死后室间隔穿孔修补术,手术死亡率为42.9%[14]。介入封堵治疗手术成功率高,术中及术后的并发症少,且行介入封堵治疗患者术后一旦好转出院具有良好的长期预后[15]。另外目前有报道介入封堵的同时利用介入方法治疗其他AMI并发症,如用MitraClip治疗二尖瓣关闭不全[16]。
本研究样本量有限,可能进一步影响结论的外推性。本研究回顾性分析PIVSR临床特点、短期及随访期死亡的危险因素。目前该病的预后仍较差,相较于行保守治疗,行介入封堵治疗可以大大的改善预后。对于AMI患者应早诊断,尽早开通罪犯血管,减少此类并发症发生。一旦出现此类并发症可根据患者具体情况选择合理的治疗措施,并在合适的时机行外科手术或行介入封堵治疗。