酸水解法富集人参细胞稀有皂苷工艺研究
2021-02-25朱义刚申雁冰王敏
朱义刚,申雁冰,王敏
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津300457)
人参(Panax ginseng C.A.mey)为五加科人参属珍贵药用植物,主要分布在我国东北及韩国,人参以其独特的滋补功效及民间悠久的服用历史,被誉为百草之王,闻名中外。据《神农本草经》中记载,人参具有补五脏、安精神、止惊悸、定魂魄、开心、益智、久服轻身延年的功效。现代药理研究结果表明,人参主要的药理活性物质为人参皂苷和人参多糖等[1],其中稀有人参皂苷具有良好的药理活性,尤其是有较强的抗肿瘤活性而受到研究者极大关注。人参皂苷具有多种药理活性,例如人参皂苷可以清除损害细胞的氧自由基并在一定程度上具有抗氧化和抗衰老作用[2],人参总皂苷可以增强5-氟尿嘧啶抗肿瘤的作用疗效[3]。人参皂苷Rg1可以改善记忆力[4]。人参皂苷Rd可以提高免疫系统、保护神经系统和心脑血管系统[5]。人参皂苷Rh2在抑制乳头状瘤、黑色素瘤[6]及子宫内膜瘤[7]等方面具有重要的作用。人参皂苷Rg3可以抑制人肠癌细胞增殖[8]。人参皂苷Rk1可以抑制乳腺癌细胞增殖及诱导阻滞乳腺癌细胞分裂周期,被认为是一种新型、潜在的抗乳腺癌药物[9]。人参皂苷Rg5可以有效抑制癌症转移,来提高治疗效果[10]。可见稀有人参皂苷对多种常见肿瘤有确切的药理活性,但是传统种植人参稀有皂苷的含量极低,通过常规的提取分离手段获得稀有皂苷途径无法满足市场需求,因此通过化学方法或者生物学手段富集稀有人参皂苷成为人参产品开发研究领域的热点。目前主要有酸水解法[11,12]、碱水解法和酶催化法[13],但是碱水解法往往由于条件较难控制、易水解过度,所以较少使用;而酶催化法则由于酶活性不够导致用量较大,成本较高;酸水解法尤其是弱酸水解法是目前较常用的方法,其有酸性温和、产率较高、操作简便、绿色环保及产物可不经分离直接用于功能性食品领域等优势[14]。本研究以人参细胞培养物为起始原料,比较了苹果酸、柠檬酸及谷氨酸等弱酸富集人参细胞稀有皂苷的差异,进一步采用正交试验对谷氨酸水解人参细胞富集稀有皂苷工艺进行优化,以期为规模化生产富含稀有皂苷人参培养物提供理论指导,是潜在的规模化生产富含稀有人参皂苷的新途径,对缓解稀有皂苷供应不足的现状具有重要意义。
1 仪器与材料
1.1 仪器
1200高效液相色谱仪(安捷伦公司);ES-E210B电子分析天平(天津市德安特传感技术有限公司);HH-4恒温水浴锅(常州国华电器有限公司);MJ-78A高压灭菌锅(山东新华医疗);RO DI 1600纯水机(上海和泰仪器有限公司);LGJ-10F冷冻真空干燥机(北京松源华兴科技有限公司)。
1.2 材料
人参细胞培养物(紫外检测含量≥2.0%,厦门鹭港兆康生物科技有限公司);人参皂苷的标准品Re(批号:080023-201802,纯度:≥98%,国药集团化学试剂有限公司);人参皂苷Rg1(批号:080024-201801,纯度:≥98%,国药集团化学试剂有限公司)、人参皂苷Rb1(批号:080021-201802,纯度:≥98%,国药集团化学试剂有限公司)、人参皂苷20(R)-Rg3(批号:080027-201802,纯度:≥98%,国药集团化学试剂有限公司)、人参皂苷20(S)-Rg3(批号:110804-201504,纯度:≥98%,中国食品药品检定研究院)、人参皂苷Rh2(批号:080027-201802,纯度:≥98%,国药集团化学试剂有限公司)、人参皂苷Rg5(批号:04022071-201702,≥98%,上海同田生物技术股分有限公司)、人参皂苷Rk1(批号:13360120-201802,纯度:≥98%,国药集团化学试剂有限公司);柠檬酸、谷氨酸、苹果酸(纯度:≥98%,西陇科学股份有限公司);乙腈(色谱纯,西陇科学股份有限公司);无水甲醇、正丁醇(分析纯,西陇科学股份有限公司)。
2 方法
2.1 苹果酸水解富集稀有皂苷
精密称量7.5g人参细胞培养物,分别加入到不同浓度的苹果酸水溶液中,在60℃水浴锅中搅拌30 min,均匀分散后置于120℃高压灭菌锅中保温20 min,灭菌结束后自然冷却至室温,再经冷冻干燥机冻干,即得较高稀有皂苷含量的人参细胞培养物。
2.2 柠檬酸水解富集稀有皂苷
精密称量7.5g人参细胞培养物,分别加入到不同浓度的柠檬酸水溶液中,在60℃水浴锅中搅拌30 min,均匀分散后置于120℃高压灭菌锅中保温20 min,灭菌结束后自然冷却至室温,再经冷冻干燥机冻干,即得较高稀有皂苷含量的人参细胞培养物。
2.3 谷氨酸水解富集稀有皂苷
精密称量7.5g人参细胞培养物,分别加入到不同浓度的谷氨酸水溶液中,在60℃水浴锅中搅拌30min,均匀分散后置于120℃高压灭菌锅中保温20 min,灭菌结束后自然冷却至室温,再经冷冻干燥机冻干,即得较高稀有皂苷含量的人参细胞培养物。
2.4 正交试验设计
研究以人参细胞培养物为试验材料,选用正交表L9(34)共9组试验,重复5次。正交试验的各因素及水平见表1。按正交表设计中试验组控制谷氨酸水解富集稀有皂苷转化条件。
2.5 人参皂苷含量的测定[15]
2.5.1 标准品溶液的制备分别精密称取人参皂苷Rg1、Re、Rb1、Rh2、20(R)-Rg3、Rk1、20(S)-Rg3、Rg5标准品,加入甲醇溶解制成每1 mL各0.2 mg的混合溶液,摇匀,即得标准品溶液。

表1 L9(34)正交试验因素与水平Table 1 Factors and levels of L9(34)orthogonal test
2.5.2 对照样品1溶液的制备称量人参细胞培养物1 g,用中性滤纸包好,置索氏提取器中,加入适量氯仿回流3 h,弃去氯仿,挥干溶剂,加饱和正丁醇水溶液50 mL,密塞,放置过夜,超声处理30 min,滤过,弃去初滤液,精密量取续滤液25 mL,置蒸发皿中蒸干,残渣加甲醇溶解并转移至5 mL容量瓶中,加甲醇至刻度线,摇匀,过滤,取续滤液即得。
2.5.3 对照样品2溶液的制备称量人参细胞培养物1 g,加入等酸体积的纯化水,在60℃水浴中搅拌30 min,均匀分散后置于120℃高压灭菌锅中保温20 min,灭菌结束后自然冷却至室温,再经冷冻干燥机冻干,收集干品按照2.5.2步骤进行制样,即得。
2.5.4 样品溶液的制备称量人参细胞培养物1 g,经不同酸转化,转化后的人参细胞培养物的样品经冷冻干燥,收集干品按照2.5.2步骤进行制样,即得。
2.5.5 液相色谱条件以十八烷基硅烷键合硅胶为填充剂,以乙腈为流动相A,以超纯水为流动相B,按表2进行梯度洗脱程序,检测波长203 nm。理论塔板数按人参皂苷Rg1峰计算不低于6 000。
2.6 数据分析
所有实验都进行了5次重复。结果为平均值±标准误差(SE)。统计分析采用SPSS 24.0软件进行单因素方差分析。
3 结果
3.1 不同浓度苹果酸对人参皂苷转化的影响
苹果酸是具有重要功能的有机酸[16],是目前世界食品工业中用量最大和发展前景较好的有机酸之一,常作为酸度调节剂来改良食品风味。试验用不同浓度的苹果酸处理人参细胞培养物后,结果如图1所示,随着苹果酸浓度的提高,稀有人参皂苷含量先逐步提高后略微降低;苹果酸较适宜的添加量为0.6 mg mL-1,此时普通皂苷大部分被转化,稀有人参皂苷含量最大。当苹果酸量不足时,例如在0.3 mg mL-1时,有近1/3的普通皂苷未被转化,可见苹果酸的添加量对人参皂苷的转化具有重要作用。适量浓度的苹果酸在高温条件下可以使Re、Rb1等皂苷完全转化为稀有皂苷,该结果与张金秋等报道一致[17]。

图1不同浓度苹果酸对人参皂苷转化的影响Fig.1 Effect of malic acid concentrations on ginsenoside conversion
3.2 不同浓度谷氨酸对人参皂苷转化的影响
如图2所示,不同浓度的谷氨酸处理人参细胞培养物后,随着谷氨酸浓度的提高稀有人参皂苷含量先逐步提高后逐渐降低;谷氨酸较适宜的添加量为2.5 mg mL-1,此时普通皂苷大部分被转化。当谷氨酸量不足时,例如1.25 mg mL-1时,有近1/2的普通皂苷未被转化,可见谷氨酸的添加量对人参皂苷的转化具有重要作用。谷氨酸作为一种酸性氨基酸,其弱酸性水溶液可以有效水解人参皂苷结构中C-20及C-3位糖苷键,进而得到稀有皂苷。
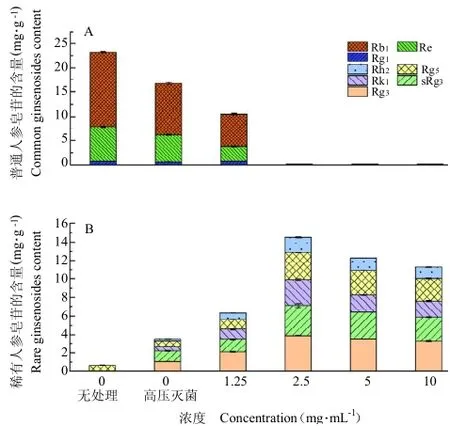
图2不同浓度谷氨酸对人参皂苷转化的影响Fig.2 Effect of glutamate concentrations on ginsenoside conversion
3.3 不同浓度柠檬酸对人参皂苷转化的影响
柠檬酸是常用的食品酸度调节剂,酸度相比盐酸、硫酸的酸性小,可有效避免酸水解过度而影响稀有皂苷得率。柠檬酸水解试验结果如图3所示,不同浓度的柠檬酸处理人参细胞培养物后,普通皂苷含量逐步降低,当柠檬酸较适宜的添加量为0.6 mg mL-1时,普通皂苷大部分被转化;当柠檬酸不足时,例如在0.3 mg mL-1时,有近1/3的普通皂苷未被转化。
3.4 不同种类的酸水解人参细胞富集稀有皂苷
不同种类的酸水解人参细胞富集稀有皂苷的含量及转化率结果见表3。从表3可知,谷氨酸水解人参细胞培养物效果最佳,稀有皂苷含量分别是柠檬酸和苹果酸的1.15倍和1.27倍。柠檬酸和苹果酸常作为食品加工中的酸度调节剂,酸度值较低,谷氨酸是一种酸性氨基酸,呈弱酸性,人参皂苷的多糖结构容易在弱酸环境中被部分或完全水解,可能由于谷氨酸溶液酸度较适宜,不易造成人参皂苷过度水解。因此,谷氨酸相对柠檬酸和苹果酸对人参稀有皂苷的富集量更大。

图3不同浓度柠檬酸对人参皂苷转化的影响Fig.3 Effect of citric acid concentrations on ginsenoside conversion

表3 不同酸种类水解人参细胞富集稀有皂苷的对比Table 3 Comparison of rare saponins enriched by different acid hydrolyzed Panax ginseng cells
3.5 谷氨酸水解富集人参细胞培养物稀有皂苷的正交试验结果
正交试验结果见表4。通过正交法设计的直观分析法可见,谷氨酸水解富集人参细胞培养物稀有皂苷的最优条件A2B2C2,即3种因素的最优组合为水解温度75℃、水解时间120 min、谷氨酸浓度3 mg L-1。通过极差分析可见,影响谷氨酸水解人参细胞富集稀有皂苷的因素的主次影响为C>A>B,即谷氨酸浓度>水解温度>水解时间。经过SPSS24.0软件对正交试验结果进行方差分析,由表5可见C因子(P<0.05)对谷氨酸水解人参细胞富集稀有皂苷影响显著,其他因子对谷氨酸水解人参细胞富集稀有皂苷影响不显著。

表4 L9(34)正交试验方案及结果Table 4 L9(34)orthogonal test and results
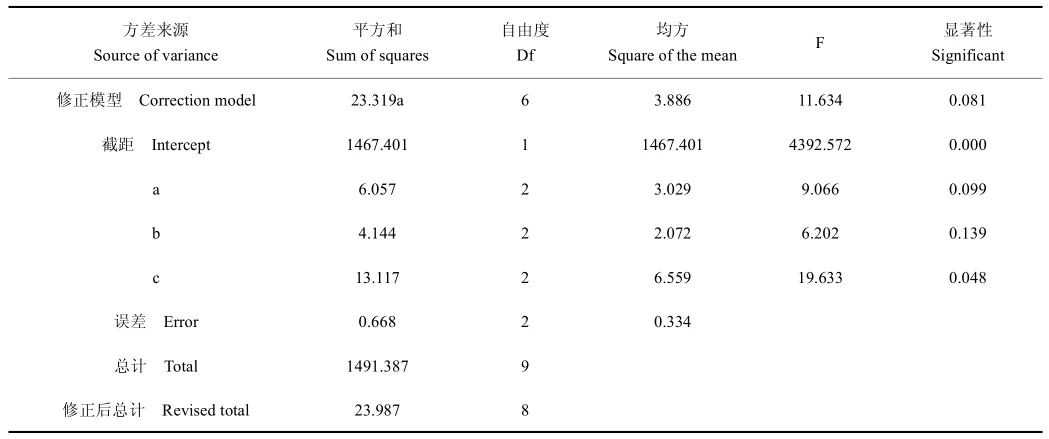
表5 主体间效应检验Table 5 Inter subject effect test
3.6 试验结果的验证
根据正交实验结果,对谷氨酸转化人参细胞培养物富集稀有皂苷的最优组合条件和最佳组合进行3次重复验证,其结果如表6所示,最优组合A2B2C2与正交表最佳组合A2B1C2相比,前者稀有皂苷平均含量是后者的1.05倍。因此综合正交试验与验证试验可以得出结论,谷氨酸水解富集人参细胞培养物稀有皂苷的最佳条件为温度75℃,时间120 min,谷氨酸浓度为3 mg mL-1,人参细胞培养物中稀有皂苷的含量高达16.75 mg g-1。
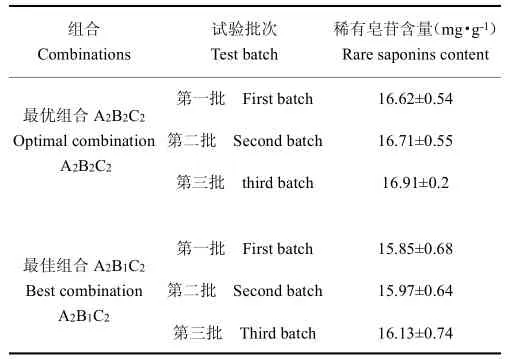
表6 工艺验证试验Table 6 Results of validation experiment
4 讨论与结论
应用植物组织培养技术进行人参的规模化、标准化生产,被认为是解决现有种植人参占用林地、破坏环境问题的潜在可行的途径。近几十年来,日本及韩国先后成功进行了人参组织培养的工业化大生产[18,19]。我国在人参组织培养方面也取得了较大的进步[20]。现代药理学研究发现人参的主要活性物质为人参皂苷,其中稀有皂苷可以抑制多种肿瘤细胞,在抗肿瘤方面表现出良好的应用前景。但是目前市场上的园参、林下参等稀有皂苷的含量极低,满足不了人们对富含稀有皂苷人参制品的需求。本试验选择3种较常用的食品添加剂,并比较其提取人参培养物的富集稀有皂苷量的差异,结果表明谷氨酸富集的稀有皂苷含量相对高,进一步通过正交优化试验,确定最佳的水解条件为温度75℃,时间120 min,谷氨酸浓度为3 mg mL-1,人参细胞培养物中稀有皂苷的含量高达16.75 mg g-1,是市售高丽参稀有皂苷含量的16倍左右。利用谷氨酸水解人参细胞富集稀有皂苷具有工艺简单、操作安全和环境友好等优势。此外,植物组织培养技术结合酸水解法协同作用富集高稀有皂苷含量的人参,可以进一步开发成高端的食品、保健品及药品,展示出广阔的应用前景。
