两株耐铅镉菌株的分离筛选及铅镉去除性能研究
2021-02-23薛林贵武雯雯李明聪王韶梅刘映彤何圆圆
张 璐,薛林贵*,武雯雯,李明聪,王韶梅,刘映彤,何圆圆
(1. 兰州交通大学 化学与生物工程学院,兰州 730070;2. 甘肃省极端环境微生物资源与工程重点实验室,兰州 730070)
随着21世纪工农业的快速发展,重金属污染问题开始受到广泛关注[1].采矿、尾矿堆积、矿业废弃等一系列矿山开采活动形成多种重金属复合污染[2-4]使得土壤质量下降、微生物多样性降低、植被覆盖率也随之下降[5-6].周边的农田土壤也会出现重金属超标的现象[7],甚至重金属会随食物链进入人体,影响人体健康[8].而目前,针对矿山土壤修复多采用物理化学修复、微生物或植物微生物联合修复[9-10],其中微生物和植物微生物联合修复技术,由于其具有方法简便、修复成本低、无二次污染等优点被广泛应用,而筛选出重金属耐受细菌,是进行生物修复的基础和关键.
为了得到对重金属耐受力较强的微生物,并且考虑到后期修复应用过程中微生物对尾矿环境的适应性,一般选择在矿区进行土著微生物的筛选[11].不同种类矿山重金属污染中,经常伴随出现铅镉复合污染[12-14],筛选具有铅镉“双耐性”细菌的研究报道较铅、镉单一耐性菌的研究少,且耐受浓度都不是很高.付瑾等[15]筛选出的皮氏罗尔斯通氏菌,可耐受1 600 mg·L-1的Cd2+.Naranjargal等[16]从金矿中筛选到了芽孢杆菌Z1,对Pb2+的耐受性达到了800 mg·L-1.Abdollahi等[17]分离并鉴定了5种耐药菌株,包括阴沟肠杆菌,科氏肠杆菌,蜡状芽孢杆菌,脓毒根瘤菌和根癌农杆菌,这5种菌可耐受3 500 mg·L-1的铅和100 mg·L-1的镉.黄军等[18]从极度重金属污染的土壤中筛选得到了大肠杆菌LY29-1-5,该菌株可耐受1 500 mg·L-1的镉离子,且对铅也表现出了一定的耐受性.
通过对临泽硫铁矿尾矿采集样本的分析,发现其铅镉含量很高,且可培养微生物数量较多.值得对其中的耐受菌资源展开深入发掘.本研究对临泽硫铁矿尾矿污染土壤中强耐镉离子(Cd2+)、铅离子(Pb2+)的细菌进行分离、筛选和鉴定,并对筛选鉴定的细菌株系的重金属去除性能进行了初步研究,以期为矿山土壤重金属污染的微生物修复工程提供种质资源和基础理论依据.
1 材料与方法
1.1 实验材料
1.1.1 土壤采样
筛菌土壤样本采自甘肃省张掖市临泽县的宏鑫矿业尾矿区,采用五点取样法进行采样,采样深度为0~20 cm,采样尾矿区中心地理位置为东经100°14′49″,北纬39°29′15″,采集的样品充分混合后尽快带回实验室备用.该土壤含铅镉的量如表1所列.

表1 采样土壤含重金属量
1.1.2 试剂与培养基
溶液的配制:铅溶液:Pb(NO3)2;镉溶液:CdCl2.
培养基:牛肉膏蛋白胨培养基(牛肉膏3 g、蛋白胨10 g、NaCl 5 g、水1 000 mL)、LB培养基(胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,水1 000 mL).
1.2 研究方法
1.2.1 菌种筛选
将95 mL装有适量沸石的牛肉膏蛋白胨液体培养基灭菌,称取5 g土样加入其中,加入过滤除菌后的Pb(NO3)2、CdCl2溶液,分别使培养体系Pb2+、Cd2+浓度达到200 mg·L-1,50 mg·L-1,30 ℃、150 r·min-1振荡培养5 d后转接至新的培养基中,此时Pb2+、Cd2+浓度增长至 400 mg·L-1、100 mg·L-1,相同条件继续培养,以此类推,转接第5次后进行平板涂布,划线分离,选择长势较好的菌株保存,进行后续实验.
1.2.2 菌种鉴定
对筛选出的菌株进行平板划线分离,初步观察其菌落形态.对重金属耐受菌提取总DNA,然后进行PCR扩增,扩增结果提交西安擎科泽西生物技术有限公司进行序列测定.
1.2.3 筛选菌种生物学性能研究
向LB培养基添加 Cd2+储备液,使培养液中的 Cd2+终浓度分别为0 mg·L-1,100 mg·L-1,200 mg·L-1,300 mg·L-1,400 mg·L-1和500 mg·L-1;将斜面保存的耐Cd2+菌株在LB培养液中活化至OD600 nm=0.8,以2%接种量接入培养液中,每个浓度设置三组平行,30 ℃、150 r·min-1振荡培养,分别在4 h,8 h,12 h,24 h,48 h取样,测定600 nm处的OD值,观察菌株在不同Cd2+浓度下的生长情况.Pb2+终浓度设置为0 mg·L-1、1 000 mg·L-1、2 000 mg·L-1、3 000 mg·L-1、4 000 mg·L-1,重复上述操作.
1.2.4 筛选菌株对液体中铅镉去除能力的影响因素研究
菌株生长曲线测定:将菌株G-1、G-2分别培养至对数期(OD600 nm=0.8),接入已灭菌的LB培养基中,设置三组平行,30 ℃、150 r·min-1恒温摇床培养,分别于1 h,2 h,4 h,6 h,8 h,10 h,12 h,24 h,48 h,72 h,96 h,120 h和144 h取样,测定OD600 nm的值,绘制生长曲线.
菌株不同生长阶段对铅镉去除效果测定:将菌株G-1、G-2培养至对数期(OD600 nm=0.8),分别接入已灭菌的LB培养基中,体系中Pb2+、Cd2+设置为400 mg·L-1、200 mg·L-1,30 ℃、150 r·min-1恒温摇床培养,于对数期(12 h)、稳定期(48 h)、衰亡期(120 h)分别取样,离心后测定上清液中Pb2+、Cd2+的浓度,计算不同生长阶段两菌株对液体培养基中铅镉的去除率.
菌株去除溶液中Pb2+、Cd2+的最适条件探究:最适温度实验:将驯化后的菌株接入已灭菌的LB培养基中,Pb2+、Cd2+浓度分别为200 mg·L-1、400 mg·L-1,接种量保持为1%,温度梯度设置为25 ℃、28 ℃、30 ℃、32 ℃、35 ℃,设置三组平行,150 r·min-1培养48 h后,离心取上清液测量Pb2+、Cd2+残余,计算重金属去除率.最适pH实验:在最适温度条件下,Pb2+、Cd2+浓度分别为200 mg·L-1、400 mg·L-1,接种量保持为1%,pH梯度设置为5、6、7、8、9,设置三组平行,30 ℃、150 r·min-1培养48 h后,离心取上清液测量Pb2+、Cd2+残余,计算重金属去除率.耐盐性实验:将驯化后的菌株接入已灭菌的LB培养基中(pH=8),铅镉浓度为200 mg·L-1、400 mg·L-1,NaCl浓度梯度为1%、2%、3%、4%、5%,设置三组平行,30 ℃、150 r·min-1培养48 h后离心取上清测量Pb2+、Cd2+残余,计算重金属去除率.最佳接种量实验:将驯化后的菌株接入已灭菌的LB培养基中(pH=8、NaCl %=3),铅镉浓度分别为200 mg·L-1、400 mg·L-1,接种量为1%、2%、3%、4%、5%,设置三组平行,30 ℃、150 r·min-1培养48 h后,离心取上清测量Pb2+、Cd2+残余,计算重金属去除率.
1.2.5 铅镉量的测定
铅镉量采用ICP-MS测定,采用公式(1)计算重金属去除率
(1)
其中:η为去除率;Co表示处理前溶液中重金属浓度;Ce表示处理后溶液中重金属浓度.
1.2.6 数据分析
将两株菌经16S rRNA基因测序后所得序列与NCBI数据库中已有的序列进行BLAST比对分析,通过MEGA 5.0软件制作系统发育树.其余数据用Origin 8.5和SPASS 19.0进行分析.
2 结果与分析
2.1 菌株的筛选
经过对土壤样品的富集培养,以平板涂布和划线分离法进行分离纯化,初步筛选出7株重金属耐受菌株,分别编号为G-1、G-2、G-3、G-4、G-5、G-6、G-7,再经过复筛驯化培养后,在不同铅镉离子浓度下的生长情况如表2所列.由表2可以看出,在铅镉离子浓度分别为2 000 mg·L-1、200 mg·L-1时,7株菌株均可生长,但随着铅镉离子浓度的增加,G-1可在铅镉离子浓度分别为2 000 mg·L-1、200 mg·L-1的培养基中生长,G-2可在铅镉离子浓度分别为2 000 mg·L-1、200 mg·L-1的培养基中生长,两株菌株均表现出了较高的耐受性,其他菌则停止生长.研究结果表明,G-1、G-2为具有较强铅镉耐受能力的优势菌株.
2.2 菌株的鉴定
2.2.1 菌株的形态特征
培养温度为30 ℃,在含有铅镉离子浓度分别为200 mg·L-1、50 mg·L-1的LB培养基上培养24 h后进行革兰氏染色,耐铅镉菌株G-1、G-2的菌落形态如图1所示.G-1菌落表面呈白色,不规则圆形,边缘不齐整,有毛绒状突起,表面较干燥,质地均匀.G-2菌落表面呈淡黄色,形状规则,呈圆形,小而均匀,表面较湿润.革兰氏染色鉴定结果显示菌株G-1、G-2均为革兰氏阴性菌.
2.2.2 16S rRNA分子鉴定
利用PCR扩增16S rRNA基因,对扩增后的序列进行拼接,利用BLAST进行比对,通过MEGA 5.0构建系统发育树,结果见图2.结果显示,G-1与已知分类地位的标准菌株Bacilluswiedmanniistrain ER6(MT124531.1)亲缘关系很近,16S rRNA序列一致性为100%,G-2则与标准菌株Klebsiellapneumoniaestrain 285(GU451217.1)亲缘关系很近,16S rRNA序列一致性为99.86%.因此,G-1菌株被鉴定为Bacilluswiedmannii,G-2菌株被鉴定为Klebsiellapneumoniae.
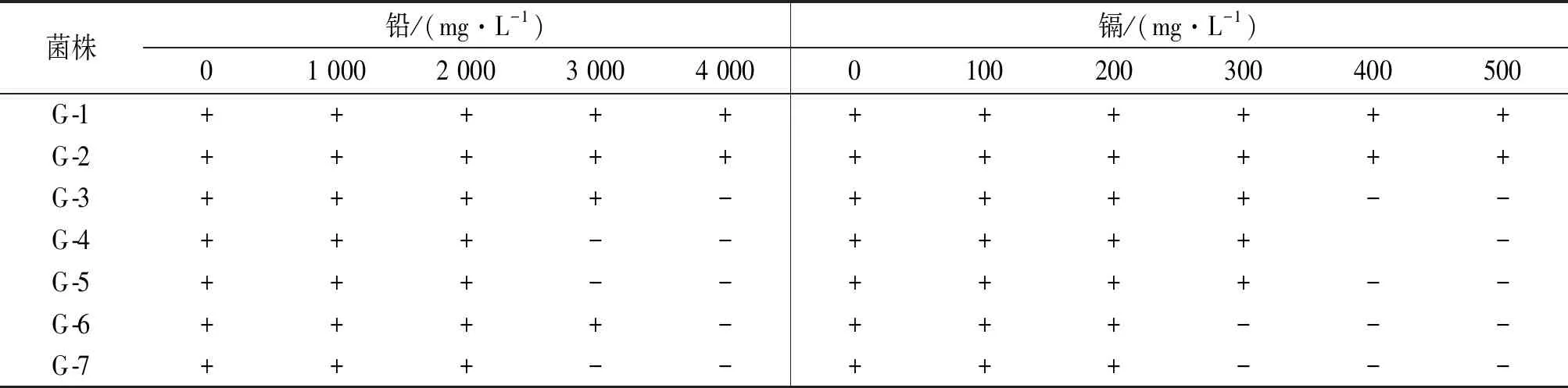
表2 菌株在不同铅镉离子浓度下的生长情况
2.3 重金属耐受菌株生物学性能研究
菌株G-1、G-2在不同镉离子浓度下的生长情况分别如图3所示,两株菌对镉离子的耐受浓度都达到了500 mg·L-1,随着隔离子浓度的升高,两株菌的生长开始逐渐受到抑制,在400 mg·L-1的浓度下,G-1、G-2都能较好的生长,浓度达到500 mg·L-1时,其生长明显受到抑制,此时G-1的生长情况略好于G-2,说明G-1对镉的耐受性高于G-2.两株菌在不同铅离子浓度下的生长情况分别如图4所示,两株菌对镉离子的耐受浓度均达到了4 000 mg·L-1,随着铅离子浓度的升高,两株菌的生长开始逐渐受到抑制,在4 000 mg·L-1的浓度下,G-1、G-2都能较好的生长,抑制作用不太明显,此时G-2的生长情况略好于G-1,说明G-2对铅的耐受性高于G-1.
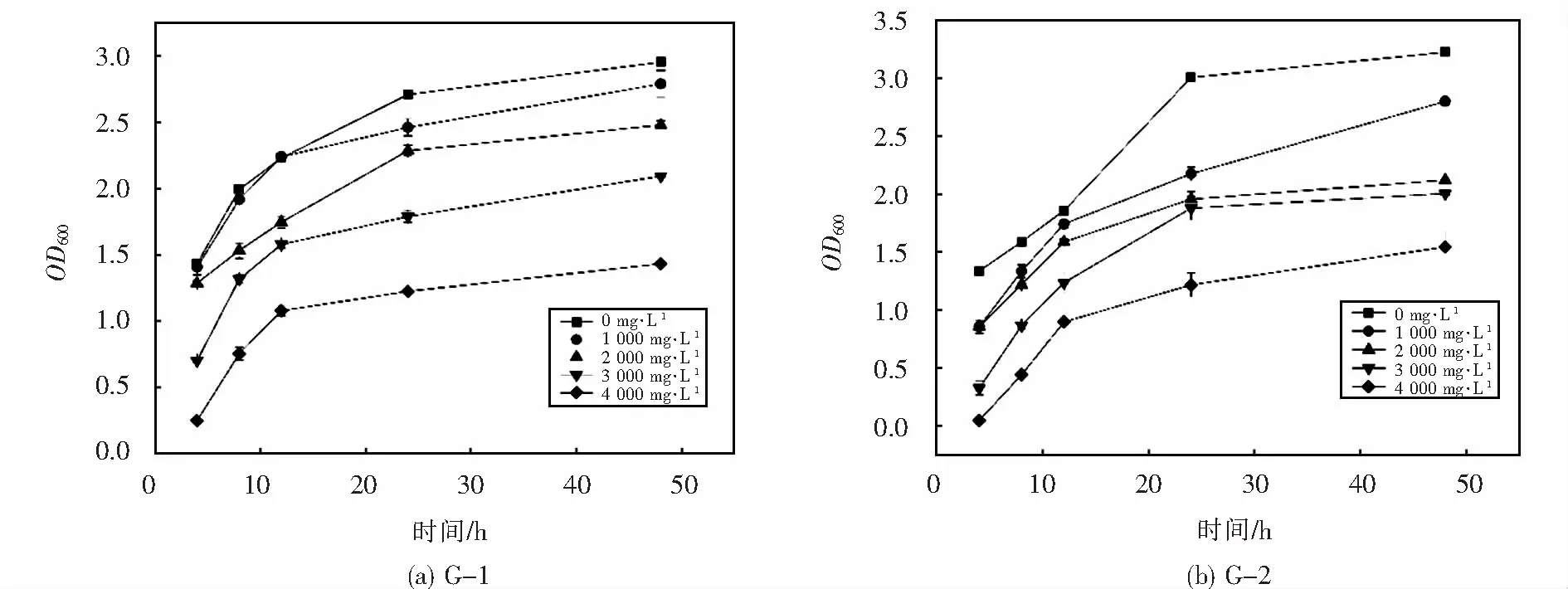
图4 菌株在不同Pb2+浓度下的生长情况Fig.4 The growth of strains at different Pb2+ concentrations
2.4 菌株对液体中铅镉去除能力的影响因素研究
2.4.1 菌株G-1、G-2的生长曲线及其不同生长阶段对Pb2+、Cd2+的去除能力
菌株G-1、G-2的生长曲线及其不同生长阶段对Pb2+、Cd2+的去除能力如图5所示.根据图5(a)可知菌株G-1和G-2在LB培养基中生长,延滞期均不明显,0~20 h期间经历了对数期,生长迅速,20 h之后均进入稳定期,菌株G-1在120 h时进入衰亡期,G-2则在80 h时较G-1提早进入衰亡期.菌株在不同生长阶段对液体中的Pb2+、Cd2+的去除效果如图5(b)所示,两株菌在48 h时对液体中Pb2+、Cd2+的去除率最高,菌株G-1对Cd2+去除率为81.97%,高于G-2,菌株G-2则对Pb2+显示出更好的去除效果,去除率达到了98.96%,此时菌株正处于稳定期.因此,依据图5研究结果,培养48 h的菌悬液用于水体和土壤的重金属污染修复处理能够获得很好的修复效果.
2.4.2 温度对菌株Pb2+、Cd2+去除效果的影响
菌株G-1与G-2在不同温度下对铅镉离子的去除率如图6所示,由图6(a)可以看出,G-1菌株在不同温度下对Cd2+的去除率都大于等于57%,在32 ℃时,对Cd2+的去除率最高,达到了71.34%,对Pb2+的去除率均大于等于63%,在32 ℃时则达到了最高89.22%.由图6(b)可以看出G-2菌株在不同温度下对Cd2+的去除率都大于等于49%,在32 ℃时,对Cd2+的去除率最高,达到了62.19%,对Pb2+的去除率均大于等于80%,在30 ℃时达到了93.21%.对比G-1、G-2在32 ℃时对Pb2+、Cd2+的去除率可以看出,G-1对镉离子的去除能力强于G-2,G-2对Pb2+的去除率则明显高于G-1.且相较于Pb2+去除效果,两株菌去除Cd2+的效果受温度的影响稍大一点.
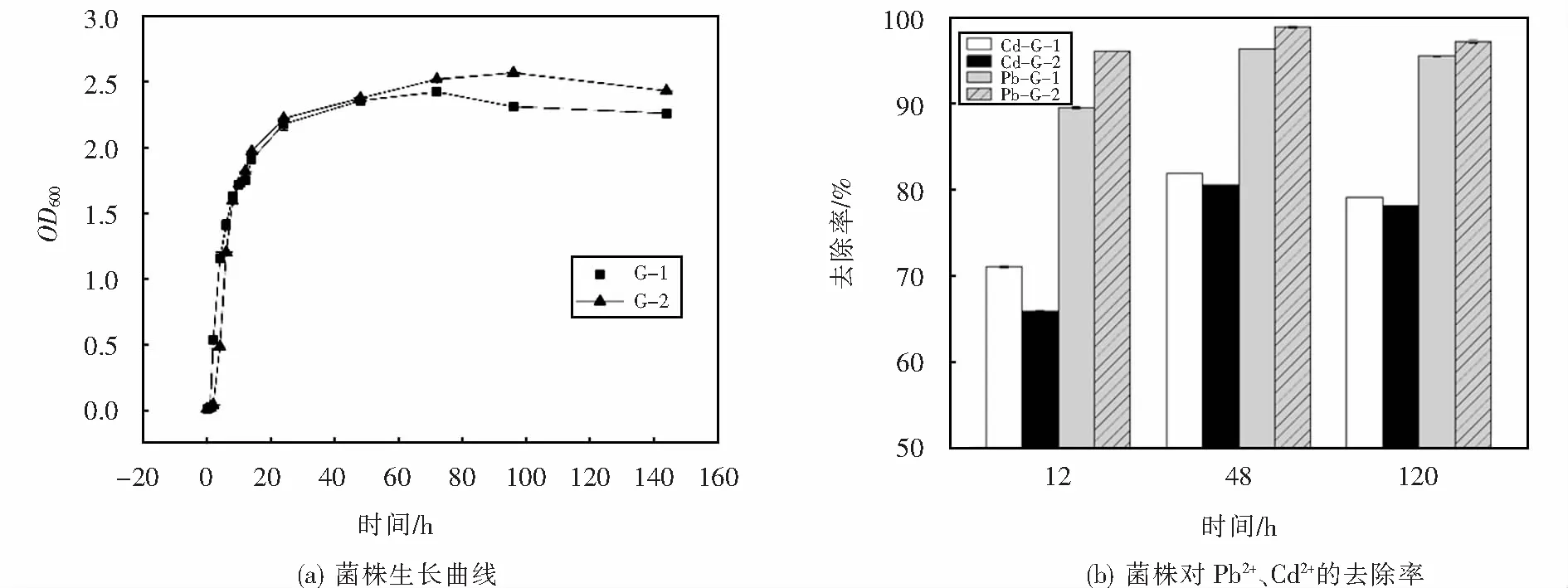
图5 菌株生长曲线和不同生长阶段菌株对Pb2+、Cd2+的去除率Fig.5 Growth curve of the strains and the removal rate of lead and cadmium by strains at different growth stages
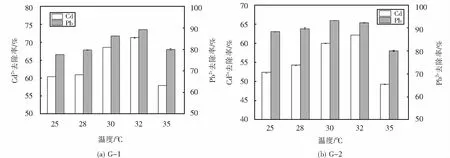
图6 温度对菌株去除Pb2+、Cd2+的影响Fig.6 Effect of temperature on the removal of Pb2+ and Cd2+ by strains
2.4.3 pH值对菌株Pb2+、Cd2+去除效果的影响
菌株G-1与G-2在不同pH下对铅镉离子的去除率如图7所示,由图7(a)可以看出,G-1菌株在不同pH下对Cd2+的去除率均大于等于60%,G-1菌株对Cd2+的去除率在pH值为5~8时随pH的增加而增加,在pH等于8时最高,达到了76.94%.pH大于7时菌株对Cd2+的去除率则有所下降,推测可能是因为pH大于7 时,菌株的生长受到一定的抑制,从而影响了去除效果.G-1对Pb2+的去除率也是随pH的增加先增加,在pH等于7时达到了最大,随着pH的进一步增大,Pb2+去除率也有所下降.在中性偏酸性条件下菌株G-1的Pb2+、Cd2+去除率高于偏碱性条件下的去除率,由图7(b)可以看出G-2菌株对Cd2+、Pb2+的去除率在pH等于5时均最低,随着pH值的增加而增加,均在pH等于8时达到了最大,分别是63.93%、99.34%,随后随着pH的继续增加开始出现下降的趋势.相较于Pb2+去除效果,菌株G-2对Cd2+的去除效果随pH的变化呈现了更为明显的变化.
2.4.4 盐浓度对菌株Pb2+、Cd2+去除效果的影响
菌株G-1与G-2在不同盐浓度下对铅镉离子的去除率如图8所示,由图8(a)可以看出,菌株G-1在不同NaCl浓度下对铅镉离子均具有一定的去除效果,G-1菌株对镉离子的去除率随着NaCl浓度的增加而增加,在NaCl浓度达到3%时最高,达到了78.89%.随着NaCl浓度的继续升高,菌株对镉离子的去除率开始出现明显下降.相较于镉离子,G-1菌株对铅离子的去除效果受NaCl浓度变化影响较小,也是在NaCl浓度为3%时达到最高,去除率为91.96%,随着NaCl浓度的进一步增大,铅去除率也有所下降.由图8(b)可以看出G-2菌株对铅镉离子的去除率在NaCl浓度达到3%时均达到最高,分别为65.20%、98.35%.在不同NaCl浓度下,菌株G-2对铅镉离子的去除率变化均不超过5%,且在NaCl浓度为3%时均达到最高,盐浓度的变化对其铅离子去除效果的影响并不显著,说明菌株具有一定的耐盐能力.
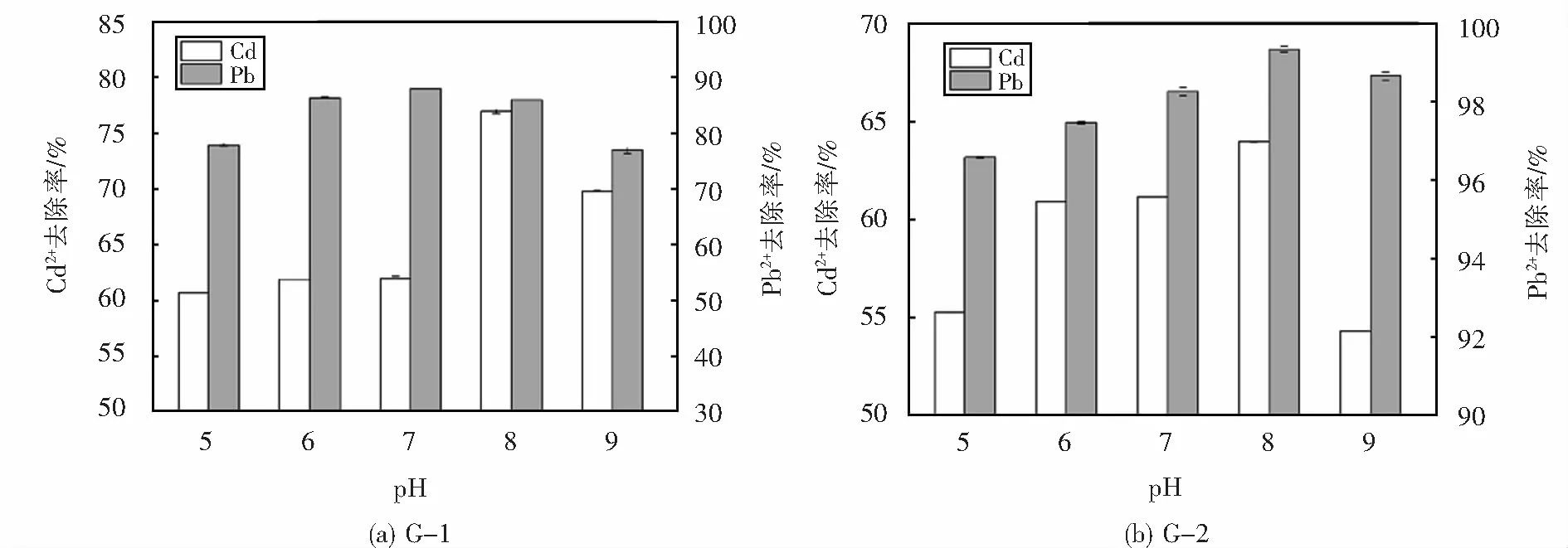
图7 pH对菌株去除Pb2+、Cd2+的影响Fig.7 Effect of pH on the removal of Pb2+ and Cd2+ by strains
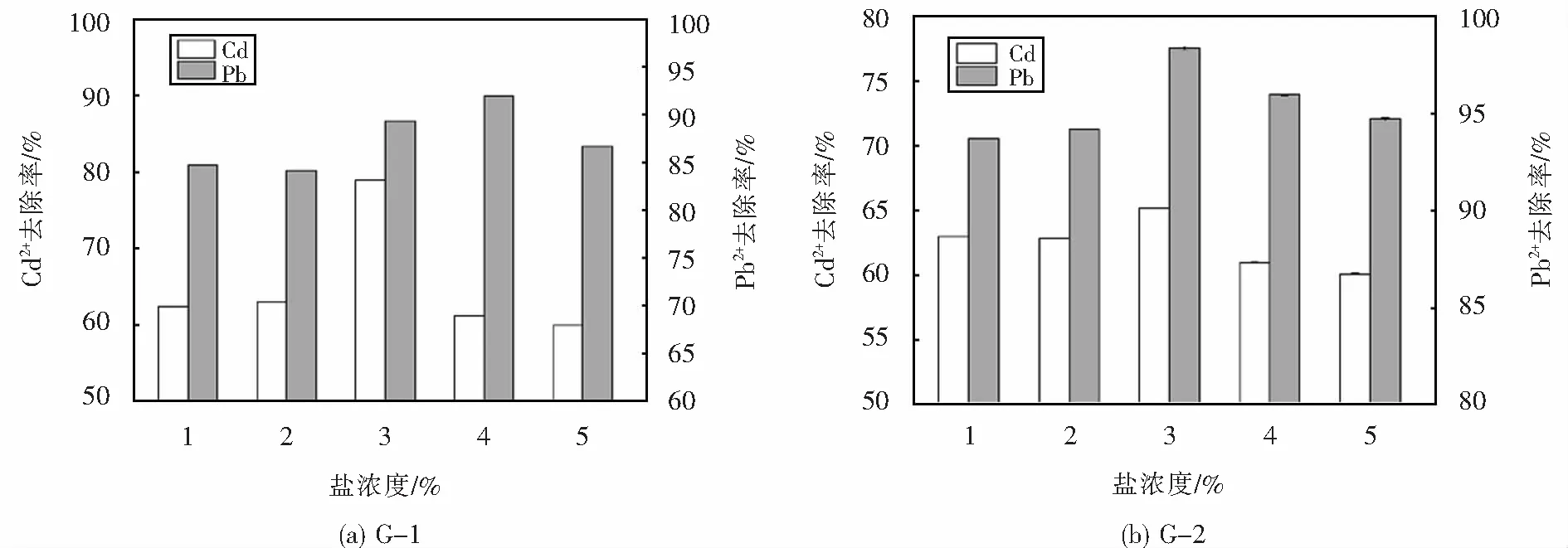
图8 盐浓度对菌株去除Pb2+、Cd2+的影响Fig.8 Effect of the NaCl concentration on the removal of Pb2+ and Cd2+ by strains
2.4.5 接种量对菌株Pb2+、Cd2+去除效果的影响
菌株G-1与G-2在不同接种量下对铅镉离子的去除率如图9所示,由图9(a)可以看出,菌株G-1在不同接种量下对铅镉离子均具有一定的去除效果,G-1菌株对镉离子的去除率先是随着接种量的增加而增加,在接种量等于2%时达到了80.66%.随着接种量的继续升高,去除率则开始下降,可能是因为接种量过大,细胞消耗营养快且多,生长后劲不足.菌株G-2对铅离子的去除率均达到了80%以上,在接种量2%时去除效果最好,去除率达到了91.32%.由图9(b)可以看出相较于镉离子,G-2菌株对铅离子的去除效果受接种量变化影响较小,G-2菌对铅离子的去除率均高于96%,呈现出了较高的铅离子去除效果,在接种量为2%时,对铅离子的去除率高达99.44%.
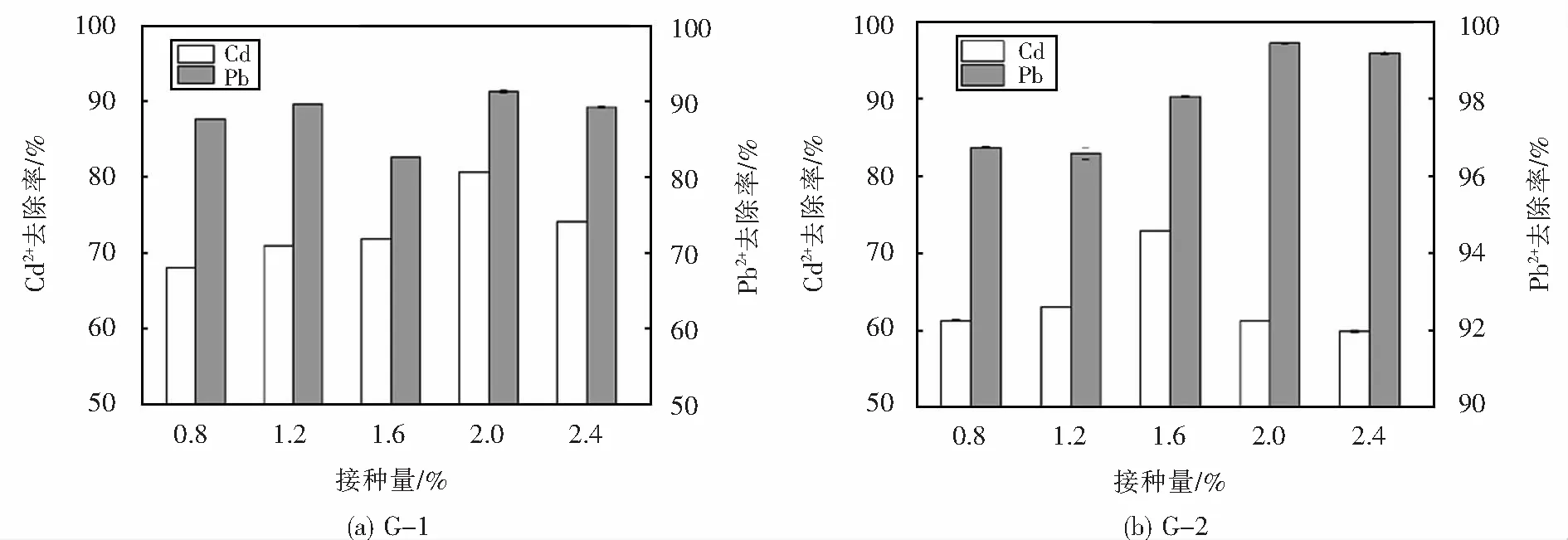
图9 接种量对菌株去除Pb2+、Cd2+的影响Fig.9 Effect of the inoculation amount on the removal of Pb2+ and Cd2+ by strains
3 结论
本研究从重金属污染的铁矿尾矿土壤中分离筛选到了7株细菌,可分别耐受2 000 mg·L-1、200 mg·L-1的铅镉,通过进一步的驯化后菌株G-1、G-2显示出更高的耐受性,能在铅、镉离子浓度分别为4 000 mg·L-1、400 mg·L-1的条件下较好的生长,菌株G-1能分别在4 000 mg·L-1、500 mg·L-1的铅镉离子浓度下缓慢生长.经分子生物学鉴定,G-1为芽孢杆菌属 (Bacillussp.),G-2为克雷伯菌(Klebsiellasp.).菌株G-1在pH为7、32 ℃、NaCl浓度4%、接种量为2%的情况下,对液体中铅镉的去除率达到最大,分别为91.32%、80.66%.菌株G-2则在pH为8、30 ℃、NaCl浓度4%、接种量为2%的情况下,对液体中铅镉的去除率达到最大,分别是99.44%、72.89%,且菌株G-1的镉离子去除效果强于G-2,而G-2则对铅的去除效果强于G-1.
