miR-145-5p靶向TPM3通过ERK信号通路抑制甲状腺癌TPC-1细胞侵袭和转移
2021-02-22兰天刘巍梦邹阳邱平
兰天,刘巍梦,邹阳,邱平
·论著·
miR-145-5p靶向TPM3通过ERK信号通路抑制甲状腺癌TPC-1细胞侵袭和转移
兰天,刘巍梦,邹阳,邱平
610500 成都医学院第一附属医院内分泌代谢科(兰天、邱平);617023 四川,攀枝花市第六人民医院妇科(刘巍梦);400700 重庆市第九人民医院内科(邹阳)
探讨 miR-145-5p 对甲状腺癌细胞侵袭和转移的影响。将miR-145-5p mimic 质粒、mimic-NC 质粒、TPM3 质粒分别或联合转入甲状腺癌细胞,RT-qPCR 检测 miR-145-5p 与 TPM3 mRNA 的表达,双荧光素酶报告检测靶向关系,Transwell 法检测细胞侵袭能力,划痕实验检测细胞迁移能力,Western blot 检测 ERK1/2 和 p-ERK1/2 的表达;采用裸鼠右后肢腹侧皮下注射构建甲状腺癌移植瘤模型,测定移植瘤体积和重量,免疫组化检测 Vimentin 的表达,Western blot 检测 TPM3、ERK1/2 和 p-ERK1/2 的表达。miR-145-5p 在甲状腺癌细胞中低表达,miR-145-5p 靶向抑制 TPM3 表达;miR-145-5p 过表达能够明显降低甲状腺癌细胞的侵袭数目和伤口愈合率,并下调 p-ERK 表达,而 TPM3 过表达和 ERK 通路激活剂均可以逆转这些现象;miR-145-5p 过表达会使体内移植瘤的重量和体积明显减少,并使移植瘤的 Vimentin 阳性细胞比率明显减少,TPM3 和 p-ERK1/2 蛋白表达明显下调。miR-145-5p 靶向 TPM3 通过 ERK 信号通路抑制甲状腺癌细胞侵袭和转移。
miR-145-5p; 甲状腺癌; 原肌球蛋白 3; ERK; 侵袭; 迁移
甲状腺癌是最常见的内分泌肿瘤,在女性肿瘤发病率中高居第五位,发病率呈逐年上升趋势,全世界每年近 4 万人死于甲状腺癌[1]。虽然大多数患者预后良好,10 年生存率约为 90%,但有相当比例的患者在 10 年内出现局部复发或远处转移[2]。因此,在甲状腺癌的发生、发展过程中寻找新的分子靶点是迫切需要的。miR-145 被认为是一种肿瘤抑制因子,在多种癌症细胞中均表现为下调,如结肠癌、乳腺癌、前列腺癌等,已有研究表明其在甲状腺癌细胞中也表现为下调[3]。原肌球蛋白(TPMs)是一系列存在于骨骼肌、平滑肌和一些非肌肉组织中的肌动蛋白结合蛋白[4]。在骨骼肌中,TPMs 介导肌动蛋白对钙离子的反应,并参与细胞骨架微丝的稳定[5]。已有研究表明,非肌肉性 TPMs 可能参与了癌症的发展。TPM1 作为一种肿瘤抑制因子,在抑制肿瘤发展中发挥作用[6]。而 TPM3是一种重要的致癌基因,已被报道参与造血肿瘤、黑色素瘤、胶质瘤等肿瘤的迁移和侵袭[7-8]。本文主要探讨 miR-145-5p 对甲状腺癌细胞侵袭和转移的影响。
1 材料与方法
1.1 主要材料
DMEM 培养基购自上海善然生物科技有限公司;胎牛血清购自素尔生物科技有限公司;miR-145-5p mimic 质粒、mimic-NC 质粒、TPM3 质粒及各引物均由上海基因制药有限公司设计并合成;Lipofectamine2000转染试剂购自上海恪敏生物科技有限公司;QIAzol 裂解试剂购自北京鸿跃创新科技有限公司;cDNA 逆转录试剂盒购自上海捷瑞生物工程有限公司;双荧光素酶报告基因检测试剂盒购自北京原平皓生物技术有限公司;SYBR-Green PCR 试剂盒购自赛默飞世尔科技公司;RIPA 裂解缓冲液购自南京海克尔生物科技有限公司;BCA 试剂盒购自上海易色医疗科技有限公司;TPM3 抗体和 p-ERK1/2 抗体购自上海钰博生物科技有限公司;ERK1/2 抗体和 Vimentin 抗体购自碧云天生物科技有限公司;12-O-14 烷酰醇-13-乙酸酯(TPA)购自上海伟寰生物科技有限公司;裸鼠购自四川夏派森医药科技有限公司,许可证:SYXK(川)2017-203。
1.2 方法
1.2.1 细胞及其培养 正常甲状腺细胞系 Nthy-ori3-1和 BC-PAP、K1、TPC-1人甲状腺癌细胞系均购自 ATCC,于含 10% 胎牛血清的 DMEM 培养基中培养,在 37 ℃、5% CO2孵育箱保存。
1.2.2 分组及处理 将 TPC-1 细胞分为对照组、mimic-NC 组、miR-145-5p mimic 组、TPM3 组、TPM3 + miR-145-5p mimic 组,研究 miR-145-5p 对甲状腺癌细胞的影响。mimic-NC 组、miR-145-5p mimic 组、TPM3 组、TPM3 + miR-145-5p mimic 组细胞在对数期时,接种于 6 孔板(1 × 106个/孔)。当达到 80% 融合,根据 Lipofectamine2000说明书将 100 nmol/L miR-145-5p mimic 质粒、mimic-NC 质粒、TPM3 质粒分别或联合转染进入 TPC-1 细胞。将 TPC-1 细胞分为对照组、miR-145-5p mimic 组、TPA 组、miR-145-5p mimic + TPA 组,研究 miR-145-5p 对甲状腺癌细胞的作用通路。miR-145-5p mimic 组:根据 Lipofectamine2000说明书将 miR-145-5p mimic 质粒转染至TPC-1 细胞处理 6 h;TPA 组:50 μmol/L TPA 处理细胞 6 h;miR-145-5p mimic + TPA 组:根据 Lipofectamine2000说明书将 miR-145-5p mimic 质粒用 50 μmol/L TPA 处理细胞 6 h。
1.2.3 RT-qPCR 检测 miR-145-5p 与 TPM3 mRNA 的表达 采用 QIAzol 裂解试剂提取总RNA,采用 cDNA 逆转录试剂盒合成 cDNA。RT-qPCR 采用 SYBR-Green PCR 试剂盒说明书操作进行。GAPDH 作为 mRNA 的内参,使用 2-ΔΔct法计算。miR-145-5p 的上游引物序列:5' GTCCAG TTTTCCCAGGAAT 3';miR-145-5p 的下游引物序列:5' TGGTGTCGTGGAGTCG 3'。TPM3 的上游引物序列:5' GCGGGAAGTGGAGGGAGAAA 3';TPM3 的下游引物序列:5' TAGACTCTGCCAGCT CGGCG 3'。GAPDH 的上游引物序列:5' ACAACTTT GGTATCGTGGAAGG 3';GAPDH 的下游引物序列:5' GCCATCACGCCACAGTTTC 3'。
1.2.4 双荧光素酶报告检测靶向关系 收集生长至对数期的 TPC-1 细胞,铺于 96 孔板,每孔约4 × 103个细胞,24 h 后,分别转染mimic-NC + TPM3 WT、mimic-NC + TPM3 MUT、miR-145-5pmimic + TPM3 WT、miR-145-5p mimic + TPM3 MUT,根据双荧光素酶报告基因试剂盒说明进行测定,用萤火虫荧光素酶活性和肾荧光素酶活性比值表示荧光素酶的相对活性。
1.2.5 Transwell 法检测细胞侵袭能力 培养 48 h后,将细胞消化成单细胞悬液(5 × 104个/ml)。在 Transwell 小室上室用 Matrigel 包被,下室加入含有 10% 胎牛血清的 DMEM 细胞培养液 1 ml。孵育 24 h 后,除去膜上层细胞,将通过膜侵袭的细胞固定染色,在显微镜下观察。侵入细胞数表示为每视野的平均细胞数。
1.2.6 划痕实验检测细胞迁移能力 将各组 TPC-1 细胞消化铺满单层后用小号枪头垂直划痕,加入无血清培养基,在5% CO2、37 ℃恒温的培养箱培养24 h 后,分别在显微镜下拍照,用 Image J 软件分析。
1.2.7 Western blot 检测 TPM3、ERK1/2 和 p-ERK1/2 的表达 用 RIPA 裂解液提取各组 TPC-1 细胞总蛋白,并用 BCA 试剂盒检测总蛋白浓度,然后经 SDS-PAGE 分离蛋白后,用半干转膜仪转移蛋白质至 PVDF 膜,并用脱脂牛奶室温封闭蛋白 2 h,再加入一抗(TPM3:1:400;ERK1/2:1:1000;p-ERK1/2:1:200)在 4 ℃封闭过夜,接着加入对应二抗室温封闭 1 h,最后滴 ECL 曝光。
1.2.8 移植瘤实验 将裸鼠随机分为 TPC-1 组和 miR-145-5p mimic 组,每组 10 只,雌雄各半。在各组裸鼠右后肢腹侧皮下分别注射 0.2 ml TPC-1 细胞和转染 miR-145-5p mimic 的 TPC-1 细胞悬液。然后,继续在无特定病原(SPF)条件下正常饮食饲养,观察裸鼠皮下成瘤情况,测定移植瘤体积。第 30 天颈椎脱位法处死裸鼠,完整取出皮下移植瘤,电子天平称重,Western blot 检测 TPM3、ERK1/2 和 p-ERK1/2 的表达。
1.2.9 免疫组化检测 Vimentin的表达 经常规 10% 中性甲醛溶液固定,石蜡包埋切片,脱蜡水化过氧化物酶阻断内源性过氧化物酶活性,非免疫性动物血清阻断非特异性反应。再分别加入鼠抗人 Vimentin抗体(1:100),4 ℃过夜。滴加生物素标记二抗,DAB 显色,蒸馏水冲洗,苏木素复染,梯度酒精脱水,二甲苯透明。最后,封片观察统计。免疫组化阳性细胞其细胞核有棕色颗粒沉着,显微镜下随机选取 5 个视野,每个视野阳性率 = 阳性细胞数/总细胞数 × 100%。
1.3 统计学处理
2 结果
2.1 miR-145-5p 在甲状腺癌细胞中下调
RT-qPCR 检测正常甲状腺细胞系 Nthy-ori3-1 和 BC-PAP、K1、TPC-1 等 3 个甲状腺癌细胞中 miR-145-5p 的表达发现,与正常甲状腺细胞系 Nthy-ori3-1 相比,BC-PAP、K1、TPC-1 等 3 个甲状腺癌细胞中miR-145-5p mRNA 的表达明显下调(< 0.01),且以TPC-1 下调最显著(图 1),故选择甲状腺癌细胞系 TPC-1 作为后续实验研究对象。
2.2 miR-145-5p 靶向抑制 TPM3 表达
根据 TargetScan 数据库的预测,TPM3 3'UTR 区与 miR-145-5p 存在结合位点(图2A)。为了进一步验证 miR-145-5p 直接作用于 TPM3,进行了荧光素酶报告基因实验,结果如图 2B 所示。miR-145-5p 高表达明显抑制了含有野生型 TPM3 质粒的荧光素酶活性,但对突变型 TPM3 质粒的荧光素酶活性无影响(< 0.01)。为了进一步证实转染效果,RT-qPCR 检测各组细胞 TPM3 mRNA 的表达,结果如图 2C 所示,与 control 组细胞相比,mimic-NC 组细胞中 TPM3 mRNA 的表达无明显变化,miR-145-5p mimic 组细胞中TPM3 mRNA 表达明显下调(< 0.01),TPM3 组细胞中 TPM3 mRNA 表达明显上调(< 0.01);与 miR-145-5p mimic 组相比,TPM3 + miR-145-5p mimic 组细胞中 TPM3 mRNA 表达明显上调(< 0.01)。因此,miR-145-5p 直接靶向抑制 TPM3。
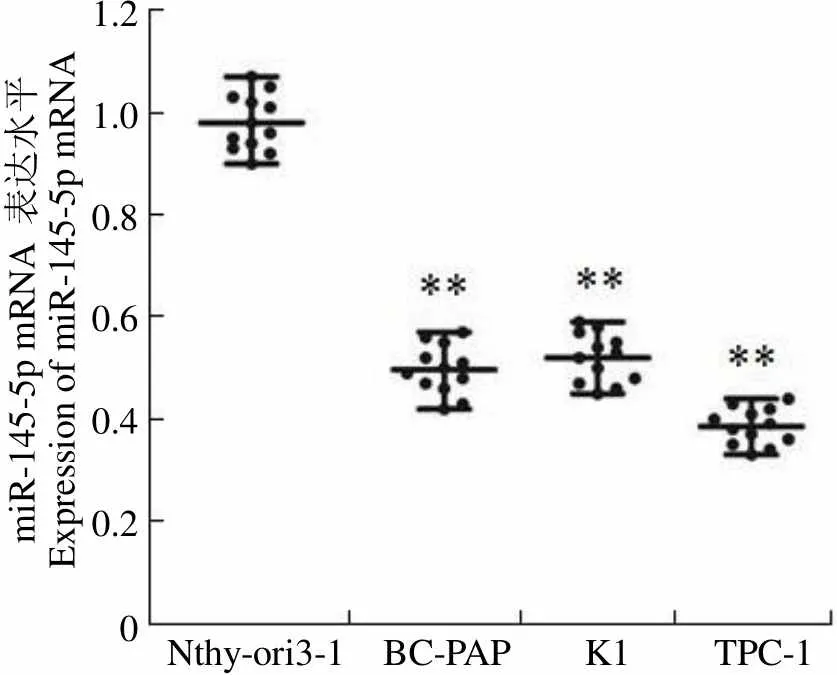
miR-145-5p mRNA 表达水平Expression of miR-145-5p mRNA1.2 1.0 0.8 0.6 0.4 0.2 0 Nthy-ori3-1 BC-PAP K1 TPC-1
Figure 1 Expression of miR-145-5p in each group of cells was detected by RT-qPCR (**< 0.01 vs Nthy-ori3-1)
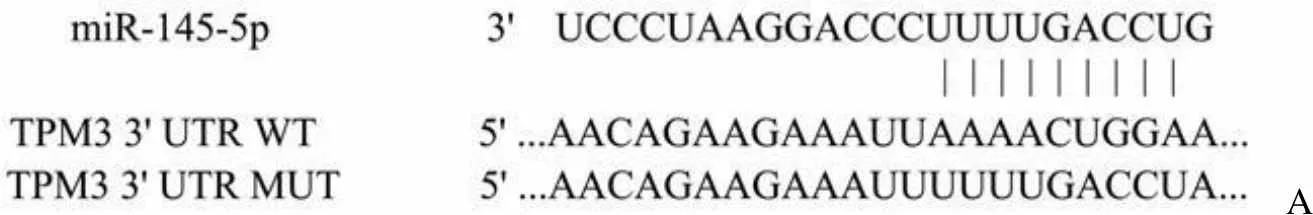
A
Figure 2 miR-145-5p targeted inhibition of TPM3 (A: The binding site of the TPM3 3'UTR region to miR-145-5p is predicted by the TargetScan database; B: miR-145-5p and TPM3 targeting relationship was detected by a dual luciferase reporter gene assay,**< 0.01 compared with the mimic-NC group; C: Expression of TPM3 mRNA in each group of cells was detected by RT-qPCR,**< 0.01 compared with the control group,##< 0.01 compared with the miR-145-5p mimic group)
2.3 miR-145-5p 靶向 TPM3 抑制甲状腺癌细胞侵袭和迁移
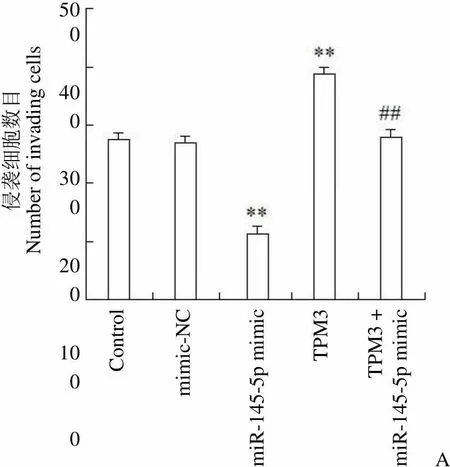
Transwell 法检测各组细胞侵袭能力,结果如图 3A 所示。与 control 组细胞相比,mimic-NC 组每视野侵袭数目无明显变化,miR-145-5p mimic 组每视野侵袭数目明显降低(< 0.01),TPM3 组每视野侵袭数目增高(< 0.01);与 miR-145-5p mimic 组相比,TPM3 + miR-145-5p mimic 组每视野侵袭数目明显增高(< 0.01)。因此,miR-145-5p 靶向TPM3 抑制甲状腺癌细胞侵袭。
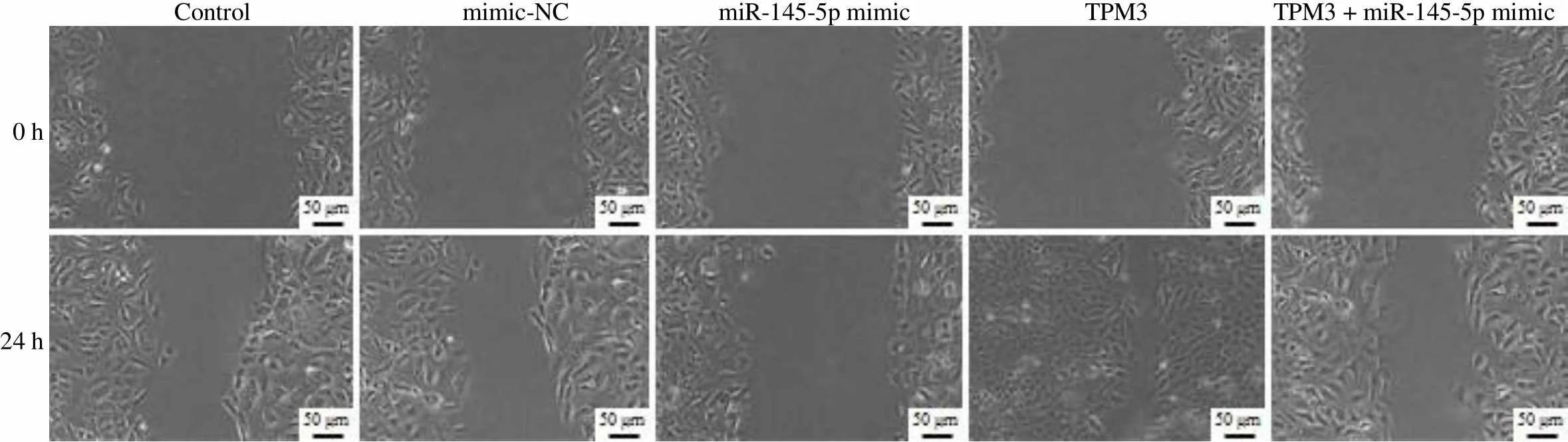
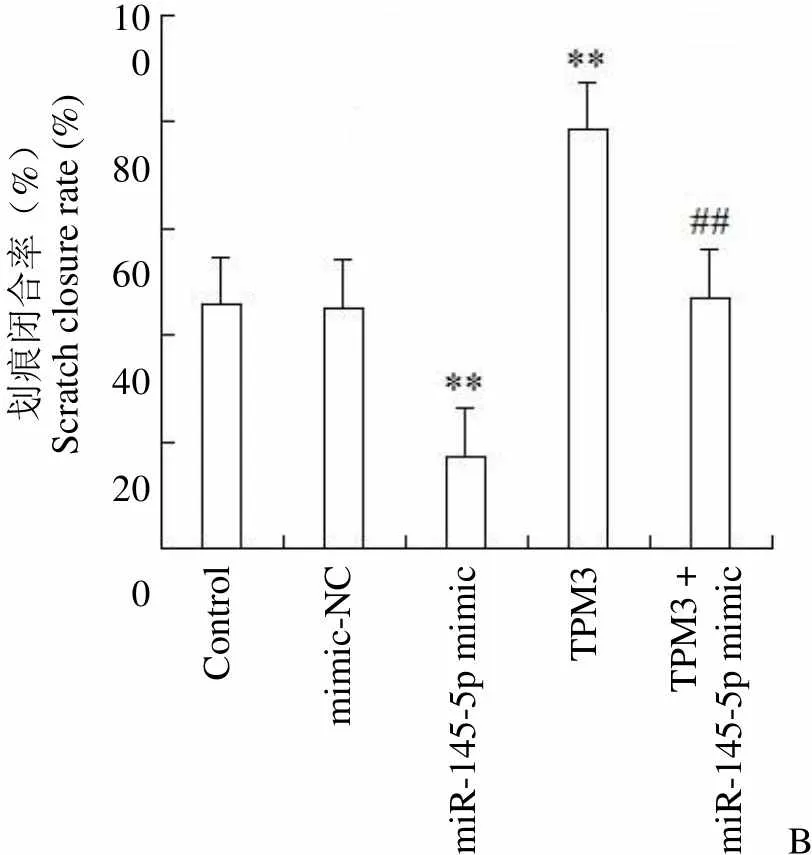
划痕实验检测细胞迁移能力,结果如图 3B 所示,与 control 组细胞相比,mimic-NC 组细胞伤口愈合率无明显变化,miR-145-5p mimic 组细胞伤口愈合率明显降低(< 0.01),TPM3 组细胞伤口愈合率明显增高(< 0.01);与 miR-145-5p mimic 组相比,TPM3 + miR-145-5p mimic 组细胞伤口愈合率明显增高(< 0.01)。因此,miR-145-5p 靶向 TPM3 抑制甲状腺癌细胞迁移。
2.4 miR-145-5p 靶向 TPM3 抑制 ERK 信号通路
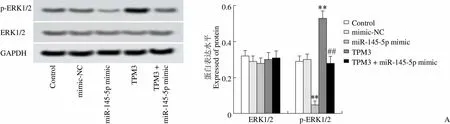
Western blot 检测各组细胞 ERK 和磷酸化 ERK 蛋白表达量,结果如图 4A 所示。与 control 组相比,mimic-NC 组细胞中 ERK 和磷酸化 ERK 蛋白表达均无明显变化,miR-145-5p mimic 组细胞中 ERK 蛋白表达无明显变化、磷酸化 ERK 蛋白表达明显下调(< 0.01),TPM3 组细胞中 ERK 蛋白表达无明显变化、磷酸化 ERK 蛋白表达明显上调(< 0.01);与 miR-145-5p mimic 组相比,TPM3 + miR-145-5p mimic 组细胞中 ERK 蛋白表达无明显变化、磷酸化 ERK 蛋白表达明显上调(< 0.01)。因此,miR-145-5p 靶向 TPM3 对甲状腺癌的作用可能与抑制 ERK 信号通路有关。
添加 ERK 信号通路激活剂TPA验证该预测。通过 Transwell 法检测各组细胞侵袭能力,结果见图4B。与 control 组相比,miR-145-5p mimic组每视野 TPC-1 细胞侵袭数目明显减少(< 0.01),TPA 组每视野 TPC-1 细胞侵袭数目明显增多(< 0.01);与 miR-145-5p mimic 组相比,TPM3 + miR-145-5p mimic 组每视野 TPC-1 细胞侵袭数目明显增多(< 0.01),说明 miR-145-5p 通过 ERK 信号通路抑制甲状腺癌细胞侵袭。通过划痕实验检测细胞迁移能力,结果如图 4C 所示。与 control 组相比,miR-145-5p mimic 组伤口愈合率明显降低(< 0.01),TPA 组伤口愈合率明显升高(< 0.01);与 miR-145-5p mimic 组相比,TPM3 + miR-145-5p mimic 组伤口愈合率明显升高(< 0.01)。因此,确证miR-145-5p 通过 ERK 信号通路抑制甲状腺癌细胞迁移。
2.5 miR-145-5p 抑制甲状腺癌细胞移植瘤发生和发展
为了进一步研究 miR-145-5p 对甲状腺癌发生和发展影响,进行了甲状腺癌细胞移植瘤实验。如图 5A、B、C 所示,与 control 组相比,miR-145-5p mimic 组大鼠体内移植瘤的重量和体积明显减少(< 0.01)。如图 5D 所示,与 control 组相比,miR-145-5p mimic 组大鼠体内移植瘤 Vimentin 的阳性细胞比率明显减少(< 0.01)。如图 5E 所示,与 control 组相比,miR-145-5p mimic 组大鼠体内移植瘤 TPM3、p-ERK 蛋白表达明显下调(< 0.01)。因此,miR-145-5p 抑制甲状腺癌细胞移植瘤发生和发展。
3 讨论
癌症的发生和发展是一个极其复杂的生物学过程,涉及数以百万计的分子和生物学途径,其中 miRNAs 近年来受到广泛关注。已有众多证据表明 miRNAs与前列腺癌、宫颈癌、肝癌和肺癌等多种癌症的发生和发展密切相关[9-12]。过表达 miR-145 能够抑制结肠癌、食管鳞状细胞癌、肺癌等癌症的发生[13-15]。本文通过研究发现,与正常甲状腺细胞相比,miR-145 在甲状腺癌细胞中表达明显下调。因此,过表达 miR-145 有望抑制甲状腺癌的发生和发展。本研究通过 TargetScan 数据库预测到 TPM3 3'UTR 区与 miR-145-5p 存在结合位点,且通过荧光素酶报告基因实验发现 miR-145-5p 直接靶向 TPM3。已有研究表明,在高转移性小鼠黑色素瘤细胞系中,TPM3 的表达水平高于低转移性小鼠黑色素瘤细胞[8];TPM3 敲除能显著抑制胶质瘤细胞的侵袭和迁移潜能[16]。本文研究发现,过表达 miR-145-5p 能够靶向抑制 TPM3 的表达,从而抑制甲状腺癌的侵袭和迁移。
甲状腺癌患者治疗存在的最大问题就是局部复发或远处转移,因此,抑制甲状腺癌细胞的侵袭和迁移能力对于甲状腺癌的治疗至关重要。Liu 等[17]发现,miR-145-5p 通过靶向信号素 3A 抑制脂肪源性干细胞的成骨分化。Ding 等[18]报道 miR-145 通过调节 TGF-β1 表达抑制乳腺癌细胞的增殖和迁移。Sathyanarayanan 等[19]发现 miR-145 通过靶向人宫颈癌细胞 SIP1,调节上皮-间质转化,抑制增殖、迁移和侵袭,因此,miR-145 有望抑制甲状腺癌细胞的侵袭和迁移能力。本文通过 Transwell 法和划痕实验发现,miR-145-5p 靶向 TPM3 抑制甲状腺癌细胞侵袭和迁移,这与其他癌症细胞的结果相一致。
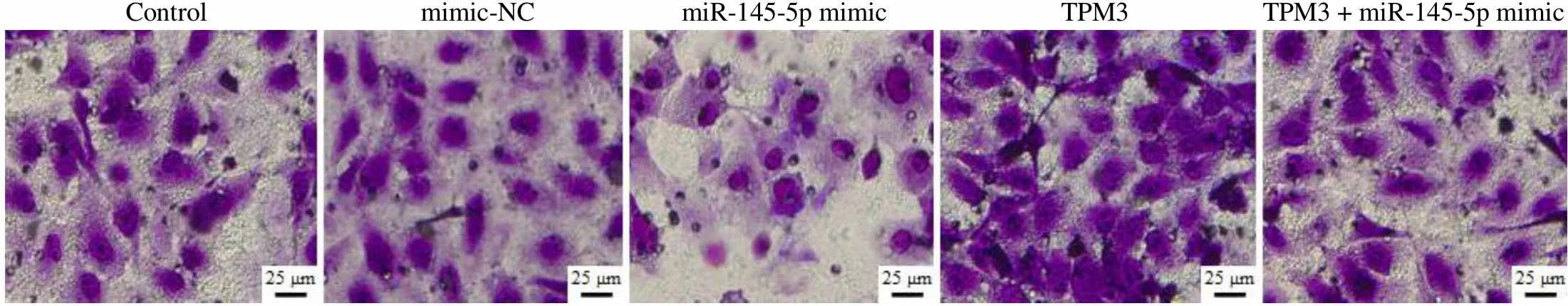
Control mimic-NC miR-145-5p mimic TPM3 TPM3 + miR-145-5p mimic
侵袭细胞数目Number of invading cells500 400 300 200 100 0 Control mimic-NC miR-145-5p mimic TPM3 TPM3 +miR-145-5p mimicA
Control mimic-NC miR-145-5p mimic TPM3 TPM3 + miR-145-5p mimic 0 h 24 h
划痕闭合率(%)Scratch closure rate (%)100 80 60 40 20 0 Control mimic-NC miR-145-5p mimic TPM3 TPM3 +miR-145-5p mimicB
Figure 3 Effect of miR-145-5p targeting TPM3 on invasion and migration of thyroid cancer cell (A: Invasive ability of each group was detected by Transwell method,**< 0.01 compared with the control group,##< 0.01 compared with the miR-145-5p mimic group; B: Cell migration ability was detected by scratch test,**< 0.01 compared with the control group,##< 0.01 compared with the miR-145-5p mimic group)
p-ERK1/2 ERK1/2 GAPDH蛋白表达水平Expressed of protein0.6 0.4 0.2 0 Controlmimic-NCmiR-145-5p mimicTPM3TPM3 + miR-145-5p mimic Control mimic-NC miR-145-5p mimic TPM3 TPM3 +miR-145-5p mimic ERK1/2 p-ERK1/2 A
Figure 4 miR-145-5p inhibits ERK signaling pathway by targeting TPM3 (A: Expression levels of ERK and p-ERK protein in each group were detected by Western blot,**compared with control group,< 0.01,##compared with miR-145-5p mimic group,< 0.01; B: Invasive ability of each group was detected by Transwell method,**< 0.01 compared with the control group,##< 0.01 compared with the miR-145-5p mimic group; C: Cell migration ability was detected by scratch test,**< 0.01 compared with the control group,##< 0.01 compared with the miR-145-5p mimic group)
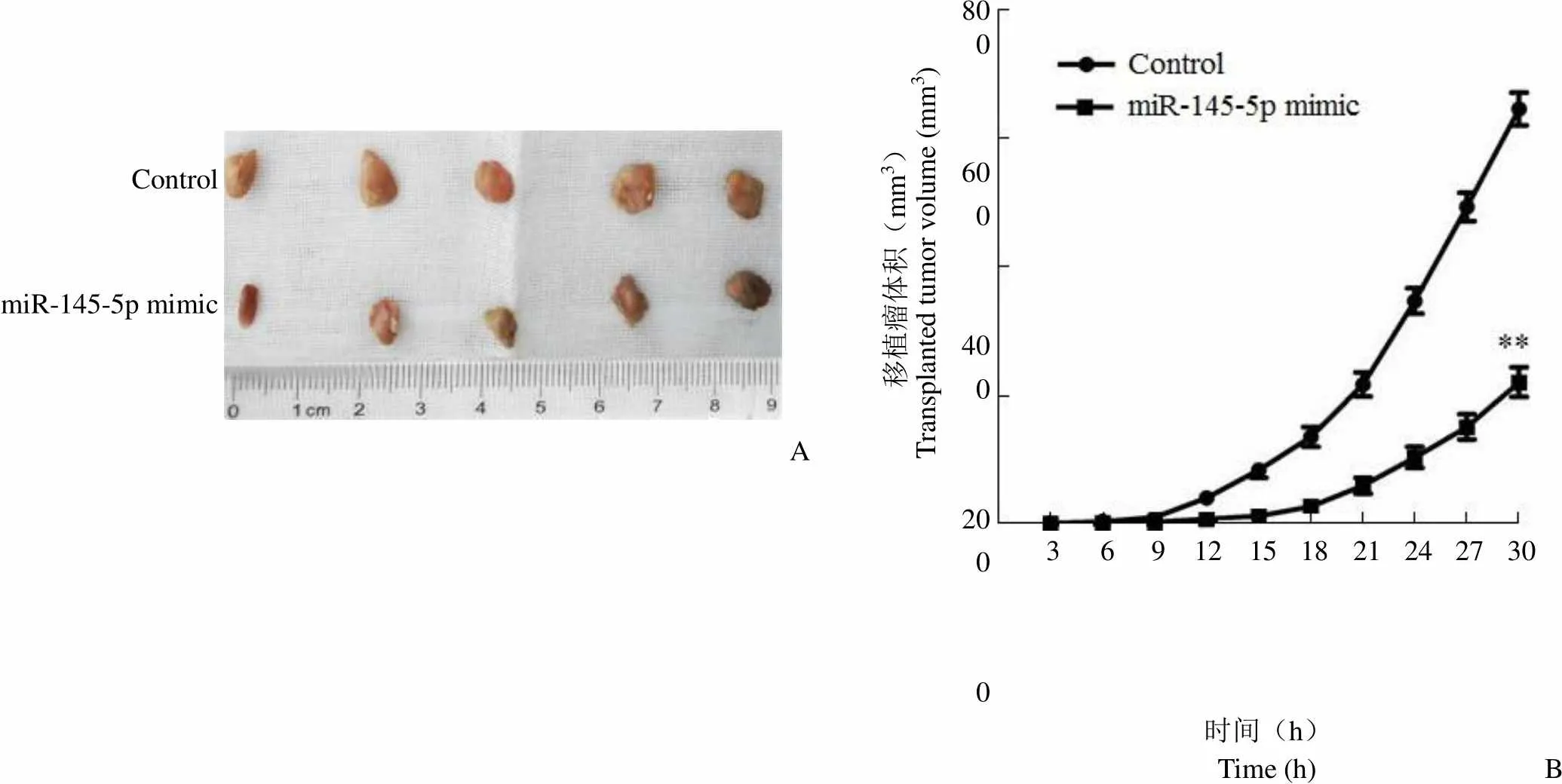
移植瘤体积(mm3)Transplanted tumor volume (mm3)800 600 400 200 0 Control miR-145-5p mimic A 3 6 9 12 15 18 21 24 27 30 时间(h)Time (h)B
Figure 5 Effect of miR-145-5p on thyroid carcinoma xenografts (A: Picture of transplanted tumor; B: Volume of transplanted tumor,**< 0.01 compared with the control group; C: Weight of the transplanted tumor,**< 0.01 compared with the control group; D: Expression of Vimentin+in transplanted tumors was detected by immunohistochemistry,**< 0.01 compared with the control group; E: Expression of TPM3, ERK and p-ERK protein in the transplanted tumor was detected by Western blot,**< 0.01 compared with the control group)
本研究发现,miR-145-5p 靶向 TPM3 抑制磷酸化 ERK 的表达,说明 miR-145-5p 靶向TPM3 对甲状腺癌的侵袭和迁移能力的抑制作用可能与抑制 ERK 信号通路有关。为了验证这一猜测,添加 ERK 信号通路激活剂 TPA 后通过 Transwell 法和划痕实验检测细胞侵袭和迁移能力。结果发现,miR-145-5p 通过 ERK 信号通路抑制甲状腺癌细胞侵袭和迁移。ERK 信号通路是自然界生物体内普遍存在的信号转导系统之一,参与细胞的增殖、分化及凋亡等不同生理功能。已有研究表明激活ERK 信号通路途径有助于甲状腺癌细胞的侵袭和迁移[20],抑制 ERK 信号通路途径能够抑制甲状腺癌细胞的侵袭和迁移[21],这与本文研究结果相统一。
通过体外实验可知,miR-145-5p 过表达靶向 TPM3 通过 ERK 信号通路抑制甲状腺癌细胞的侵袭和迁移。生物机体内环境是极其复杂多变的,为了更好地了解 miR-145-5p 对甲状腺癌细胞的影响,本文进行了裸鼠体内移植瘤实验。通过研究发现,miR-145-5p 过表达会使体内移植瘤的重量和体积明显减少,并使移植瘤的 Vimentin 阳性细胞比率明显减少,TPM3、ERK、p-ERK蛋白表达明显下调,说明 miR-145-5p 过表达抑制甲状腺癌移植瘤的侵袭和迁移,并抑制 ERK 信号通路的激活。
综上所述,miR-145 在甲状腺癌细胞中低表达,高表达 miR-145 靶向抑制 TPM3 来抑制甲状腺癌细胞的侵袭和迁移,这种作用是通过 ERK 信号通路来实现的。未来将进一步挖掘 miR-145 在甲状腺癌的诊断和预后中的价值。
[1] Lin Y, Cheng K, Wang T, et al. miR-217 inhibits proliferation, migration, and invasion via targeting akt3 in thyroid cancer. Biomed Pharmacother, 2017, 95:1718-1724.
[2] Pemayun TG. Current diagnosis and management of thyroid nodules. Acta Med Indones, 2016, 48(3):247-257.
[3] Foroutan T, Farhadi A, Abroun S, et al. Adipose derived stem cells affect miR-145and p53 expressions of Co-cultured hematopoietic stem cells. Cell J, 2018, 19(4):654-659.
[4] Jang WI, Jo YJ, Kim HC, et al. Non-muscle tropomyosin (Tpm3) is crucial for asymmetric cell division and maintenance of cortical integrity in mouse oocytes. Cell Cycle, 2016, 13(15):2359-2369.
[5] Janco M, Rynkiewicz MJ, Li L, et al. Molecular integration of the anti-tropomyosin compound ATM-3507 into the coiled coil overlap region of the cancer-associated Tpm3.1. Sci Rep, 2019, 9(1):11262.
[6] Zhu S, Si ML, Wu H, et al. Microrna-21 targets the tumor suppressor gene tropomyosin 1 (tpm1). J Biol Chem, 2017, 282(19):14328- 14336.
[7] Kim TM, Yim SH, Shin SH, et al. Clinical implication of recurrent copy number alterations in hepatocellular carcinoma and putative oncogenes in recurrent gains on 1q. Int J Cancer, 2018, 123(12): 2808-2815.
[8] Zhou S, Ma X, Wang ZJ, et al. Research on the establishment of a TPM3 monoclonal stable transfected PANC-1 cell line and the experiment of the EMT occurrence in human pancreatic cancer. Onco Targets Ther, 2019, 12(2):5577-5587.
[9] Feng F, Liu H, Chen A, et al. miR-148-3p and miR-152-3p synergistically regulate prostate cancer progression via repressing KLF4. J Cell Biochem, 2019, 120(10):17228-17239.
[10] Chen L, Shi X, Huo D, et al. miR-449b-5p regulates cell proliferation, migration and radioresistance in cervical cancer by interacting with the transcription suppressor FOXP1. Eur J Pharmacol, 2019, 856: 172399.
[11] Wang S, Zhang S, He Y, et al. HOXA11-AS regulates JAK-STAT pathway by miR-15a-3p/STAT3 axis to promote the growth and metastasis in liver cancer. J Cell Biochem, 2019, 120(9):15941-15951.
[12] Yang Y, Li H, Liu Y, et al. MIR-4319 hinders yap expression to restrain non-small cell lung cancer growth through regulation of LIN28-mediated RFX5 stability. Biomed Pharmacother, 2019, 115: 108956.
[13] Sheng N, Tan G, You W, et al. Mir-145 inhibits human colorectal cancer cell migration and invasion via PAK4-dependent pathway. Cancer Med, 2017, 6(6):1331-1340.
[14] Mei LL, Wang WJ, Qiu YT, et al. miR-145-5p suppresses tumor cell migration, invasion and epithelial to mesenchymal transition by regulating the Sp1/NF-κB signaling pathway in esophageal squamous cell carcinoma. Int J Mol Sci, 2017, 18(9):1833.
[15] Pan Y, Ye C, Tian Q, et al. miR-145 suppresses the proliferation, invasion and migration of NSCLC cells by regulating the BAX/BCL-2 ratio and the caspase-3 cascade. Oncol Lett, 2018, 15(4):4337-4343.
[16] Tao T, Shi Y, Han D, et al. TPM3, a strong prognosis predictor, is involved in malignant progression through MMP family members and EMT-like activators in gliomas. Tumor Biol, 2014, 35(9):9053-9059.
[17] Liu X, Zhu W, Wang L, et al. miR-145-5p suppresses osteogenic differentiation of adipose-derived stem cells by targeting semaphorin 3A. In Vitro Cell Dev Biol Anim, 2019, 55(3):189-202.
[18] Ding Y, Zhang C, Zhang J, et al. miR-145 inhibits proliferation and migration of breast cancer cells by directly or indirectly regulating TGF-β1 expression. Int J Oncol, 2017, 50(5):1701-1710.
[19] Sathyanarayanan A, Chandrasekaran KS, Karunagaran D. microRNA-145 modulates epithelial-mesenchymal transition and suppresses proliferation, migration and invasion by targeting SIP1 in human cervical cancer cells. Cell Oncol (Dordr), 2017, 40(2):119-131.
[20] Guan H, Guo Z, Liang W, et al. Trop2 enhances invasion of thyroid cancer by inducing MMP2 through ERK and JNK pathways. BMC Cancer, 2017, 17(1):486.
[21] Hong S, Yu S, Li J, et al. miR-20b displays tumor-suppressor functions in papillary thyroid carcinoma by regulating the MAPK/ERK signaling pathway. Thyroid, 2016, 26(12):1733-1743.
miR-145-5p inhibits thyroid cancer TPC-1 cell invasion and metastasis via ERK signaling pathway by targeting TPM3
LAN Tian, LIU Wei-meng, ZOU Yang, QIU Ping
Department of Endocrinology and Metabolism, The First Affiliated Hospital of Chengdu Medical College, Chengdu 610500, China (LAN Tian, QIU Ping); Department of Gynecology, The Sixth People's Hospital of Panzhihua, Panzhihua 617023, China (LIU Wei-meng); Internal Medicine, The Ninth People's Hospital of Chongqing, Chongqing 400700, China(ZOU Yang)
This work aims to study the effect of miR-145-5p on invasion and metastasis of thyroid cancer cells.miR-145-5p mimic plasmid, mimic-NC plasmid, and TPM3 plasmid were separately or jointly transfected into thyroid cancer cells by Lipofectamine2000. Expression of miR-145-5p and TPM3 mRNA was detected by RT-qPCR. The targeted relationship was detected by dual luciferase reporting assay. Cell invasion ability was detected by Transwell method. Cell migration ability was measured by a scratch test. Expression of ERK1/2, and p-ERK1/2 was detected by Western blot. A thyroid cancer xenograft model was constructed by subcutaneous injection of the right hind limb of nude mice. The volume and weight of the transplanted tumor were determined. Expression of vimentin was detected by immunohistochemistry. Expression of TPM3, ERK1/2 and p-ERK1/2 was detected by Western blot.Expression of miR-145-5p is decreased in thyroid cancer cells, and miR-145-5p was found to target and inhibit TPM3 expression. Overexpression of miR-145-5p significantly reduced the number of invasion and wound healing of thyroid cancer cells, and down-regulated p-ERK expression, whereas both TPM3 overexpression and ERK pathway activators reversed the miR-145-5p-induced effects (< 0.01). Overexpression of miR-145-5p significantly reduced the weight and volume of transplanted tumors, and significantly reduced the ratio of Vimentin-positive cells in transplanted tumors and down-regulated TPM3 and p-ERK1/2 protein expression (< 0.01).miR-145-5p inhibits thyroid cancer cell invasion and metastasis via ERK signaling pathway by targeting TPM3.
miR-145-5p; thyroid cancer; TPM3; ERK; invasion; migration
QIU Ping, Email: wxqiuping@163.com
四川省教育厅自然类课题(18Z065)
邱平,Email:wxqiuping@163.com
2020-09-10
10.3969/j.issn.1673-713X.2021.01.005
