发根农杆菌介导的杜梨毛状根遗传转化方法
2021-02-22郝紫微戴雨沁张绍铃
郝紫微,戴雨沁,张绍铃,王 鹏
(南京农业大学梨工程技术研究中心,南京 210095)
杜梨(Pyrus betulaefolia)是常用的梨栽培用砧木,具有高度杂合的基因型,遗传背景复杂,并且童期长,因此导致杜梨砧木育种周期极长[1]。植物基因工程是实现快速精准育种的有效方法,而遗传转化则是其中最关键的环节之一。农杆菌介导的植物转化是目前应用最广泛的方法[2],农杆菌分为根癌农杆菌(Agrobacterium tumefaciens)和发根农杆菌(Agrobacterium rhizogenes)。根癌农杆菌中含穿梭质粒-Ti质粒,该质粒含有可以整合到植物基因组上的T-DNA区段[3]。目前借助根癌农杆菌已成功实现水稻[4]、玉米[5]、大豆[6]、苹果[7]、柑橘[8]等重要作物的遗传转化。发根农杆菌在感染植物后,能诱导植物产生大量高度分支的毛状根。发根农杆菌中的Ri质粒经过改造修饰后,其T-DNA片段区可以将目标基因插入宿主植物的基因组中,产生转基因毛状根[9]。发根农杆菌侵染植物所产生的毛状根具有生长速度快、分化程度高、生理生化和遗传性稳定、操作控制简单等特点[10]。目前通过发根农杆菌转化在烟草、苜蓿、豌豆、咖啡等植物中获得了提高抗性相关的转基因植株,如抗病、抗虫、耐受重金属等[10]。此外,近年来在茶树[11,12]、龙眼[13]、枳[14]、山定子[15]和枣树[16]等果树中也有较多关于发根农杆菌遗传改良和抗病性的研究。梨遗传转化体系起步较其他物种较晚,目前还缺乏高效快速的遗传转化方法,严重限制了梨基因功能研究和梨精准分子育种应用[17,18]。本研究以杜梨为研究材料,利用发根农杆菌开发了一种简单、快速、高效的杜梨毛状根转化方法,为梨树基因功能研究和遗传改良提供了技术支持。
1 材料与方法
1.1 供试材料
杜梨种子经4℃沙藏层积35 d后,播种于盆内,生长环境为光照16 h/黑暗8 h,温度25±1℃,生长至6~8片真叶,株高约7 cm时,用于侵染。
发根农杆菌菌株K599储存在含有50%甘油的LB液体培养基(蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L)中,于-80℃冻存。植物表达质粒载体为pROK2,包含卡那霉素抗性基因筛选标记。
1.2 方法
1.2.1 克隆mCherry基因 克隆mCherry荧光蛋白基因(正向引物:5′-acgggggactctagaggatcc ATGGTG AGCAAGGGCGAGG-3′,反 向 引 物 :5′-gggaaattcg agctcggtacc TTACTTGTACAGCTCGTCCATGCC-3′)并通过同源重组构建到pROK2,mCherry基因编码区长度为711 bp。采用Phusion High-Fidelity DNA Polymerase试剂盒,50 μL 总反应体积中,包括 5×Phusion GC Buffer 10 μL,10×d NTP Max 1 μL,10μmol/L 正 向 引物 2.5 μL,10 μmol/L 反 向 引物 2.5 μL,模 板 DNA 1 μL,ddH2O 32.5 μL,Phusion DNA Polymerase 0.5 μL。PCR反应程序为预变性:98 ℃30 s,循环反应(30个循环)98℃ 10 s→65℃ 30 s→72℃ 45 s,终延伸72℃ 10 min。
1.2.2 产物鉴定及载体构建 将PCR产物经1%的琼脂糖凝胶电泳分离后,切取约700 bp的目的条带,用胶回收试剂盒回收目标片段。将pROK2空载于37℃下用BamHⅠ和KpnⅠ双酶切3 h,酶切后胶回收,利用重组酶将基因和酶切好的质粒于37℃下反应30 min,将重组完毕的产物转入大肠杆菌DH5α感受态细胞,选取阳性克隆小量提取质粒进行Sanger测序验证,将测序正确的质粒进行农杆菌转化(运用冻融法制备发根农杆菌感受态),得到含有目的基因的发根农杆菌。
1.2.3 K599发根农杆菌感受态的制备与转化 使用冻融法制备农杆菌感受态并进行转化,方法参照姚丹[19]并作修改。
1)首先将农杆菌菌株K599于LB固体培养基(含50 μg/mL利福平)的平板上划线,28℃恒温倒置培养36~48 h。
2)挑取单菌落2~5 mL到LB液体培养基(含50μg/mL利福平),之后按1%接种率接种于100 mL LB液体(含50 μg/mL利福平)培养基中,28℃、220 r/min振荡培养至OD600=0.8。
3)将菌液分装于50 mL无菌离心管中,冰浴10 min,于4℃、5 000 r/min离心10 min,弃上清。
4)在超净工作台中加入2~5 mL预冷的10%甘油,吸打混匀后至等体积冰预冷的10%甘油,4℃、5 000 r/min离心10 min后弃上清。
5)重复4)步骤1次,然后加入200 μL过滤除菌的山梨醇(100 mg/mL)重悬。
6)将感受态细胞分装为50 μL/管,液氮速冻后于-80℃保存待用。
7)取500 ng质粒加入50 μL融化的农杆菌感受态中,冰上放置30 min;液氮速冻1 min后立即37℃水浴1 min;冰上放置3 min后加入500 μL无抗生素LB液体培养基,28℃、220 r/min恒温摇床中培养4 h,然后5 000 r/min离心5 min,弃去部分培养基,留100 μL重悬菌体后涂于含有50 mg/L利福平和50 mg/L卡那霉素的LB平板上放于30℃培养箱中培养36~48 h,筛选阳性克隆,并进行PCR鉴定,将鉴定出来的阳性菌液提取质粒再次进行大肠杆菌转化,并选择测序结果正确的阳性克隆菌液,在其中加入50%甘油,于-80℃保存。
1.2.4 注射侵染杜梨实生苗 方法参照Meng等[9]并稍作修改:挑取含有pROK2-35S:mCherry的发根农杆菌菌株K599的单克隆在5 mL LB液体培养基(含50 mg/L利福平和50 mg/L卡那霉素)中,28℃振荡(180 r/min)培养3~4 h,取1 mL农杆菌加到含25 mL LB培养基(含50 mg/L利福平和50 mg/L卡那霉素)的锥形瓶中28℃过夜培养,OD600值达到0.3~0.4后,将培养物在室温下以8 000 r/min离心10 min,然后重悬于MES缓冲液(10 mmol/L MES-KOH,pH 5.2,10 mmol/L MgCl2和 100 μmol/L 乙酰丁香酮),60 r/min室温缓慢振荡孵育3 h。将0.1 mL农杆菌悬浮液用1 mL注射器注入梨苗距根部1.5 cm位置,然后用脱脂棉沾取少量菌液包裹伤口移入土中。注射后20 d可见愈伤组织在茎的注射部位生长,注射后45 d可见毛状根生长良好。
1.2.5 RNA提取及PCR检测 收集毛状根提取总RNA,进行反转录后,以cDNA为模板进行PCR扩增,扩增目的片段是长度为711 bp的mCherry全长编码区,验证载体片段是否插入梨基因组。
1.2.6 注射烟草叶片验证pROK2-35S:mCherry克隆是否可以正常表达 采用农杆菌注射法将pROK2-35S:mCherry载体转入烟草表皮细胞中,用去掉针头的注射器将侵染液注入烟草叶片的背面,之后于25℃培养3 d。叶片剪取1 cm2大小制成临时装片,使用Zeiss LSM800激光共聚焦显微镜观察烟草叶片在561 nm激发光下检测mCherry表达情况。
1.2.7 体视显微镜观察杜梨毛状根中mCherry的荧光 体视荧光显微镜可以在不损伤植物的情况下观察根部荧光。注射后待毛状根长出,即可运用Leica M205FA体视荧光显微镜观察mCherry的荧光信号,与未注射的阴性对照杜梨苗进行比较。
2 结果与分析
2.1 使用侵染烟草叶片瞬时表达目的基因的方法检测表达载体的效率
为了验证pROK2-35S:mCherry表达载体的效率,利用侵染烟草叶片瞬时表达的方法进行验证。如图1所示,注射携带pROK2-35S:mCherry农杆菌的烟草叶片中有红色荧光产生,说明mCherry可以正常表达。
2.2 杜梨毛状根的发生
取生长40 d,6~8片叶片的杜梨实生苗(图2a),在距根部约1.5 cm的位置(图2b)注射含pROK2-35S:mCherry质粒的农杆菌K599,菌液浓度为OD600值0.3~0.4。共注射40株梨苗,18~32 d后愈伤组织出现,产生毛状根植株为34株,毛状根产生率为85%,注射后约45 d再生毛状根生长良好(图2c)。转基因毛状根长势良好且鉴定为阳性植株有6株,阳性率达到17.6%。
2.3 毛状根RT-PCR鉴定
因发根农杆菌侵染后植株自然生长在土壤中,未经过灭菌处理,通过DNA检测转基因材料的假阳性比例过高,因此本试验提取毛状根总RNA进行阳性植株检测。选取生长良好的杜梨实生苗转化植株的毛状根,提取毛状根总RNA并反转录。以未侵染的根作为阴性对照,pROK2-35S:mCherry质粒为阳性对照,扩增检测mCherry基因,用1%琼脂糖凝胶对扩增产物进行电泳检测。结果如图3所示,34个产生毛状根的植株中,有6个植株及阳性对照质粒均扩增出了大小与mCherry基因完全一致的条带,而阴性对照植株(CK)则没有扩增出相应的条带。
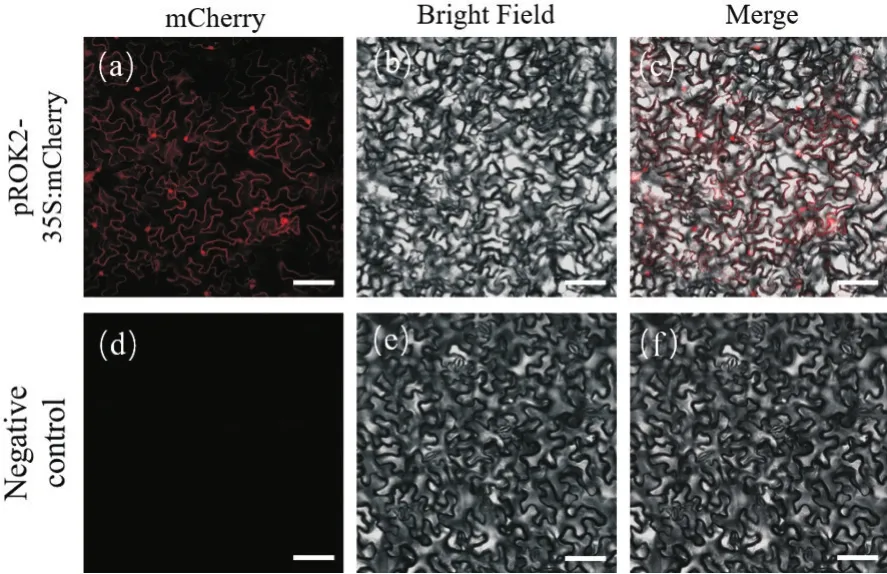
图1 烟草叶片中瞬时表达检测pROK2-35S:mCherry载体的表达效率

图2 杜梨苗注射部位和毛状根发生
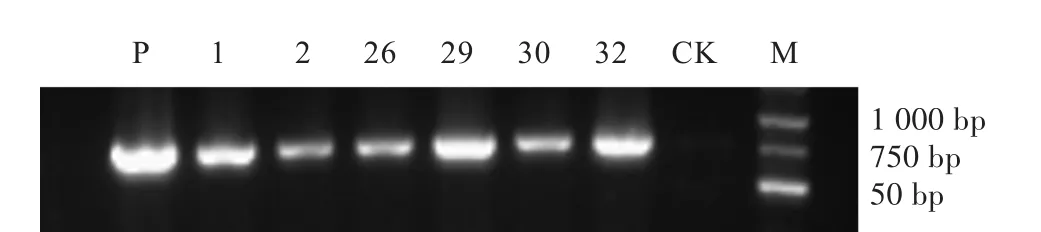
图3 RT-PCR检测梨转基因毛状根中mCherry的表达
2.4 体视荧光显微镜观察杜梨毛状根mCherry荧光
为进一步确定mCherry在杜梨毛状根中的表达,用体视荧光显微镜对梨根部进行观察,结果可以在根中直接观察到mCherry的红色荧光,而在未转化阴性对照杜梨根中则无荧光信号(图4)。
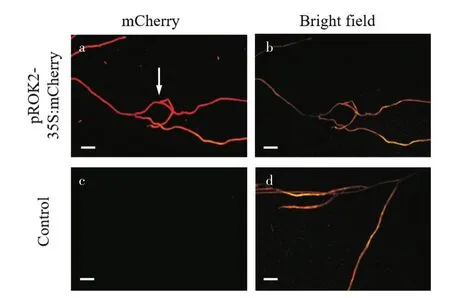
图4 转化的梨毛状根中可以观察到mCherry的荧光信号
3 小结与讨论
本研究探索了杜梨毛状根遗传转化技术,建立了一种通过发根农杆菌直接侵染杜梨产生不定根的方法。侵染时期为生长40 d,6~8片叶片的梨实生苗,注射20 d后,可见不定根在茎的注射部位生长,注射后45 d可见毛状根生长良好,使用该方法可在45 d获得长势良好的转基因杜梨毛状根且植株阳性率可达17.6%。结果表明,发根农杆菌侵染诱导毛状根发生是一种不依赖组织培养的高效转化技术,也为杜梨基因功能研究提供了新的工具。
目前,果树转基因大多依赖根癌农杆菌转化,通过根癌农杆菌转化已成功在多种果树上运用,包括苹果[20]、山 定 子[21]、葡 萄[22]、草 莓[23]、荔枝[24]、香蕉[25]、柑桔[26]、枣[16]、桃[27]等。梨的转基因研究也普遍采用此方法,以白梨系统的苹果梨[28]和鸭梨[29],砂梨系统的雪青[30],西洋梨康弗伦斯、帕西和杜康[31,32]以及野生种的杜梨[33]获得了转基因植株。根癌农杆菌介导的遗传转化方法依赖于组织培养技术,所受影响因素较多,包括农杆菌浓度、适合的侵染时间、共培养时间、成熟的组织培养技术以及稳定高效的再生体系等[33],这些因素都导致遗传转化再生频率普遍偏低、周期相对较长,转化效率低等问题[34,35]。
发根农杆菌己成功在多种植物上进行转基因研究,尤其在药用植物上应用广泛[36-39]。在果树遗传转化研究中,目前只在柑橘[14]和枣树[16]上有发根农杆菌通过外植体侵染的研究报道。本研究初步建立了直接侵染杜梨实生苗获得转基因植株的一个简单而高效的毛状根转化系统,能在相对短的时间内稳定转化根。利用该转化方法可以在梨上面开展基因功能验证、次生代谢物及植物根系发育的研究,对于其他常见果树如苹果、葡萄等的毛状根遗传转化体系建立有一定的参考意义。
