某核心种猪场猪胸膜肺炎放线杆菌的分离鉴定与药敏试验
2021-02-22李泽伟段倩倩程家园
王 迪,李泽伟,段倩倩,李 国,程家园,李 郁
(安徽农业大学动物科技学院,安徽 合肥 230036)
猪传染性胸膜肺炎(Porcine contagious pleuropneumoniae, PCP)是由猪胸膜肺炎放线杆菌(Actinobczcillus pleuropeumonicze, APP)引致的猪的一种高度接触性的呼吸道传染病,对生猪生产的影响因APP血清型、环境和机体免疫因素不同等而异,主要临诊特征为急性出血性、纤维素性胸膜肺炎和慢性纤维素性、坏死性胸膜肺炎[1]。PCP呈世界性分布,传播力强,尤其是近年随着我国猪场规模化、集约化的发展及跨区频繁引种,其发病率和死亡率均有上升,目前流行日渐严重,现已成为我国猪群中主要的细菌性呼吸道传染病之一,造成了养猪业巨大经济损失。APP根据荚膜多糖(CPS)和脂多糖(LPS)抗原性差异,可分为15种血清型;依照生长是否需要烟酰胺腺嘌呤二核苷酸(NAD或V因子),又分为两个生物型,即生物Ⅰ型(NAD依赖型)和生物Ⅱ型(非NAD依赖型),其中血清1~12型和15型归为生物Ⅰ型,血清13型和14型归为生物Ⅱ型。不同国家或地区流行血清型并非一致,相同血清型之间临床致病力也不尽相同,且不同血清型之间交叉保护力较弱,尤其是目前市场上存在的商品化疫苗仅涉及血清1、3和7型,致使疫苗免疫效果常不确实或免疫失败,从而使该病的防制难度进一步增大。
2020年7月,某核心种猪场260~300日龄后备母猪出现体温升高、呼吸困难、咳嗽等症状,发病率为100%,病死率为4%。剖检后其肺呈紫红色,伴有出血,且在肺的心叶、尖叶和隔叶出现病灶,与正常组织界线分明,胸腔存在积液。通过对病原的分离鉴定,确定该猪场存在APP感染,并根据药敏试验筛选出高敏药物,试验结果不仅为猪场临床治疗及有效防控提供科学依据,同时也为区域性APP流行动态调查提供相应参考。
1 材料与方法
1.1 病料来源
病料为某种猪场4份260~300日龄病死后备母猪肺脏,相关试验于2020年7—8月在安徽农业大学动物传染病实验室开展。
1.2 主要试验材料
0.6 %酵母浸膏胰酪胨大豆琼脂(TSA-YE)、0.6%酵母浸膏胰酪胨大豆肉汤(TSB-YE)购自绍兴天恒生物科技有限公司;新生小牛血清购自北京索莱宝科技有限公司;琼脂糖、烟酰胺腺嘌呤二核苷酸(NAD)购自生工生物工程(上海)股份有限公司;2×Taq PCR Master Mix、DL 2 000 DNA Marker购自天根生化科技有限公司;17种抗生素(环丙沙星、诺氟沙星、氟苯尼考、氧氟沙星、头孢唑林、头孢曲松、链霉素、庆大霉素、丁胺卡那、复方新诺明、多西环素、红霉素、阿莫西林、氨苄西林、青霉素、卡那霉素和四环素)购自杭州天和微生物试剂有限公司。
1.3 质控菌株
金黄色葡萄球菌CMCC 26112、大肠杆菌CMCC 44113均购自中国药品生物制品检定所。
1.4 细菌的分离培养及形态学观察
无菌采取4份病死猪肺脏接种于TSA-YE培养基(含5%小牛血清及1.5% NAD),采用需氧、微需氧、厌氧3种培养方式,置37 ℃条件下培养18~24 h,观察细菌的生长情况,并挑取单个可疑菌落进行革兰氏染色,镜检,观察其形态特征。
1.5 引物合成
参照文献[2-4]设计PCR鉴定APP及其血清型、毒力基因型引物(表1)。引物均由合肥通用生物科技有限公司合成。
1.6 分离菌株的PCR鉴定
利用煮沸法提取分离菌基因组DNA作为模板,用于PCR鉴定APP。PCR反应体系(25 μL):2×Taq PCR Master Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 5 μL,ddH2O 5.5 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,57 ℃ 90 s,72 ℃ 1 min,3个循环;95 ℃ 20 s,57 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物经琼脂糖凝胶电泳后在凝胶成像仪上进行观察,并记录结果。
1.7 APP NAD依赖试验
将鉴定为APP的分离株分别接种于NAD阳性(含5%小牛血清及1.5% NAD)和NAD阴性(只含5%小牛血清,不含NAD)的TSA-YE培养基上。同时用金黄色葡萄球菌单个菌落在TSA-YE培养基(只含5%小牛血清,不含NAD)上划一横线,再将鉴定为APP的分离株垂直接种于横线两侧,置37 ℃条件下培养24 h后观察其生长情况。

表1 PCR鉴定APP及其血清型、毒力基因型引物序列
1.8 APP血清型鉴定
参照1.6提取APP模板DNA,用于PCR鉴定血清型。PCR反应体系(25 μL):2×Taq PCR Master Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 5 μL,ddH2O 5.5 μL。PCR反应条件:95 ℃5 min;95 ℃ 50 s,62 ℃ 50 s ,72 ℃ 1 min,35个循环;72 ℃ 10 min。PCR产物经琼脂糖凝胶电泳后在凝胶成像仪上进行观察,并记录结果。
1.9 APP毒力基因鉴定
参照1.6提取APP模板DNA,用于PCR鉴定4种毒力基因(ApxⅡ、ApxⅢ、ApxⅣ和Omp2)。ApxⅡ、ApxⅢ、Omp2基因PCR反应体系:2×Taq PCR Master Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 5 μL,ddH2O 5.5 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,62 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。ApxⅣ基因PCR反应体系如下:2×Taq PCR Master Mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 2 μL,ddH2O 8.5 μL。反应条件为:94 ℃ 10 min;94 ℃ 1 min、54.8 ℃ 1 min、72 ℃ 1 min,30个循环;72 ℃ 10 min。PCR产物经琼脂糖凝胶电泳后在凝胶成像仪上进行观察,并记录结果。
1.10 APP毒力基因分析
将含目的基因片段的PCR产物纯化后测序,采用MEGA 6.02软件对获得的毒力基因序列进行序列同源性分析,并用Maximum Likeihood tree方法分别构建APP的毒力基因序列系统发育树进行遗传进化分析。
1.11 药物敏感性试验
采用Kirby-Bauer纸片法。将APP分离株培养物用0.5麦氏比浊管校正菌液浓度后,在MHA培养基(含5%小牛血清及1.5% NAD)表面均匀涂布接种100 μL,室温干燥5 min后,选择17种药敏纸片贴于琼脂表面,置37 ℃条件下培养18~24 h后观察结果。结果根据美国临床试验室标准委员会(CLSI/NCCLS)2016版执行标准判定结果。
2 结果与分析
2.1 细菌的分离培养及形态学观察
自每份病死猪肺脏中均分离1株细菌,共计4株。分离菌在TSA-YE培养基(含5%小牛血清及1.5% NAD)上培养24 h后,均呈圆形、表面光滑、灰白色半透明的水株样菌落。厌氧培养与需氧培养时,细菌生长较快,微需氧培养次之;经涂片染色镜检,分离菌为革兰阴性短杆菌,两端钝圆,具有典型的多形性,呈细小短杆状,少数为长丝状,符合APP的形态学特征。
2.2 分离菌株的PCR鉴定
利用APP特异性引物对4株分离菌进行PCR扩增和琼脂糖凝胶电泳检测,阳性对照出现342 bp扩增条带、阴性对照无条带出现,试验结果成立。4株分离菌PCR扩增产物与阳性片段大小均相符,确定为APP,分别命名为HB1、HB2、HB3和HB4(图1)。

图1 4株分离菌的PCR扩增结果
2.3 APP NAD依赖试验
HB1、HB2、HB3和HB4菌株在NAD阳性的TSA-YE培养基上均生长良好,在NAD阴性的TSAYE培养基上均不生长。在金黄色葡萄球菌周围均呈典型“卫星现象”生长,愈靠近金黄色葡萄球菌菌落生长愈大,反之愈小,甚至不见菌落生长,均符合生物Ⅰ型APP特征。
2.4 APP血清型鉴定
利用8对不同血清型的APP引物对HB1、HB2、HB3和HB4菌株进行PCR扩增。结果显示,该4株生物Ⅰ型APP均获得977 bp目的片段,与预期片段的大小相符,确定为血清8型(图2)。

图2 4株APP的血清型PCR鉴定结果
2.5 APP毒力基因鉴定
对HB1、HB2、HB3和HB4菌株的ApxⅡ、ApxⅢ、ApxⅣ和Omp2毒力基因进行PCR检测,结果显示,该4株APP均出现750 bp的Omp2目的条带(图3)和1 200 bp的ApxⅣ目的条带(图4),与预期结果一致,进一步通过测序后上传GenBank进行比对,分别确定为Omp2和ApxⅣ毒力基因。但4株菌均未检测到ApxⅡ和ApxⅢ毒力基因。

图3 Omp2毒力基因的PCR鉴定

图4 ApxⅣ毒力基因的PCR鉴定
2.6 APP毒力基因分析
序列同源性分析结果表明,HB1、HB2、HB3和HB4菌株之间的Omp2基因核苷酸序列的相似度为100%,高度同源,与11株APP参考菌株的相似度在98.6%~100%之间,其中与2株丹麦株(登录号:U86677.1和U86681.1)、3株日本株(登录号:AB007586.1、AB007585.1和AB007578.1)的相似度达100%,同源性很高(图5)。HB1、HB2、HB3和HB4菌株之间的ApxⅣ基因核苷酸序列的相似度也为100%,高度同源,与9株APP参考菌株的相似度在96.4%~99.5%之间,其中与1株德国株(登录号:CP001091.1)的相似度达99.8%,同源性也很高(图6)。构建的Omp2和ApxⅣ基因系统发育树显示,HB1、HB2、HB3和HB4菌株的Omp2基因序列处于同一分支且与2株丹麦株(登录号:U86677.1和U86681.1)、3株日本株(登录号:AB007586.1、AB007585.1和AB007578.1)聚为同一分支(图7);ApxⅣ基因序列处于同一分支且与1株德国株(登录号:CP001091.1)位于同一分支,遗传关系均密切(图8)。
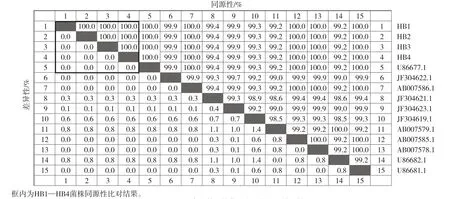
图5 Omp2毒力基因核苷酸序列的同源性比较

图6 ApxⅣ毒力基因核苷酸序列的同源性比较

图7 Omp2毒力基因核苷酸序列系统发育树分析

图8 ApxⅣ毒力基因核苷酸序列系统发育树分析
2.7 药物敏感性试验
根据CLSI/NCCLS执行标准判断,质控菌株的抑菌圈大小在规定范围内。HB1、HB2、HB3和HB4菌株对环丙沙星、诺氟沙星、氟苯尼考、氧氟沙星、头孢唑林、头孢曲松均100%敏感,对青霉素、卡那霉素、四环素100%耐药,对其他8种药物也表现出不同程度耐药(表2)。

表2 HB1—HB4菌株药物敏感性试验结果
3 讨论
APP主要定植于猪的呼吸道并且具有高度宿主特异性。调查显示,在猪4周龄时APP即可定植其上呼吸道,而发病一般在6~12周龄之后的肥育期。带菌猪和病猪是PCP的主要传染源,传播途径主要为气源感染,即通过猪只之间的直接接触或短距离的飞沫传播;还可通过被APP污染的车辆、工具、器械以及饲养人员流动等间接传播;鼠类和鸟类也能传播PCP。感染猪的鼻腔、扁桃体、支气管和肺脏等部位是APP存在的主要场所。PCP虽多发于冬春季节,但易受外界因素影响,如气温骤变、湿度过高、通风不良、饲养环境的突然改变、混群、转群、拥挤、长途运输等应激因素可促使本病的发生和流行。此外,猪群感染猪圆环病毒2型、猪蓝耳病病毒、猪链球菌、副猪嗜血杆菌、多杀性巴氏杆菌等病原后,也可使其对APP的易感性增强[5]。
PCR技术鉴定APP,具有敏感性高、特异性强、诊断速度快的特点,是目前病原分子生物学诊断中常用的方法。本试验针对某核心种猪场260~300日龄后备母猪出现的病情,在掌握进行相关信息的基础上,包括饲养数量、饲养方式、免疫接种、发病时间、病程进展、用药情况、发病率与病死率等,以及发病时的临床表现和病理剖检变化,利用常规细菌学鉴定方法,对采集的4头发病猪病料组织进行细菌分离培养与APP分离菌的生物型确定,应用PCR技术对分离菌进行APP及其血清型鉴定、毒力基因检测以及分离菌之间亲缘关系的确定。检测结果表明,4份病料均分离出APP,且同为生物Ⅰ型、血清8型菌株,均检测到毒力基因Omp2和ApxⅣ而无ApxⅡ、ApxⅢ,菌株之间的Omp2和ApxⅣ基因核苷酸序列相似度达100%,并处于系统发育树的同一分支,4株APP分离菌高度同源,该猪场后备母猪出现的APP感染为同一菌株。APP血清型众多,分布广泛,不同国家和地区流行的优势血清型存在差异,即使是同一地区也会随时间的迁移而发生变化。在国外,欧洲以2、3、7、8和9型为主;北美地区以1、3、5和7型为主;日本、韩国则以2、4和5型为主。1995—2004年韩国以血清2、5型最为流行,但至2012—2013年血清1、5型呈现优势。在国内,优势血清型多集中于7、1和3型,其次为5、11、10和13型。山东地区以5、7和10型为主;湖北地区以13、1和11型为主;广东地区以3、10型为主[6]。1996—2000年,多个省份地区血清1、3和7型处于优势,2015—2018年,在流行的APP血清型中又增加了5、10、11和13型[7]。本试验APP分离株为血清8型,尽管与目前主要的流行血清型不同,且相关报道不多,但由于APP各血清型之间交互免疫力差,现有的商品化疫苗不能对其感染提供保护,因此该血清型的出现应引起高度重视,实时监测APP血清型的动态流行情况,对于APP疫苗的研发以及预防该菌的感染具有重要意义。
对PCP的综合防制措施主要包括加强饲养管理、药物防治、预防接种等。免疫接种是预防本病的有效方法,但要根据具体情况选择含有相对应APP血清型的疫苗。对受威胁但未发病的猪群,可以进行预防性给药。对于发病猪群,早期及时治疗是有效降低损失的方法。药敏试验结果显示,4株APP分离株对环丙沙星、诺氟沙星、氟苯尼考、氧氟沙星、头孢唑林和头孢曲松均100%敏感,可作为首选治疗药物,对青霉素、卡那霉素和四环素均100%耐药,对链霉素、庆大霉素、丁胺卡那、复方新诺明、多西环素、红霉素、阿莫西林和氨苄西林的耐药率介于25%~75%。研究显示,65株韩国分离株对头孢噻呋、阿米卡星敏感,对四环素耐药;148株塞尔维亚分离株对头孢噻呋、恩诺沙星、氟苯尼考敏感,对四环素和链霉素耐药;我国河南地区APP分离株对泰妙菌素、氨苄西林和头孢噻呋钠等6种药物敏感,对替米考星、红霉素、氟苯尼考等20种抗菌药物完全耐药,西南地区APP分离株对阿莫西林、头孢噻肟和青霉素敏感,对氟苯尼考、替米考星和四环素等9种药物耐受[8-10]。至此表明不同国家和地区APP分离株对抗菌药物的感受性存在差异。由于不同地区、不同养猪场,即使同一养猪场在不同时间,其用药方法有所不同,出现因抗生素的选择压力而导致APP对药物的敏感性不同。因此,针对APP分离菌株进行药敏试验以选择合适药物意义显著。此外,本试验源自4头病猪的APP分离株虽鉴定为同一菌株,但4株菌对链霉素、庆大霉素、丁胺卡那、复方新诺明、多西环素、红霉素、阿莫西林和氨苄西林等8种抗生素的感受性有一定差异,这可能是由于抗生素的长期使用,引致环境中抗生素抗性基因(ARGs)丰度增高,而ARGs之间水平基因的不规则转移可加速APP的抗性获得,导致耐药差异性的出现。
