前列腺原发性鳞状细胞癌伴导管内癌1例并文献复习
2021-02-10廖忠鸿刘启航胡科翱陈李葵曹润福
廖忠鸿,刘启航,胡科翱,陈李葵,曹润福
(南昌大学第一附属医院泌尿外科,南昌 330006)
前列腺原发性鳞状细胞癌(prostate squamous cell carcinoma,PSCC)临床罕见,发生率约占前列腺癌的0.25%~1%[1]。前列腺导管内癌(intraductal carcinoma of the prostate,IDC-P)在2016版世界卫生组织(WHO)泌尿和男性生殖系统肿瘤分类中单独列出,定义为前列腺癌的一种新实体亚型[2]。PSCC伴IDC-P的患者临床更是罕见。2020年11月12日南昌大学第一附属医院诊断出1例前列腺原发性鳞状细胞癌伴导管内癌患者,现结合文献和回访结果对其临床资料进行回顾性分析,以提高对该罕见病的认识。
1 临床资料
患者,男,66岁。因进行性排尿困难5个月,于2020年11月12日入本院。既往有脑出血病史,无激素治疗、放射治疗等特殊病史。全身体格检查无特殊。直肠指诊:前列腺Ⅱ度增生,中央沟变浅,无触痛及波动感,未触及明显结节,质中,表面部光滑,指套无染血。
前列腺MRI(平扫+波谱)示:前列腺体积增大,大小约4.5 cm×4.8 cm×5.1 cm,中央带及左侧外周带见不规则团块状T2信号减低区,部分突破包膜,DWI呈高信号,ADC呈低信号,波谱可见明显倒置峰改变;盆腔内未见明显肿大淋巴结。全身骨平面显像示(图1A):全身骨显像清晰,右侧骶髂关节、右侧耻骨及坐骨见异常核素分布浓聚灶,考虑骨转移改变征象。胸部CT平扫示:两肺多发低危小结节。实验室检查示:TPSA 27.32 ng·mL-1;FPSA 4.37 ng·mL-1;尿液隐血;尿液白细胞酯酶。心电图正常。经直肠彩超穿刺13针活检病理(图2):(前列腺左外上、左外中、左外下、左内上、左内中、右内上)鳞状细胞癌;(左内下)导管内癌;(可疑区)鳞状细胞癌,期间可见极少许导管内癌成分;其余为增生性病变。“左外下组织中鳞状细胞癌成分”免疫组织化学示:P40(+);CK5/6(+);P63(+);Ki-67(40%+);UroplakinⅢ(-);P504S(-);GATA-3(-);PSA(-)。“左内下组织中导管内癌成分”免疫组织化学示:PSA(+);P504S(+);P40(基底细胞+);P63(基底细胞+);Ki-67(10%+);GATA-3(-);UroplakinⅢ(-)。“可疑区组织中导管内癌成分”免疫组织化学示:PSA(+);P504S(+);P40(基底细胞+);P63(基底细胞+)。
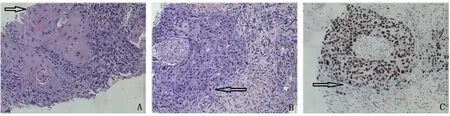
A:癌细胞异型性明显,胞浆丰富、嗜酸性,核大小不一且形态不规则,可见细胞间桥形成(箭头示癌细胞,HE,×400);B:癌细胞沿着正常的前列腺导管内生长(箭头示癌细胞和正常导管的边界,HE,×400);C:免疫组织化学表现:癌细胞P40强阳性(箭头示癌细胞和正常导管的边界,×200)。
确诊后患者前往外院行机器人辅助腹腔镜下前列腺癌根治性切除术,术后病理与穿刺病理结果一致。术后患者拒绝进一步的化疗等综合治疗方案,药物去势采用每28 d注射醋酸亮丙瑞林微球3.75 mg。术后第2个月复查TPSA为1.02 ng·mL-1,此后6个月内复查的TPSA均在0.50 ng·mL-1上下波动。术后第6个月行全身骨平面显像(图1B)显示骨转移病灶数量较术前未增加。当前患者病情尚处于稳定状态,可能与其疾病发现较早并及时行减瘤手术有关。但此疾病一旦发生进展,病情加重速度非常快,所以强烈建议其接受进一步化疗等多模式的综合治疗。
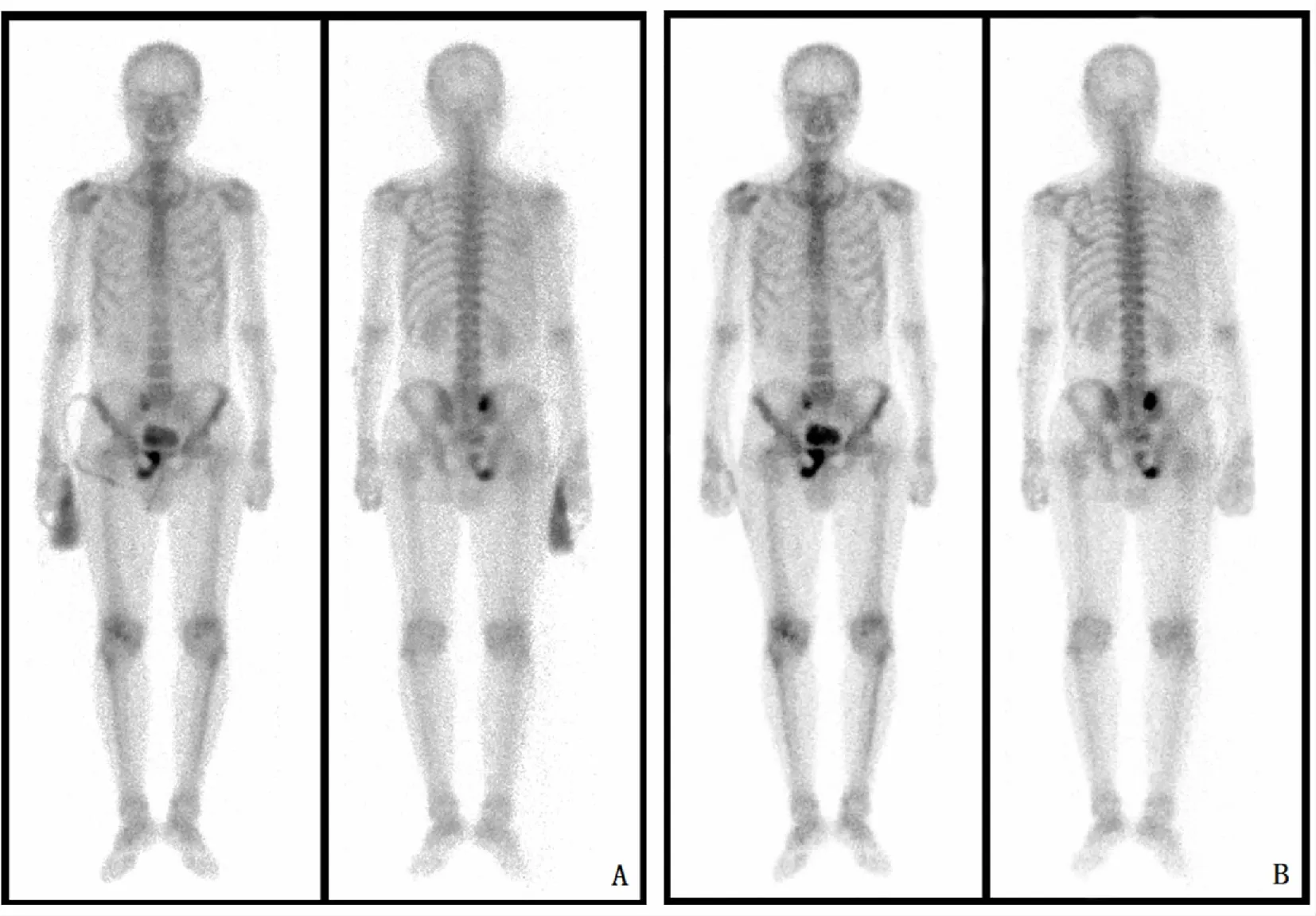
A:术前全身骨平面显像;B:术后6个月复查全身骨平面显像(右侧骶髂关节、右侧耻骨及坐骨代谢增高,考虑骨转移改变征象)。
2 讨论
前列腺癌以腺癌为主,约占97%,PSCC临床非常罕见[1],其平均发病年龄为59岁[3]。MOTT在1979年总结出第一个被大部分学者认可的PSCC组织学特征的定义:1)高侵袭性、生长失调、细胞发育不良的典型的恶性肿瘤特征;2)有角化珠、螺旋巢状结构,或有各异的细胞间桥的鳞状上皮特征;3)无腺状或腺泡形态;4)无雌激素治疗史;5)其他脏器,特别是膀胱中没有原发性鳞癌[1]。PSCC的组织来源长期以来一直是个争论的话题。THOMPSON等[4]认为其组织来源有两个:一个是来源于尿道前列腺部的移行上皮,另一个是来源于前列腺上皮细胞的化生,但来源于后者的可能性较小。目前还没有明确的证据表明PSCC可来源于鳞状化生[5]。近年来也有学者认为其来源可能是前列腺腺泡的基底细胞或尿道周围导管的移行上皮细胞[6]。IDC-P的概念在1973年被首次提出,它当时是泛指各种病理类型的前列腺癌沿着前列腺导管和腺泡内生长的情况[7]。后来研究发现其是在邻近的正常导管和腺泡内播散[8]。随着大家对IDC-P认识的深入,WHO在2016年将其定义为腺泡内或导管内上皮细胞表现出部分高级别上皮内瘤变特征的增生,但其异形性更高[2]。IDC-P有3个可能的来源:原发、高级别上皮内瘤变的进展;腺泡腺癌向导管的侵袭[9]。大部分的IDC-P周围常伴有Gleason评分>4分的浸润性癌,有研究[10-12]表明,前列腺穿刺标本中单纯IDC-P仅占0.06%~0.26%,而且其术后标本中仅仅只有10%是单纯IDC-P。有研究[13]指出,IDC-P通常代表进展期的前列腺癌,且是前列腺癌患者独立的预后指标。
PSCC的临床特征不明显,一项基于22例病例的研究[6]认为患者的临床表现主要包括进行性的排尿困难、急性尿潴留、血尿、下尿路症状和转移相关的骨痛。PSCC患者的血清PSA和酸性磷酸酶通常不增高[14],其直肠指诊常可触及质地较硬的前列腺结节。因此,对于血PSA值正常的患者不应该排外前列腺癌的可能,如果其直肠指诊或影像学检查结果高度怀疑前列腺肿瘤,应行穿刺活检以明确诊断。IDC-P患者血PSA通常增高,临床表现主要以伴发癌为主。PSCC对内分泌治疗是无效的,这可能与其组织来源有关[1]。目前,PSCC理想的治疗方案尚未达成共识。临床上对于肿瘤局限在前列腺的患者应争取行前列腺根治性切除术加扩大的盆腔淋巴结清扫术。对于肿瘤已经侵犯外周组织或转移的患者,可先进行调强适形放射治疗再进行化疗,这可以改善患者的症状并延长其生存时间[15]。PSCC预后较差,MALIK等[6]研究显示其平均生存时间约11.9个月,而PSCC伴IDC-P则代表患者的预后要更差。目前,对于PSCC伴IDC-P尚无明确的规范化治疗方案,应不断探索手术、化疗、放疗等多模式的综合治疗方案,以延长该类患者的生存时间。
