基于TCGA数据库分析PODNL1基因在肾透明细胞癌中的表达及临床价值
2021-02-10熊世达何文瑞
丁 亿,熊世达,邓 文,何文瑞,郭 炬
(南昌大学a.研究生院医学部2019级;b.研究生院医学部2018级;c.第一附属医院泌尿外科,南昌 330006)
肾细胞癌是来源于肾小管上皮细胞的异质性癌症,占所有癌症发病率的3%~5%[1],其组织学亚型有肾透明细胞癌(kidney renal clear cell carcinomas,KIRC)、肾乳头状细胞癌和肾嫌色细胞癌。KIRC为主要的组织学亚型,约占所有肾癌患者的70%~75%[2]。临床上大多数KIRC患者对长期使用化疗或放疗易产生耐受,故手术切除是其目前的主要治疗方法。此外,约有1/3的KIRC早期确诊患者伴有局部或远处转移,故虽经手术治疗达到临床治愈,仍约有1/4的患者在术后随访中发生远处复发[3-5]。KIRC患者的复发和转移与其不良预后相关[2,6],因此,寻找新的有效的分子标记物,对改善患者的预后具有重要意义。
有研究[7]指出,Podocan样1(PODNL1)蛋白具有信号肽,1个富含半胱氨酸的N端簇,21个富含氨基酸的重复基序和1个假定的N-糖基化位点,在蛋白结构上类似于Podocan的蛋白,是富含亮氨酸的小重复蛋白聚糖(SLRPs)家族的成员之一。有研究[8]发现,PODNL1在神经胶质瘤中高表达并且能够影响其生物学功能。然而,关于PODNL1在KIRC中的表达、与临床预后的相关性及分子机制目前尚未见报道。因此,本研究通过数据挖掘癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库,分析PODNL1在KIRC中的表达和预后价值,并利用基因集富集分析(GSEA)预测其可能的分子机制,旨在为KIRC筛选可靠的分子靶标提供线索和依据。
1 资料与方法
1.1 资料来源
从TCGA数据库(http://www.tcga.org/)中下载KIRC的mRNA数据和相关共获得KIRC患者组织样本539例,正常组织样本72例作为对照。使用R 4.0.4软件提取PODNL1在KIRC组织和正常组织中的表达情况,通过WilCox检验比较2组PODNL1的表达;采用WilCox检验对72对KIRC组织和正常组织中的PODNL1的表达进行配对差异分析。此外,从下载的临床数据中分别提取患者的临床资料,包括年龄、性别、生存时间、生存状态、肿瘤分级、临床分期、TNM分期。
1.2 方法
1.2.1 PODNL1的表达及其与KIRC患者预后关系的分析
根据PODNL1表达在KIRC组织中表达的中位值,将KIRC患者分为2组:高表达组和低表达组。利用R软件,通过WilCoxon符号秩检验和逻辑回归分析PODNL1基因表达与患者临床参数的关系,包括肿瘤分级、临床分期、肿瘤浸润深度、淋巴结浸润、远处转移;采用Kaplan-Meier生存分析2组的总体生存率(overall survival,OS),采用单因素和多因素Cox回归分析与患者预后相关的临床因素,并分析PODNL1基因在KIRC预后评估中的价值。
1.2.2 实时荧光定量PCR检测PODNL1基因在各细胞系中的mRNA表达水平
体外培养正常肾小管上皮细胞系HK2和KIRC细胞系A-498、786-O、ACHN、OSRC-2,细胞/组织中总RNA提取试剂(诺唯赞生物科技公司)提取细胞总RNA,HiFiScript cDNA Synthesis Kit(康为世纪生物科技公司)将其逆转录为cDNA,SYBR Green qPCR Master Mix(High ROX)(赛维尔生物科技公司)进行扩增,采用2-△△Ct方法对估计值进行验证。PODNL1基因引物序列为上游引物:3′-CAACGGTGCTGTGACTCTG-5′;下游引物:3′-CCCTGCCCATGTACCCT-5′。ACTIN引物序列为上游引物:3′-TCTCCCAAGTCCACACAGG-5′;下游引物:3′-GGCACGAAGGCTCATCA-5′。
1.2.3 基因富集分析
基因富集分析(gene set enrichment analysis,GSEA)是一种在基因集的水平上研究微阵列数据的计算方法[9]。在本研究中,GSEA被用来确定PODNL1高表达组与低表达组之间的差异。以PODNL1表达作为表型标记,利用GSEA 4.1.0软件进行KEGG通路富集分析,并将随机组合次数设置为1000次。以标准化富集分数(NES)的绝对值大于1,正常P<0.05和错误发现率小于0.25的基因集为富集标准。
1.2.4 统计学方法
使用R 4.0.4软件进行数据处理。使用WilCox检验分析PODNL1在KIRC组织和正常组织中的表达差异;WilCoxon符号秩检验和逻辑回归分析PODNL1与患者临床病理参数的关系;生存分析使用Kaplan-Meier方法;使用单因素Cox回归分析总生存率(OS)与临床相关因素之间的关系;采用多因素Cox分析,筛选独立预后因素。用t检验比较PODNL1基因在KIRC细胞系和正常细胞系中的表达差异。以P<0.05为差异有统计学意义。
2 结果
2.1 PODNL1在KIRC组织和细胞系中的表达
与正常组织比较,PODNL1在KIRC组织中的表达显著上调(P<0.001)。见图1A。72对配对的KIRC组织和正常组织中PODNL1表达分析亦显示,PODNL1基因在KIRC组织中的表达显著上调(P=0.003)。见图1B。RT-qPCR结果显示,与HK2细胞比较,4种癌细胞系中PODNL1的mRNA相对表达量均更高,差异具有统计学意义(均P<0.05)。见图2。
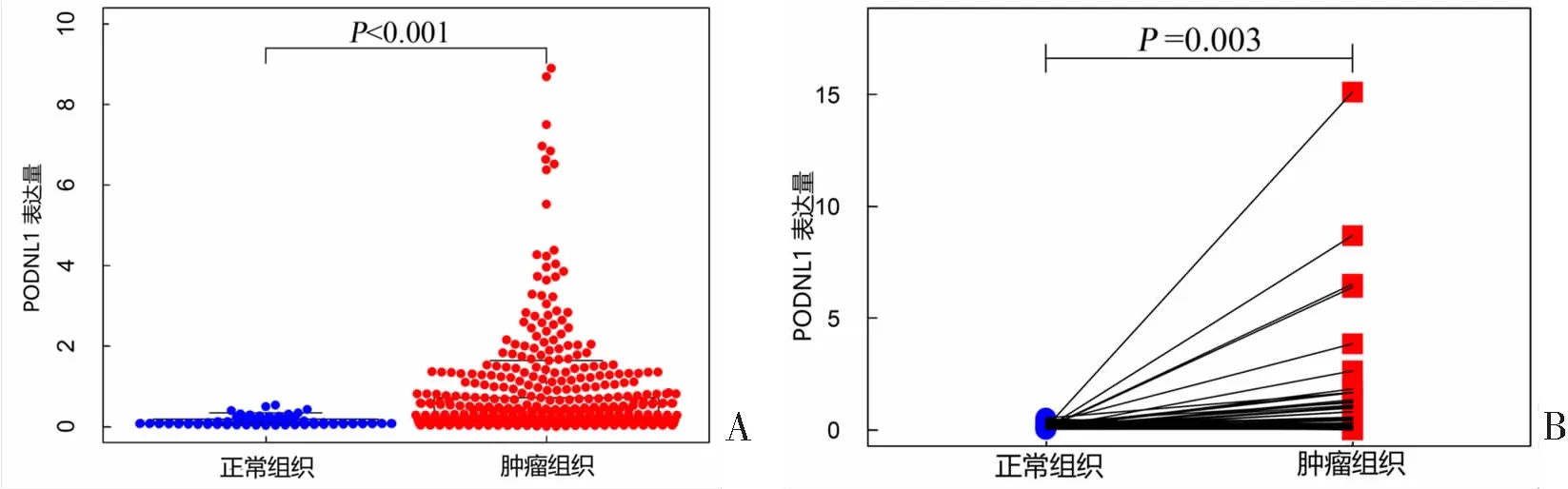
A:PODNL1基因在肾脏正常组织和KIRC组织中的表达比较;B:72对配对的KIRC组织和癌旁组织中PODNL1的表达比较。

*P<0.05,**P<0.01,***P<0.001,与HK2细胞比较。
2.2 PODNL1的表达与KIRC患者临床病理参数的关系
PODNL1在KIRC患者中的表达与肿瘤分级(P<0.001)、临床分期(P<0.001)、肿瘤浸润深度(P<0.001)、淋巴结浸润(P=0.001)、远处转移(P=0.001)均显著相关。见图3。逻辑回归分析结果亦显示PODNL1表达与临床病理参数显著相关。见表1。

A:肿瘤分级(grade);B:临床分期(stage);C:肿瘤浸润深度(T);D:淋巴结转移(N);E:远处转移(M)。
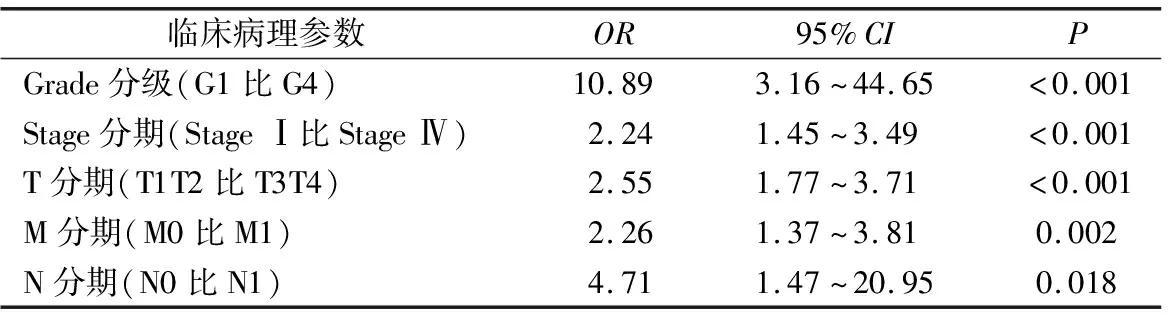
表1 PODNL1表达与KIRC患者临床病理参数的关系
2.3 PODNL1表达与患者OS、预后的关系
Kaplan-Meier生存分析结果(图4A)显示,KIRC组织中高表达组的总体生存率显著低于低表达组(P<0.001)。单因素Cox回归分析结果显示,PODNL1的表达、年龄、肿瘤分级(grade)、临床分期(stage)、TNM分期与患者的生存相关(均P<0.05);多因素Cox回归分析结果显示,年龄、肿瘤分级(grade)和PODNL1表达均可作为KIRC预后的独立风险因子。见表2。
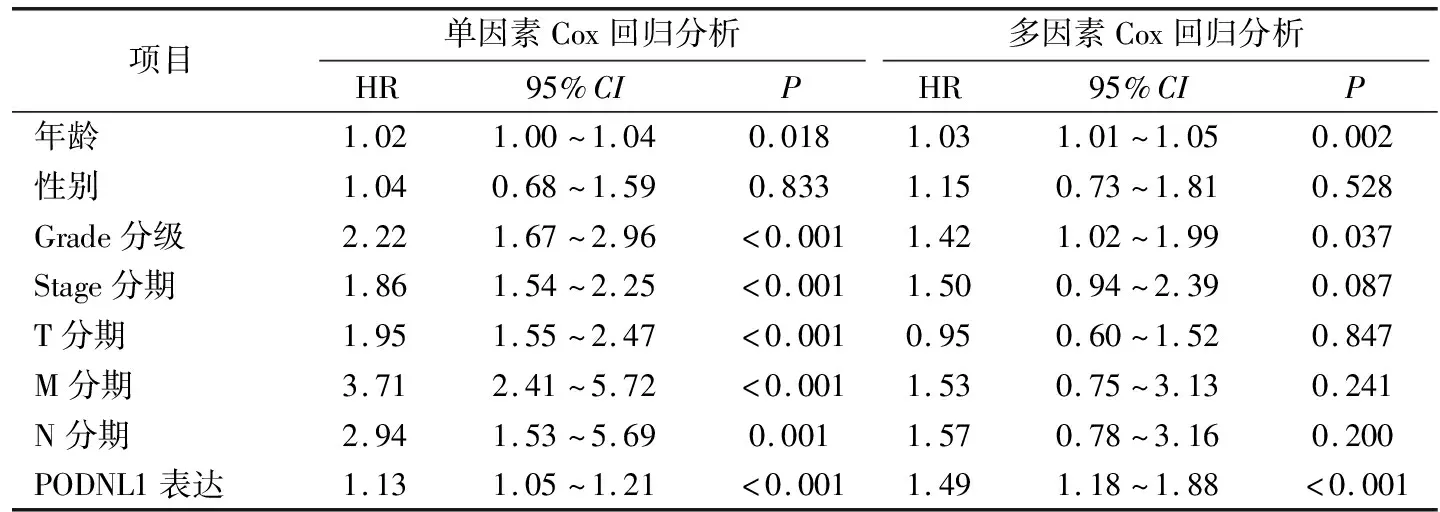
表2 单因素和多因素Cox回归分析
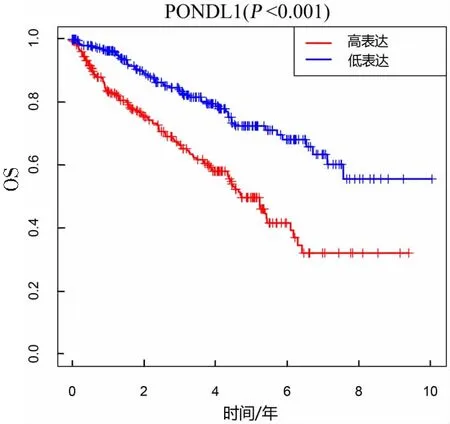
图4 PODNL1表达与KIRC患者OS的关系
2.4 GSEA富集分析
GSEA富集分析结果显示,在PODNL1高表达组中,筛选出了9条与细胞黏附和肿瘤发生相关的重要信号通路显著上调,包括细胞外基质受体相互作用、钙信号通路、局部性粘连、Hh信号通路、P53信号通路,NOTCH信号通路、MAPK信号通路、VEGF信号通路和肿瘤相关通路。见图5。

图5 GSEA富集分析KIRC中PODNL1高表达激活的信号通路
3 讨论
富含亮氨酸重复序列的小分子蛋白聚糖家族(SLPRs)是蛋白聚糖的一个特殊亚群,参与细胞生长和信号传导的关键调节剂[10]。SLPRs广泛存在于细胞外基质中,在各种癌症中具有潜在的调控肿瘤细胞增殖、血管生成和迁移的作用[11-12]。而Podocan样1(PODNL1)蛋白作为SLRPs的V类成员[13],2011年首次被发现其存在于成骨细胞和新形成的骨骼中[7]。近年来,PODNL1在肿瘤的发生发展中的作用被不少研究者关注。例如,TENG等[14]指出PODNL1可作为卵巢癌预后的生物标记物。在神经胶质瘤中PODNL1的表达与患者的预后呈负相关,并可通过调节Akt/mTOR途径促进神经胶质瘤细胞增殖、迁移[8,15-16]。
本研究基于TCGA数据库的分析发现,PODNL1基因在KIRC组织中表达显著上调;同时,本研究发现PODNL1基因的mRNA表达水平在正常肾小管上皮细胞系显著低于肾癌细胞系。此外,PODNL1的表达与KIRC患者的肿瘤分级、临床分期和TNM分期相关,提示PODNL1参与KIRC的恶性进展;PODNL1的表达与患者的总体生存率呈负相关,单因素和多因素Cox回归分析表明PODNL1是KIRC的独立预后因子,提示PODNL1与患者的预后有关。而且,利用TCGA数据库下载的数据进行GSEA富集分析,结果发现多个肿瘤相关通路在PODNL1高表达组织样本中均有不同程度的富集。其中,细胞外基质受体相互作用已经证明参与包括肾癌在内的多种癌症细胞的增殖和侵袭[17];NOTCH信号通路异常激活后参与维持KIRC的干性功能特性[18];抑制VEGF途径是转移性KIRC的分子靶向治疗的关键点之一[19]。尽管PODNL1与这些肿瘤信号通路的关系尚未明确,但GSEA富集分析结果提示PODNL1高表达可能是促进肾癌细胞增殖和KIRC恶性进展的重要因子。此外,虽然通过上述生物信息学分析显示PODNL1基因是KIRC的独立预后分子标记物,但二者之间的确切关系及PODNL1与KIRC的作用与机制,仍需通过临床前和临床实验进行验证。
综上所述,PODNL1基因在KIRC组织中呈高表达,并与KIRC的恶性进展相关,可能是预测患者预后的分子标记物。
