铁代谢对代谢综合征患者认知功能的影响
2021-02-06章丹曾婷婷傅圣勇卢晔芬
章丹 曾婷婷 傅圣勇 卢晔芬
代谢综合征(MS)是以多种心脑血管疾病危险因素为特征的综合性疾病,在我国的发病率为10%~26.4%[1-2]。轻度认知障碍(MCI)作为老年化过渡至痴呆的早期病理变化,对其治疗是防治阿兹海默病的重要环节。现代研究表明,代谢综合征可增加患者认知功能障碍的风险[3-5],海马神经元丢失、退变等痴呆表现的同时伴有铁转运蛋白表达异常,由此推测铁代谢异常可能与认知功能的退化有关[6]。本文探讨铁代谢对MS患者认知功能的影响。
1 资料与方法
1.1 临床资料 选取2017年1月至2018年12月本院代谢综合征患者168例。男89例,女79例;年龄50~72岁,平均(61.58±8.97)岁。根据有无轻度认知障碍,分为观察组(MS+MCI组,72例)与对照组(MS组,96例)。本项目经本院医学伦理委员会批准,所有患者均签署知情同意书。纳入标准:(1)年龄≥18岁;(2)符合《中国成人血脂异常防治指南(2016年修订版)》[7]诊断标准,即满足以下≥3项条件:①腹型肥胖:男性腰围≥90 cm,女性≥85 cm;②血甘油三酯≥1.7 mmol/L;③血高密度脂蛋白胆固醇<1.04 mmol/L;④血压≥130/85 mmHg,或接受治疗的高血压;⑤空腹血糖≥6.1 mmol/L,或糖负荷后2 h血糖≥7.8 mmol/L,或接受治疗的糖尿病;(3)MCI患者需符合认知功能障碍诊断标准:①主观症状有记忆力减退;②日常生活活动能力评分<26分;③MMSE评分:初中及以上文化水平评分<27分,小学文化水平<24分,文盲<21分;④MoCA评分<26分;(4)完成研究相关检查项目。排除标准:(1)伴有痴呆、精神疾病、癫痫等精神神经疾病;(2)有脑出血、脑梗塞等脑血管疾病史或脑外伤史;(3)无法配合完成相关量表评估;(4)合并有肝病、肾病、心脏病等其他严重脏腑疾病;(5)合并有大血管疾病;(6)治疗过程中需接受其他神经类或精神类药物者。
1.2 方法 血液检测:治疗前抽取所有患者禁食12 h后空腹静脉血,采用雅培全自动血细胞分析仪(C16000)对血脂(TC、TG、HDL-C、LDL-C等)、空腹葡萄糖(FBG)等指标进行检测;采用比色法评估血清铁含量(SI),采用免疫比浊法测定血清铁蛋白(SF)、转铁蛋白水平(TRF),采用日立全自动生化分析仪(7600)测定总铁结合能力(TIBC)。认知功能测试:采用MMSE、MoCA对患者认知水平进行评估;MMSE总分为30分,<27分为认知功能障碍;MoCA总分为30分,<26分为认知功能异常,受教育年限≤12年加1分。脑铁沉积水平检测:所有患者在带有12通道相控阵头线圈的Siemens Magnetom Verio 3.0 T磁共振仪器上进行检查;首先获取常规MRI序列,以排除其他颅内病变;其次获取SWI图像,并由2名放射科医师画出海马、尾状核头作为ROI;然后通过软件处理得到校正后的相位值(X);最后,以公式Y=-X×π/4096计算出Y值,即脑铁沉积的量化值。ROC分析:以观察组为阳性样本,以对照组为阴性样本,建立ROC诊断分析模型,采用组段建模模式;被分析指标按样本总水平数值范围划分为若干个组段,建立ROC曲线;以软件拟合之ROC曲线读取约登指数最大值点,对应计算理论阈值和敏感度、特异度。
1.3 统计学方法 采用SPSS 23.0统计软件。符合正态分布计量资料以(±s)表示,两组间比较采用成组t检验或校正t检验;不符合正态分布以M(Q1,Q3)表示,两组间比较采用Wilcoxon秩和检验。计数资料以n(%)表示,两组间比较采用χ2检验或校正χ2检验;相关性分析采用Pearson相关性分析法。ROC分析多指标联合应用使用LogP模式,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料与治疗前血液检测指标水平比较 见表1。
表1 两组患者一般资料与治疗前血液检测指标水平比较(±s)
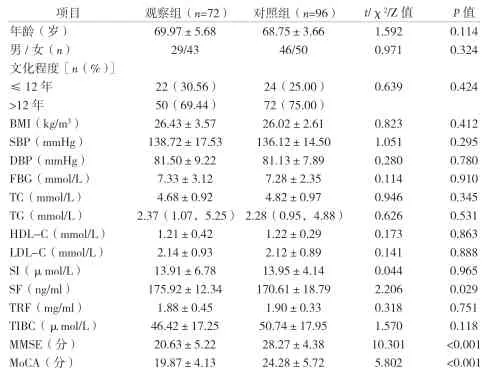
表1 两组患者一般资料与治疗前血液检测指标水平比较(±s)
项目 观察组(n=72) 对照组(n=96) t/χ2/Z值 P值年龄(岁) 69.97±5.68 68.75±3.66 1.592 0.114男/女(n) 29/43 46/50 0.971 0.324文化程度[n(%)]≤12年 22(30.56) 24(25.00) 0.639 0.424>12年 50(69.44) 72(75.00)BMI(kg/m3) 26.43±3.57 26.02±2.61 0.823 0.412 SBP(mmHg) 138.72±17.53 136.12±14.50 1.051 0.295 DBP(mmHg) 81.50±9.22 81.13±7.89 0.280 0.780 FBG(mmol/L) 7.33±3.12 7.28±2.35 0.114 0.910 TC(mmol/L) 4.68±0.92 4.82±0.97 0.946 0.345 TG(mmol/L) 2.37(1.07,5.25)2.28(0.95,4.88) 0.626 0.531 HDL-C(mmol/L) 1.21±0.42 1.22±0.29 0.173 0.863 LDL-C(mmol/L) 2.14±0.93 2.12±0.89 0.141 0.888 SI(μmol/L) 13.91±6.78 13.95±4.14 0.044 0.965 SF(ng/ml) 175.92±12.34 170.61±18.79 2.206 0.029 TRF(mg/ml) 1.88±0.45 1.90±0.33 0.318 0.751 TIBC(μmol/L) 46.42±17.25 50.74±17.95 1.570 0.118 MMSE(分) 20.63±5.22 28.27±4.38 10.301 <0.001 MoCA(分) 19.87±4.13 24.28±5.72 5.802 <0.001
2.2 两组患者脑铁沉积量化值比较 见表2。

表2 两组患者脑铁沉积量化值比较[M(Q1,Q3)]
2.3 脑铁沉积量化值与MMSE评分、血清铁蛋白水平的相关性分析 左、右两侧海马脑铁沉积量化值与MMSE总分呈正相关(P<0.05);血清铁蛋白水平与右侧海马脑铁沉积量化值呈正相关(P<0.05)。见表3、图1。

表3 脑铁沉积量化值与MMSE评分、血清铁蛋白水平的相关性分析
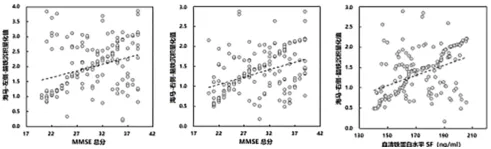
图1 显著相关指标的数据散点图
2.4 脑铁沉积量化值诊断MS患者出现MCI的评估价值ROC分析 见表4、图2。

表4 脑铁沉积量化值诊断MS患者出现MCI的评估价值ROC分析

图2 ROC曲线
3 讨论
MCI作为痴呆前期阶段,可伴有认知功能下降,但日常生活并不会受到较大影响。国外相关流行病学调查显示,>65%的痴呆由MCI进展而来[8],因此尽早诊断MCI,并及时有效干预是控制痴呆发病率的主要手段。而认知功能障碍的发生、发展,可能与脑铁过度沉积密切相关。郑波等[9-10]研究表明,脑铁沉积水平可随年龄增长而增高,痴呆患者脑铁沉积定量较MCI患者明显增高。MS是指人体蛋白质、脂肪、碳水化合物等物质发生代谢紊乱的病理状态,是一组复杂的代谢紊乱症候群,是导致糖尿病心脑血管疾病的危险因素。付棉等[11]研究发现,低HDL-C血症是认知障碍的危险因素,高HDL-C血症是认知功能的保护因素,但未发现MetS作为整体与认知障碍相关。张宁等[12]研究指出,高龄是MS合并MCI不可避免的因素,肥胖、高血压、高TG是MS合并MCI的独立危险因素。杨莉等[13]研究发现,MS合并MCI患者胰岛素抵抗和炎症反应较单纯MS患者更为明显。而血清尿酸作为认知功能障碍/痴呆的一个危险因素,具体作用机制尚不明确[14]。
本资料结果显示,观察组血铁蛋白含量高于对照组,观察组左、右侧海马脑铁沉积水平相比对照组显著升高。以MMSE总分、血清铁蛋白水平作为应变量,对两组患者的脑铁沉积量化值进行Pearson相关性分析,结果提示左、右两侧海马脑铁沉积量化值与MMSE总分呈正相关(P<0.05),血清铁蛋白水平仅与右侧海马脑铁沉积量化值呈正相关(P<0.05),与陈浩等[15]相关研究结果一致。
综上所述,铁代谢异常可能是MS患者认知功能减退的重要原因,因血清铁蛋白仅与右侧海马脑铁沉积量有关,此与认知功能障碍脑铁沉积水平的变化特点不一致,故血清铁代谢不能作为判断脑铁代谢的指标。局灶性脑铁沉积水平与MS患者认知功能评分呈正相关,故脑铁沉积定量分析可为指导、预测MS患者认知功能变化提供依据,而磁共振检测可能是目前评估脑铁代谢水平的唯一手段。但目前脑铁沉积的病理机制尚不明确,无法针对性干预认知功能改变,也无法判断其是否受其他代谢因素的影响,这也是进一步研究的方向。
