大黄䗪虫丸对TGF-β1 干预后A549 细胞增殖的影响
2021-01-30蒋锋利任士杰孙文丽赵明镜张立山
蒋锋利,蔡 松,任士杰,孙文丽,张 晶,赵明镜,张立山
(北京中医药大学东直门医院呼吸科,北京 100029)
关键字:肺络干血;IPF;含药血清;EMT;cck-8
特发性肺纤维化(Idiopathic pulmonary fibrosis,IPF)是一种病因不明、慢性进展、致死性间质性肺疾病,以肺组织中存在“成纤维细胞灶”为特征,它是由成纤维细胞在内的间充质细胞聚集体和能表达a-SMA,并能促进有丝分裂及细胞外基质(ECM)分泌增加的肌成纤维细胞构成[1]。该病隶属于中医“肺痿”“肺痹”范畴,病性为本虚标实。武维屏、姜良铎为代表的肺病专家提出“肺系络病”理论,将本病病机概括为“气虚血瘀、痰热互结、痹阻肺络”[2-3]。基于以上认识,本课题组提出“特发性肺纤维化患者存在肺络干血”的假说,认为“肺络干血是肺纤维化病因,细胞外基质沉积是干血实质”[4]。针对“干血”一证,张仲景治以“缓中补虚”之大黄䗪虫丸,尤在泾将本方治法概括为“润以濡其干,虫以动其瘀,通以去其闭”,此实为仲景治疗“干血”的三大法门。研究[5]证实大黄䗪虫丸对博来霉素致特发性肺纤维化大鼠的保护作用可能通过抑制MMP-2 的产生来实现。本实验选择吡非尼酮作为阳性对照药,通过制备不同浓度大黄䗪虫丸含药血清,对获取的TGF-β1干预48h 后A549 细胞进行Masson 染色,使用cck-8 法观察24 h、48 h、72 h大黄䗪虫丸含药血清对TGF-β1干预后的A549 细胞增殖情况的影响,探索大黄䗪虫丸对IPF 防治作用的更多内在机制,进一步丰富捜剔肺络法防治特发性肺纤维化的学术内涵。
1 材料与方法
1.1 动物与细胞健康SD 雄性大鼠60 只,体质量250~300 g。由北京维通利华试验动物技术有限公司提供,SPF/VAF 级,许可证号:SCXK(京)2016-0006。人肺泡上皮A549 细胞株(中国科学院典型培养物保藏委员会细胞库,北京)。
1.2 药物及试剂大黄䗪虫丸(国药准字:Z11020002,批号:17013170),购自北京同仁堂;吡非尼酮胶囊(国药准字:H20133376,批号:190505),购自北京康蒂尼药业。均在常温干燥处保存。DMEM/F-12培养基(Biological Industries),FBS(Biological Industries),重组人TGF-β1(PeproTech),0.25%Trypsin EDTA(Biological Industries),PBS(Biological Industries),青-链霉素(Caisson Labs),cck-8(北京北仁化学),戊巴比妥钠(中国医药北京公司)。
1.3 主要仪器超净工作台FLC-3型(哈尔滨市东联),二氧化碳培养箱MC0175 型(日本SANYO),离心机5417R 型(德国Eppendorf),倒置显微镜CKX41 型(日本OLYMPUS),全景扫描仪Pannoramic MIDI 型(匈牙利3D HISTECH),酶标仪352 型(芬兰Thermo Multiskan MS)。
1.4 方法
1.4.1 大黄䗪虫丸含药血清的制备及保存 SD 大鼠适应性喂养3 d 后,参考卢磊[6]等人方法,按人与动物等效剂量换算法,分别算得大黄䗪虫丸高、中、低及吡非尼酮给药剂量为1.8、0.9、0.4 5、0.18 mg·kg-1·d-1,以上剂量分别各给10 只SD 大鼠灌服,每日1 次,持续7 d。末次给药1 h 后,3%戊巴比妥钠(0.15 mL·100 g-1)腹腔内麻醉,无菌条件腹主动脉取血,冰上静置2 h,4℃,3 000 r·min-1离心15 min 取上清,分装并标记,56℃灭活30 min,-80 ℃快速冻固保存,待用。剩余20 只SD 大鼠灌以等量等渗盐水,以同样方法制备空白血清并保存,待用。
1.4.2 IPF 细胞模型的建立 参照Kasai H 等的方法复制特发性肺纤维化细胞模型[7]。实验分为空白对照组(K 组)、模型组(M 组)。收集对数生长期A549细胞,调整细胞悬液浓度至5×104·mL-1,每孔2 mL接种于12 孔板,2 组均设3 个复孔,边缘孔用无菌PBS 填充,37 ℃、5%CO2条件下,培养24 h,换用无血清DMEM/F-12 培养基,继续培养24 h,换液,K 组每孔加入2 mL 培养基,M 组每孔加入2 mL 含TGF-β1(5 ng·mL-1)培养基,继续培养48 h,倒置显微镜下拍照,见图1。
1.4.3 Masson 染色 重复1.4.2 中分组及实验过程,获取TGF-β1(5 ng·mL-1)干预48 h 后A549 细胞。0.01 mol·L-1无菌PBS 将K 组、M 组分别洗板3 次×2 min,4%的多聚甲醛室温固定15 min,0.01 mol·L-1无菌PBS 将K 组、M 组分别洗板3 次×2 min,常规Masson 染色后,全景扫描仪记录图像,见图2。
1.4.4 实验分组及cck8 法观察各组细胞生长情况 选择吡非尼酮作为阳性对照药。实验分为空白对照组(K组)、模型组(M 组)、西药组(P 组)、模型+大黄䗪虫丸含药血清大剂量组(D 组)、模型+大黄䗪虫丸含药血清中剂量组(Z 组)、模型+大黄䗪虫丸含药血清小剂量组(X组)。收集对数生长期A549细胞,调整细胞悬液浓度至5×104·mL-1,每孔100 uL 接种于96 孔板,各组均设6 个复孔,边缘孔用0.01 mol·L-1无菌PBS 填充,37℃,5% CO2条件下培养。24 h 后,换用无血清DMEM/F-12 培养基,继续培养24 h,吸弃孔内培养基,加入100 uL 对应的10%含药血清及含5 ng·mL-1的TGF-β1培养基。分别于24 h、48 h、72 h 后,尽量吸弃孔内培养基,统一加入含10% cck-8无血清培养基100 uL,37 ℃继续培养1.5 h,酶标仪450 nm 波长处检测并记录OD 值,计算各实验组增殖率,过程需注意避光。增殖率(%)=(给药组-空白组)OD 值/空白组OD 值×100%。
1.5 统计学方法采用SPSS 25.0 软件进行分析,满足正态分布且方差齐的计量资料以均数±标准差()表示,组间比较采用单因素方差分析(One-Way ANOVA),两两比较采用LSD,以P<0.05 为差异有统计学意义。
2 结果
2.1 特发性肺纤维化细胞模型的鉴定倒置显微镜下,M 组A549 细胞经TGF-β1诱导,形态逐渐由鹅卵石状变为伸长的纺锤形或梭形,细胞圆形度降低,与成纤维细胞、肌纤维母细胞形态相似。图1 为TGF-β1干预A549 细胞48 h 细胞形态。Masson 三色染色法是胶原纤维染色经典而又权威的技术方法。该法染色原理与阴离子燃料分子的大小和组织的渗透有关,小分子量易穿透结构致密、渗透性低的组织;而大分子量则只能进入结构疏松、渗透性高的组织。因此Masson染色后肌纤维呈红色,胶原纤维呈绿色或蓝色,胞核呈蓝褐色。图2 为TGF-β1干预A549 细胞48 h 后Masson 染色结果,结合图1 说明发生EMT,即特发性肺纤维化细胞模型成功。

图1 TGF-β1 诱导A549 细胞48 h(白光片,×400)

图2 TGF-β1 诱导A549 细胞48 h 后Masson 染色(全景扫描仪,×400)
2.2 大黄䗪虫丸含药血清对TGF-β1 干预后A549 细胞的增殖率影响见表1。
表1 大黄䗪虫丸含药血清对TGF-β1 干预后A549 细胞的增殖率影响(,n=6) %
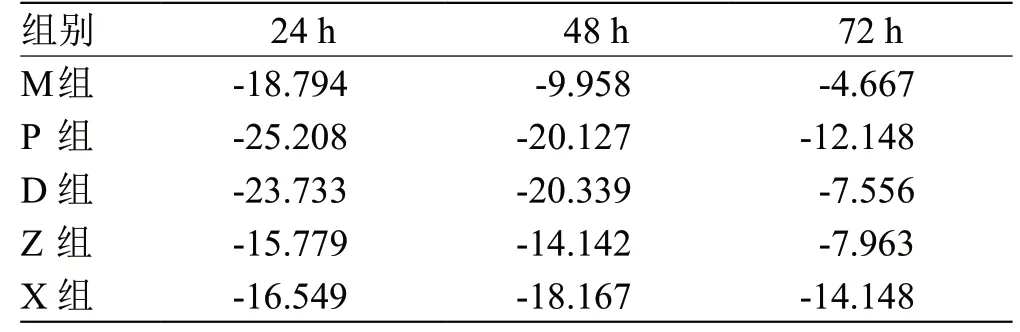
表1 大黄䗪虫丸含药血清对TGF-β1 干预后A549 细胞的增殖率影响(,n=6) %
注:与K 组比较,正值为促进作用,负值为抑制作用
2.3 大黄䗪虫丸含药血清对TGF-β1 干预后A549 细胞的增殖OD 值影响见表2。
表2 大黄䗪虫丸含药血清对TGF-β1 干预后A549 细胞的增殖OD 值影响(,n=6)

表2 大黄䗪虫丸含药血清对TGF-β1 干预后A549 细胞的增殖OD 值影响(,n=6)
注:与P 组比较,# P<0.05,## P<0.01;与K 组比较,△P<0.05,△△P<0.01;与M 组比较,▲P<0.05,▲▲P<0.01
3 讨论
如表1、表2 中所示结果,24 h 时,K 组所得OD值最高,且与其他各组比较均有显著性差异(P<0.01),可能与经TGF-β1诱导后A549 细胞发生EMT,部分肺腺癌细胞变为间充质细胞后,增殖能力降低有关;各组所得增殖率依次为Z 组、X 组、M 组、D 组、P 组,各组对比有差异,但无统计学意义(P≥0.05),提示TGF-β1干预24 h 后A549 细胞未发生EMT,可认为是特发性肺纤维化发病早期。48 h 时,K 组所得OD值均高于其他各组,且与之相比均有显著性差异(P<0.01);各组所得增殖率依次为M组、Z组、X组、P组、D 组,与M 组相比,除Z 组无统计学意义外,其他各组均有显著性差异,提示TGF-β1干预48 h 后A549 细胞部分发生EMT[8],可认为是特发性肺纤维化发病中期,各药物组对该期特发性肺纤维化保护作用较早期明显。72 h 时,K 组所得OD 值仍最高,但与M 组无统计学差异,可能与A549 细胞生长过快,培养基消耗太多,影响其增殖有关;各组所得增殖率依次为M组、D 组、Z 组、P 组、X 组,与M 组相比,X 组、P组有显著性差异,提示TGF-β1干预72 h 后的A549 细胞已全部发生EMT,可认为是特发性肺纤维化发病晚期,各药物组对本期特发性肺纤维化保护作用最明显,且以X 组最优。
24 h 时,K 组与其他组比较均有显著性差异,且48 h、72 h 时,P 组、D 组、Z 组及X 组对TGF-β1干预后A549 细胞增殖率均不同程度高于M 组。提示各实验组不仅不同程度阻断或逆转了TGF-β1诱导的EMT,对A549 细胞也具有一定杀伤作用,即吡非尼酮与大黄䗪虫丸亦具有不同程度的抗肿瘤效用[9-10],亦从实验角度验证了中医“一方多病”的科学[11-12]。原文方后注曰“上十二味,炼蜜和丸小豆大,酒饮服五丸,日三服”[13]。在本实验中,为方便对大鼠进行灌胃,由“丸”改“汤”,亦未用酒,得到大黄䗪虫丸抗纤维化作用以中小剂量使用为佳的结果。临床应用本方时,用量选择上自不能以此作为主要依据,仍需临证综合考量。
EMT 在多种病理过程中发挥着重要作用,它可能是致病间充质细胞主要来源[14]。TGF-β1是一种多功能细胞因子,具有促进细胞增殖、分化、凋亡及ECM形成等生物活性[15-16],被认为是诱导包括肺在内诸多脏器纤维化的“主开关”[17]。TGF-β1首先被描述为正常乳腺上皮细胞中发生EMT 的诱导剂[18],之后的研究中,TGF-β1作为EMT 诱导剂在包括肝脏、肾近端小管、晶状体等上皮细胞中亦被证实[19]。在特发性肺纤维化动物模型中,模型组TGF-β1分泌量显著高于正常组,并加速了特发性肺纤维化的疾病进程[20-21],在体外可以促进成纤维细胞向肌成纤维细胞转变,促进EMT,保护成纤维细胞免于凋亡和促进活性氧(ROS)的产生[22]。
在特发性肺纤维化进展过程中,肺泡及气道上皮中均发现EMT 存在,其中,肺泡上皮(AEC)是肺纤维化的主要致病介质[23-24]。考虑到AEC 损伤在特发性肺纤维化过程中的重要作用及可塑性,前期关于体内外发生EMT 潜力的相关实验表明,小鼠AEC 和AT2细胞系在含TGF-β1细胞培养基中均发生了EMT[25]。Yasuoka H 等[26]的研究表明,过表达IGFBP-5 小鼠纤维化模型的肺中AEC 共表达了E-cad 和a-SMA,提示存在EMT。特发性肺纤维化患者肺中活化AEC 可以合成分泌多种促凝血因子(如PAI-1/2)、促纤维化因子(如TGF-β、TNF-α、PDGF),这些细胞因子可以在AEC 和成纤维细胞之间相互传递信号,进而影响到彼此的增殖和凋亡[27]。特发性肺纤维化患者肺活检中,发现纤维母细胞灶80%以上增生上皮细胞中共表达上皮(Nkx2.1、促生蛋白B)和间充质(a-SMA)标志,提示EMT 是体内发生特发性肺纤维化的重要病理过程,且指出该过程受ECM 调节[28]。此外,Ward 等[29]在研究中发现,取自临床稳定的肺移植受体气道上皮细胞具有EMT 特征。
综上所述,AEC 损伤与重塑及TGF-β1诱导EMT在特发性肺纤维化发病过程中起到至关重要的作用。特发性肺纤维化患者中位生存期约2.8 年,被称为“类肿瘤疾病”,治疗上除氧疗和肺移植外,包括吡非尼酮及尼达尼布在内,尚无具有确切疗效的药物,这一现状急需改变[30]。本实验结果表明,大黄䗪虫丸对特发性肺纤维化的保护机制可能与不同程度阻断或逆转了TGF-β1诱导的EMT 有关。这也为大黄䗪虫丸可以作为特发性肺纤维化患者潜在有效治疗药物提供了更多的实验依据。
