代谢工程改造解脂耶氏酵母生产脂肪酸及其衍生物
2021-01-30王凯峰王金鹏韦萍纪晓俊
王凯峰,王金鹏,韦萍,纪晓俊
(南京工业大学生物与制药工程学院,江苏南京211816)
引 言
绿色生物制造利用可再生的生物质资源为原料,将其绿色转化为具有更高附加值的生物基产品,是一种新型的可持续发展的工业模式[1]。近年来,随着人们对资源与环境问题的日益关注,利用微生物生产脂肪酸及其衍生物以代替传统化石和动植物来源的相应产品被认为是绿色生物制造的典范。微生物来源的脂肪酸及其衍生物广泛应用于能源、材料和营养化学品等领域,可用于生产航空燃油、聚合物、增塑剂、润滑剂和食品添加剂等[2]。过去为了摆脱对化石原料的依赖,人们致力于利用动植物来源的油脂来生产这些有用的脂肪酸及其衍生物。然而,由于植物生长受环境、气候等条件影响,动物养殖周期长等问题,使得由动植物生产油脂在原料供应、生产控制方面存在一定的局限性,而利用富含油脂的微生物生产这些产品可以避免这些问题[3]。
更重要的是,随着代谢工程与合成生物学技术的快速发展,使得人们能够充分挖掘微生物的代谢潜能,通过改造细胞内部的代谢途径,构建微生物细胞工厂,人为地调节脂肪酸链长、不饱和度以及胞内油脂总量以生产特定的脂肪酸及其衍生物[4-7]。通过这些微生物细胞工厂合成的脂肪酸及其衍生物被用来替代石油和动植物来源的化学品,广泛应用于能源、材料、营养化学品等领域,提供了一种环境友好、可持续的绿色生物制造途径。
为了实现构建微生物细胞工厂生产这些脂肪酸及其衍生物,研究者们首先在尝试改造模式微生物大肠杆菌和酿酒酵母方面做了大量的工作[4-12]。近年来,解脂耶氏酵母作为一种新型的产油酵母而被广泛关注。与酿酒酵母不同,解脂耶氏酵母油脂含量甚至能够超过其自身细胞干重的80%以上[13]。同时,由于其生物安全性较高[14],可以应用于食品化合物的生产过程。因此,解脂耶氏酵母在生产面向能源、材料和营养化学品的脂肪酸及其衍生物方面具有得天独厚的优势(图1)。加之近年来,其遗传改造工具发展迅速[15],使其有潜力被改造成为高效合成脂肪酸及其衍生物的微生物细胞工厂。本文综述了构建解脂耶氏酵母细胞工厂生产面向能源、材料和营养化学品等脂肪酸及其衍生物的研究进展,着重介绍了构建细胞工厂过程中采用的代谢工程策略与合成生物学技术手段,为今后的研究提供技术参考。
1 解脂耶氏酵母
解脂耶氏酵母是一种二型、非致病酵母,因为其安全、能够在疏水环境中生长以及具有高产油脂的能力,使其成为一种重要的非常规酵母。人们已成功构建解脂耶氏酵母细胞工厂用于生产各种萜类[16-17]、黄酮类[18-19]、聚酮类[20]化合物以及单细胞蛋白[21]和单细胞油脂[3]等。它还被研究用于处理和降解各种污染物,如油、卤代烃、碳氢化合物、硝基化合物和有机磷化合物[22]。
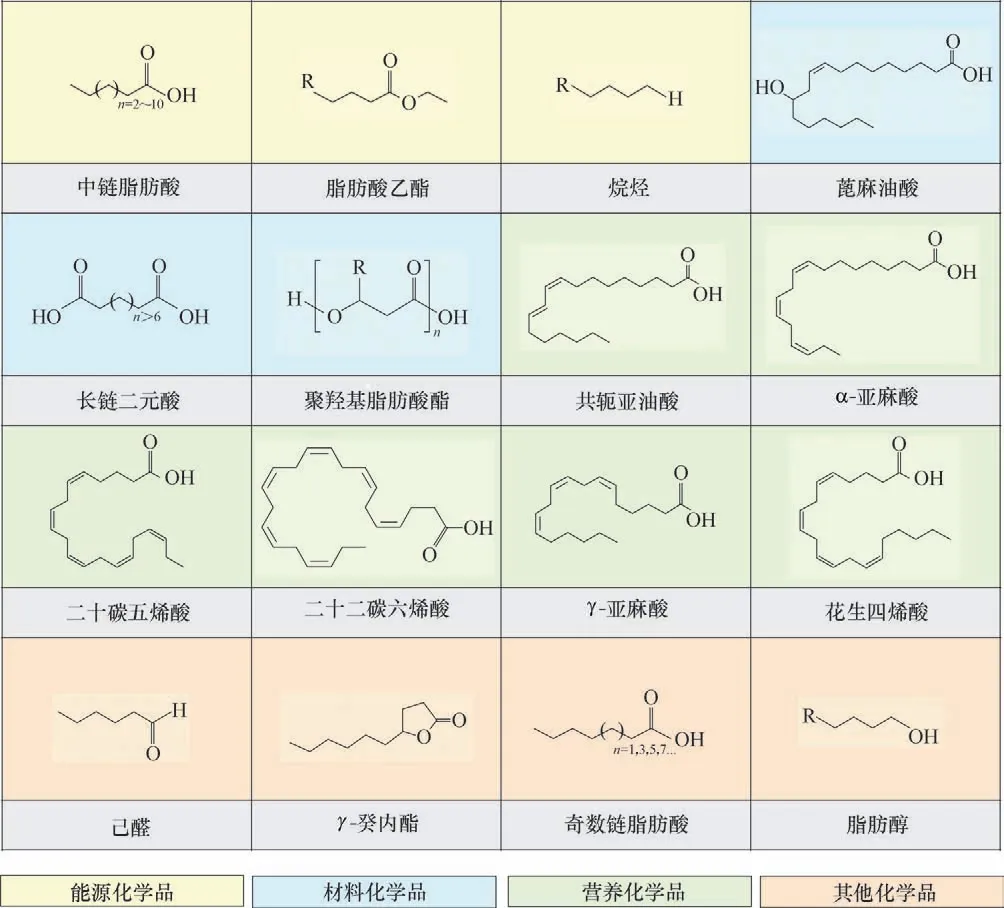
图1 解脂耶氏酵母合成的重要脂肪酸及其衍生物的化学结构式Fig.1 Chemical structures of the fatty acids and their derivatives produced by Yarrowia lipolytica
近年来,分子生物学技术的进步促进了各种改造解脂耶氏酵母的基因工程工具的蓬勃发展[15,23-24]。启动子影响微生物体内基因表达水平,是构建外源或内源基因表达盒最重要的元件[25]。在解脂耶氏酵母中,组成型强启动子pTEF 和脂肪酸或烷烃诱导型启动子pPOX2被普遍用于异源基因的表达[26]。研究发现pTEF 启动子序列若保留一段内含子序列(pTEFin),其表达强度比pTEF 高17 倍[27]。另外,通过在pLEU2 启动子的核心区域上游插入四个XPR2基因上游的激活序列(UAS1)获得杂合启动子hp4d,其强度显著提高[28],进一步研究发现可通过调整UAS1 的数目控制杂合启动子的强度[29]。在实际应用中,启动子控制基因的表达并不是越强越好,因此,在代谢途径构建过程中,可以通过调整UAS1的数目构建具有不同强度的启动子库的方法,筛选出最适于目标蛋白表达的启动子[30]。
由于解脂耶氏酵母的复制型质粒匮乏,在实际操作中,基因过表达一般通过将外源基因片段插入基因组来实现。这种方法依赖于DNA 修复的非同源末端连接[31],但其插入位点的随机性可能会破坏有用基因。而通过添加同源臂的方式可以使目的片段插入基因组中的特定位点,在敲除非同源末端连接关键蛋白KU70 后能显著提高解脂耶氏酵母的同源重组效率[15]。解脂耶氏酵母可以利用的筛选标记有营养缺陷型标记基因,如亮氨酸缺陷型标记基因(LEU2)和尿嘧啶缺陷型标记基因(URA3)[32],以及各种抗生素抗性基因,如博来霉素、潮霉素B和诺尔斯菌素的抗性基因[33]。其中,URA3 可配合5-氟乳清酸(5-FOA)实现URA3 标记的回收,通过重复使用URA3标记基因而实现不同位点的迭代基因修饰[23]。基于此,将解脂耶氏酵母体内拥有200 多个拷贝的26s rDNA 作为同源臂,并结合loxp-URA3-loxp 组件,配合Cre 酶能实现外源基因在26s rDNA位点的迭代整合[34]。另外,将URA3 的启动子截短至6bp 构建URA3d4,启动子截短后其表达量降低,只有多个拷贝的URA3d4才能使酵母在尿嘧啶缺陷型平板上生长,基于此可实现表达盒的多拷贝整合[35]。除了依赖于同源重组或者非同源末端连接的基因编辑手段,结合核酸内切酶Cas9 和单链向导RNA(sgRNA)的CRISPR/Cas9 技术可实现基因的精确编辑[23-24]。另外,缺失切割活性的Cas9 突变体dCas9 可用于构建CRISPR 抑制系统(CRISPRi)用于抑制特定基因的转录,将转录激活因子和dCas9 融合便可构建CRISPR 激活系统(CRISPRa)靶向增强特定基因的转录[23]。此外,在DNA 组装技术方面,各类快速组装技术被广泛研究,如DNA Assembler、Gateway 克隆、BioBricks、Gibson 组装和Golden-Gate组装[15],这些技术的诞生解决了传统的基于限制性内切酶切割和连接酶连接组装技术效率低的问题。随着针对解脂耶氏酵母各种合成生物技术手段的快速发展,使其更易被工程改造成合成特定脂肪酸及其衍生物的微生物细胞工厂。
解脂耶氏酵母中的油脂主要是由脂肪酸和3-磷酸甘油合成的中性甘油三酯(TAG)以及甾醇酯构成,其中TAG占绝大部分[36]。首先,细胞质来源的乙酰辅酶A 经过乙酰辅酶A 羧化酶(ACC1)催化生成丙二酰辅酶A。随后,二者作为前体(乙酰辅酶A 为起始化合物,丙二酰辅酶A为延长单位)在脂肪酸延长酶(FAS1和FAS2)的作用下不断伸长2个碳骨架,最终以16 或18 碳脂肪酰辅酶A(C16:0 和C18:0)的形式释放。接着在内质网中,C16:0 和C18:0 会被两种脂肪酸延长酶(ELO1 和ELO2)延伸为长链(C18~C22)或超长链(C22~C26)脂酰辅酶A,或者被Δ9 去饱和酶(OLE1)去饱和成单不饱和脂酰辅酶A(C16:1 和C18:1)[37]。C18:1 又会被Δ12 去 饱和酶(FAD2)进一步催化生成多不饱和脂酰辅酶A(C18:2)。最后,二酰甘油(DAG)会通过磷脂:二酰甘油酰基转移酶(LRO1)催化磷脂或者二酰甘油酰基转移酶(DGA1)催化脂酰辅酶A 生成TAG,最终以脂滴的形式在胞内积累[38]。脂滴是一种营养储存形式,在培养基中营养物质耗尽后会被脂肪酶(TGL3 和TGL4)降解为脂肪酸,进而经过脂肪酸 激 活 蛋 白(FAA1)或 者 转 运 蛋 白(PXA1 和PXA2)激活成脂酰辅酶A 并转运进入过氧化物酶体中通过β-氧化降解。由于解脂耶氏酵母中天然存在上述脂肪酸合成、积累和降解途径,因此其具有通过工程改造实现各类脂肪酸及其衍生物合成的良好基础(图2)。
2 能源化学品
2.1 中链脂肪酸
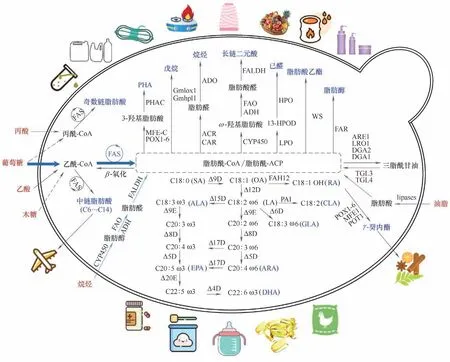
图2 解脂耶氏酵母中脂肪酸及其衍生物的合成途径Fig.2 Metabolic pathways of fatty acids and their derivatives in Yarrowia lipolytica
中链脂肪酸(MCFA)通常指碳链长度为6~14的脂肪酸,相比于长链脂肪酸,其凝固点较低,可用作航空煤油在低温下使用;相比于短链脂肪酸,其沸点较高、不易挥发、易于储存。因此,中链脂肪酸及其衍生物可以提高生物燃料的性能,是化石燃料可持续的替代品[4]。解脂耶氏酵母中的脂肪酸合成酶属于Ⅰ型系统(FASI),是一种包含8 个功能催化从头合成脂肪酸的多功能蛋白,可分为α 亚基和β 亚基。α 亚基由酰基载体蛋白(ACP)、酮酰基还原酶(KR)、酮酰基合酶(KS)和磷酸泛酰巯基乙胺基转移酶(PPT)组成;β 亚基由酰基转移酶(AT)、烯醇还原酶(ER)、脱水酶(DH)和丙二酰/棕榈酰转移酶(MPT)组成[39]。具体而言,首先乙酰辅酶A 和丙二酰辅酶A 在AT 和MPT 的转酰活性下生成乙酰ACP和丙二酰ACP,二者被KS 催化缩合,并在KR、DH、ER作用下形成饱和酰基ACP[40-41]。接着通过与丙二酰ACP 缩合增加2 个碳链不断循环直至被MPT 转化为酰基辅酶A 终止[42]。与酵母来源的FASⅠ不同,细菌和植物来源的FAS 属于Ⅱ型系统,其脂肪酸的延伸需要硫酯酶参与[43-44]。相同的是,FASⅡ和FASⅠ都需要KS域来进行脂肪酸的延长。
目前,解脂耶氏酵母合成中链脂肪酸的代谢工程手段主要是围绕引入外源硫酯酶和改造KS 以调节脂肪酸链长展开的。在细菌和植物中,FASⅡ中的不同催化亚基是分散的,所以更容易表达外源的中链特异性硫酯酶来终止长链脂肪酸合成以积累中链脂肪酸[10,45-46]。而解脂耶氏酵母中的FASⅠ各催化域结合紧密,使得表达外源的硫酯酶往往不能够大幅度提高中链脂肪酸产量。Rutter 等[47]通过在解脂耶氏酵母中表达各类对中链脂肪酸有特异性的酰基ACP 硫酯酶,发现分子量较小的酰基ACP 硫酯酶能够改变解脂耶氏酵母的脂肪酸组成,如:加州月桂(Umbellularia californica)来源的酰基ACP 硫酯酶能够使解脂耶氏酵母合成辛酸或癸酸。同样,Xu 等[39]的研究表明在解脂耶氏酵母中表达分子量较 小 的 酰 基CoA/ACP 硫 酯 酶(EGT、EcTesA′、EcTesC、EcYbgC 和EcYciA)能够生产中链脂肪酸。这是因为分子量较小的硫酯酶更容易扩散到FASⅠ的腔室中发生催化作用,从而提前终止脂肪酸链的进一步延伸。研究人员还尝试用硫酯酶替换FASⅠ中的MPT 域,例如用大肠杆菌来源的硫酯酶(EcTesA′)替换MPT 能够使C14 脂肪酸比例提高到29.2%,是直接表达EcTesA′的3倍。同样,用加州月桂来源的硫酯酶(UcBTE)替换MPT能够使C12脂肪酸含量提高6 倍。除此之外,KS 结构域决定着脂肪酸的延伸,对其进行突变能够改变最终脂肪酸的链长。采用分子模拟方法探究KS 对C16 脂肪酸的分子结合方式,发现异亮氨酸残基I1220是影响KS 中酰基辅酶A结合口袋大小的关键氨基酸。当用芳香族氨基酸取代I1220时,缩小了KS的催化口袋,使中链脂肪酸不能与其结合继续延伸而被过早释放出来,最终使得突变菌株积累占总脂肪酸11.6%的C14 中链脂肪酸[48],这是在解脂耶氏酵母中通过突变KS 域生产中链脂肪酸的有益尝试。Rigouin 等[49]在此基础上过表达了来自油棕(Elaeis guineensus)对中链脂肪酸有特异性的甘油三酯酰转移酶(DGAT)后,使中链脂肪酸积累在TAG 中,最终中链脂肪酸含量占总油脂的45%。
然而研究表明,中链脂肪酸的积累会影响必需脂肪酸的合成而影响细胞生长[47]。为了提高细胞对中链脂肪酸的耐受性,在酿酒酵母中对膜转运体TPO1进行定向进化和对菌体进行适应性进化,使中链脂肪酸的产量分别提高了1.3 和1.7 倍[4]。最近,在酿酒酵母中鉴定了中链脂肪酸响应型启动子,并用于酿酒酵母合成中链脂肪酸及其衍生物的动态调控[50]。因此,未来在利用解脂耶氏酵母合成中链脂肪酸过程中,可围绕增强其对中链脂肪酸的耐受性展开,并结合鉴定响应中链脂肪酸的启动子,实现动态调控平衡细胞的生长与产物合成,从而进一步提高其中链脂肪酸产量。
2.2 脂肪酸乙酯
脂肪酸乙酯(FAEE)是可作为柴油替代物的重要生物燃料,目前常用的生物燃料乙醇对现有设备具有一定的腐蚀性,而且需要特定的储存和运输条件[40],而FAEE 没有这些缺点。目前,大多数FAEE是由乙醇与各种脂质原料(例如植物油或动物脂肪)在催化剂的作用下发生酯交换反应生成[51]。为了解决FAEE 原料供应受限并且生产过程不够环保的问题,工程改造微生物直接合成FAEE 提供了一种可持续、环境友好的生产路线。目前微生物生产FAEE 研究最多的宿主是酿酒酵母,其自身能够合成乙醇,因此在合成FAEE 的过程中(由蜡酯合酶(WS)催化乙醇和脂酰辅酶A生成)无须外源添加乙醇[52]。然而酿酒酵母合成脂肪酸的能力有限,需要外源添加脂肪酸才能提高FAEE 产量[53]。相较而言,解脂耶氏酵母因为具有更高的脂肪酸积累能力而被认为是极具潜力的FAEE生产宿主。
工程改造解脂耶氏酵母合成FAEE 主要通过共表达来自不动杆菌(Acinetobacter baylyi ADP1)的蜡酯合酶(AbAtfA)和外源添加乙醇来实现,当AbAtfA靶向内质网和过氧化物酶体时,FAEE 的产生分别增加到136.5 和110.9 mg/L[39]。Gao 等[54]通过四种策略对该过程进行了进一步优化:①利用杂交强启动子pUAS4B-TEFin 表达经过密码子优化的除烃海杆菌(Marinobacter hydrocarbonoclasticus)来源的蜡酯合酶MhAtfA 基因。②过表达自身的柠檬酸裂解酶(ACL)、酿酒酵母来源的乙酰辅酶A 合成酶(ACS2)和自身乙酰辅酶A 羧化酶(ACC1)以提高胞内乙酰辅酶A 水平。③敲除油脂积累的关键基因dga1 和油脂氧化关键基因pex10 来增加FAEE 前体脂酰辅酶A。④优化外源乙醇的添加浓度。最终改造后的解脂耶氏酵母在含有5%(体积)乙醇的摇瓶中培养,能够以1.18 g/L 的浓度合成FAEE,是工程微生物生产FAEE 的最高产量。为了避免乙醇的外源添加,Yu 等[55]在解脂耶氏酵母中引入来自酿酒酵母的丙酮酸脱羧酶(PDC1)和醇脱氢酶(ADH1)构建了从丙酮酸到乙醇的完整外源途径,试图以自身合成的乙醇为底物来合成FAEE。随后通过进一步过表达甘油醛3-磷酸脱氢酶(GAPDH)促进NADH的再生,为乙醇-乙醛穿梭提供充足的NADH 供应,进而将乙醇产量提高至70.8 mg/L。然而,因为乙醇浓度太低,在引入蜡酯合酶MhAtfA 后仅能够合成0.3 mg/L的FAEE,远低于外源添加乙醇时的产量。最后,作者将解脂耶氏酵母和酿酒酵母共培养,试图以酿酒酵母合成大量乙醇供应解脂耶氏酵母生产FAEE,优化共培养方式后最优混菌体系能合成500.4 mg/L的FAEE。以上研究表明解脂耶氏酵母利用内源乙醇合成FAEE 的局限在于乙醇生产水平较低,未来可将研究的重点放在提高其FAEE 前体乙醇合成能力方面。
2.3 烷烃
烷烃是一种饱和碳氢化合物,仅由碳碳与碳氢单键构成,可分为链烷烃与环烷烃。通过石油分馏获得不同链长的链烷烃,广泛应用于燃料、化工原料等方面,其中短链和长链烷烃是汽油、航空燃油的重要组成部分[56]。利用生物质原料通过微生物细胞工厂生产烷烃符合可持续发展要求,可代替石油基燃料。微生物合成烷烃是脂肪酸在一系列酶的催化下,经过还原和脱羧反应而形成。利用这一途径已经成功在大肠杆菌和酿酒酵母中实现了各种链长烷烃的合成[6-7,56]。解脂耶氏酵母相较于大肠杆菌和酿酒酵母,因其能够大量合成脂肪酸,所以更有潜力被工程化改造合成各种烷烃。
利用解脂耶氏酵母合成链烷烃主要有两种途径。脂氧合酶能够将脂肪酸内的(Z,Z)-1,4-戊二烯结构单元加氧,将多不饱和脂肪酸转化为不饱和脂肪酸氢过氧化物。在大豆和花生中分别利用大豆脂氧合酶Ⅰ/Ⅱ和花生脂氧合酶将亚油酸(C18:2)转化为中间体13-氢过氧亚油酸(13-HPOD),进而合成短链烷烃。在能够生产亚油酸占总油脂47%的解脂耶氏酵母[57]中导入了大豆脂氧合酶I(Gmlox1),并通过优化培养基和敲除β-氧化第二步的多功能酶(MFE1)以提高前体亚油酸的供应,最终能够合成1.56 mg/L 的戊烷[58],这是首次在微生物中合成短链烷烃的报道。解脂耶氏酵母合成链烷烃的另一种途径是通过脂酰辅酶A或脂肪酸经过脂酰辅酶A还原酶或羧酸还原酶催化生成脂肪醛,然后被醛脱甲氧合酶转化为烷烃。Xu 等[39]在解脂耶氏酵母中共表达来自不动杆菌的脂酰辅酶A 还原酶(AbACR1)和海洋原绿球藻(Prochlorococcus marinus)来源的醛脱甲氧合酶(PmADO)后,成功合成了3.2 mg/L 的烷烃混合物。进一步将两种酶靶向内质网后,烷烃产量增加到16.8 mg/L。另外,他们在胞浆中表达海洋分枝杆菌来源的羧酸还原酶(MmCAR)、枯草芽孢杆菌来源与ACP 激活模块相关的磷酰转移酶(BsuSfp)和PmADO 能够生成23.3 mg/L 的烷烃。未来,利用解脂耶氏酵母卓越的脂肪酸合成能力实现高产烷烃的目标,需要采用关键酶过表达、阻断脂肪酸氧化以及增强细胞的鲁棒性以缓解烷烃的细胞毒性等多种策略进行改造。
3 材料化学品
3.1 蓖麻油酸
蓖麻油酸学名是12-羟基-十八碳-顺-9-烯酸,是一种具有羟基官能团的脂肪酸,具有多种用途[59-60],尤其是在材料领域,其衍生物广泛用于尼龙11、聚氨酯、聚酰胺等材料的合成[36,61]。蓖麻油酸主要从蓖麻籽中提取,然而由于蓖麻籽体内含有对人体有害的蓖麻毒蛋白[62],限制了蓖麻的广泛种植。这促使人们尝试通过多种替代方法来生产蓖麻油酸:如以植物油为原料化学催化制备蓖麻油酸[63],基因工程改造各类植物[64]、微生物[65-66]以生产蓖麻油酸。然而由于这些生物本身不能积累大量脂肪酸,研究者们开始着眼于工程改造油料作物或者产油微生物合成蓖麻油酸。
蓖麻油酸主要是由蓖麻豆羟化酶(Δ12 油酸羟化酶,FAH12)催化油酸合成。解脂耶氏酵母中天然能积累较多的油酸,经过工程改造后油酸含量高达总脂肪酸的92%[67]。通常,工程改造解脂耶氏酵母生产蓖麻油酸的主要策略包括三个方面:①异源表达合适的Δ12 油酸羟化酶(FAH12);②敲除Δ12 去饱和酶以降低油酸转化为亚油酸;③表达对蓖麻油酸有底物特异性的甘油三酯酰转移酶(DGAT)。Beopoulos 等[68]在解脂耶氏酵母中敲除pox1-6 和Ylfad2基因阻断β-氧化途径和亚油酸合成途径以增加前体油酸的含量,在此基础上,敲除了三种DAG酰基转移酶DGA1、DGA2 和LRO1,接着回补LRO1使菌株仅通过磷脂途径合成TAG,并进一步探究了来 自 Claviceps purpurea 的 Δ12 油 酸 羟 化 酶(CpFAH12)和来自Ricinus communis 的Δ12 油酸羟化酶(RcFAH12)对蓖麻油酸合成的影响,发现过表达2 个拷贝的CpFAH12 后蓖麻油酸产量最高。后来研究通过表达3拷贝CpFAH12和2拷贝LRO1,进一步改进了生产菌株,在10 L 生物反应器中能合成12 g/L 的蓖麻油酸,占总脂肪酸的60%[68]。最后,他们尝试表达Ricinus communis 来源的甘油三酯酰转移酶(RcDGAT2)或Claviceps purpurea 来源的甘油三酯酰转移酶(CpDGAT2)以提高蓖麻油酸的积累,结果反而降低了蓖麻油酸的产量。这些工程改造策略证明了解脂耶氏酵母作为高产蓖麻油酸菌株的可行性,未来,可通过进一步鉴定限速步骤、提高总油脂和直接前体油酸的含量以提高蓖麻油酸的产量。
3.2 长链二元酸
长链二元酸(DCA)是指10 个或以上碳原子的直链饱和二元羧酸,可用于生产特种尼龙、聚酰胺热熔胶等一系列高附加值的材料,目前主要通过化学法合成。用微生物生产DCA 主要是以烷烃或脂肪酸为底物通过氧化途径合成,脂肪酸的ω 末端被细胞色素P450单加氧酶和NADPH 依赖的细胞色素P450 氧化还原酶羟基化形成ω-羟基脂肪酸,随后被脂肪醇氧化酶进一步氧化为脂肪醛,最后,由NADH 依赖的脂肪醛脱氢酶催化形成DCA[36]。值得注意的是,解脂耶氏酵母细胞内合成的DCA 会通过发生在过氧化物酶体中的β-氧化途径降解,因此阻断β-氧化途径是促进解脂耶氏酵母中DCA 积累的有效方法。Smit等[69]在解脂耶氏酵母中首次尝试通过添加不同链长的烷烃和烷烃降解的中间体来生产DCA。结果表明,解脂耶氏酵母可以转化添加的化合物为DCA,但β-氧化途径能够快速地降解生成的DCA,所以需要敲除β-氧化途径的关键基因pox1-6 阻止DCA 降解。此外,从烷烃或者脂肪酸合成DCA 的限速步骤是参与ω-氧化第一阶段的羟基化反应,为此,Thevenieau 等[70]在敲除pox1-6 基因之后,借鉴Picataggio 等[71]改造热带假丝酵母(Candida tropicalis)的方法,过表达NADPH 依赖型细胞色素P450 还原酶和12种细胞色素P450 单加氧酶的编码基因以增强ω-氧化第一阶段的羟基化活性从而提高了DCA 的产量。Gatter 等[72]通过序列比对,在解脂耶氏酵母中鉴定出一个醇氧化酶基因(FAO),过表达FAO 后DCA 产量提高了10 倍。Mishra 等[73]为了在解脂耶氏酵母中鉴定新的能够提高DCA 合成能力的遗传改造靶点,通过建立基因组规模代谢网络模型,从中筛选出有利于十二烷二酸合成的关键过表达靶点:苹果酸脱氢酶、苹果酸酶和谷氨酸脱氢酶,并最终通过实验证明这3 个酶的过表达能够提高十二烷二酸的产量。
3.3 聚羟基脂肪酸酯
聚羟基脂肪酸酯(PHA)是一类可生物降解的聚酯,可用作替代化石类聚酯的生物材料。PHA 通常是由微生物在过量碳源和一种必需营养元素限制的条件下在胞内积累的,这种生物聚合物是由羟基脂肪酸在PHA 合酶的催化下以颗粒形式聚合而成的,是一种用于碳和能量存储的化合物[74]。PHA 根据其单体的侧链可以分为短链长度的PHA(具有3~5 个碳原子的scl-PHA)和中链长度的PHA(具有6~14 个碳原子的mcl-PHA)[75]。解脂耶氏酵母因为其高水平油脂合成能力和胞内乙酰辅酶A 含量较高,已被广泛研究用于生产各类PHA。解脂耶氏酵母可以通过补充外源脂肪酸和表达铜绿假单胞菌来源的PHA合酶用于生产各种PHA共聚物和均聚物。Haddouche 等[76]通过敲除脂质合成途径和过表达MFE 蛋白的2-烯脂酰辅酶A 水合酶结构域以增强3-羟基脂肪酸前体的合成,将脂肪酸通量重定向至β-氧化,最终合成占细胞干重7%的PHA。聚-3-羟基丁酸酯(PHB)属于scl-PHA,在解脂耶氏酵母中通过表达Ralstonia eutropha 菌株来源的β-酮硫解酶(PhaA)、乙酰乙酰辅酶A还原酶(PhaB)和PHA合酶(PhaC),可转化乙酰辅酶A 生成PHB。在补充葡萄糖和乙酸盐作为碳源后,能积累干重1.50% 和3.84%的PHB,以乙酸盐作为唯一碳源分批发酵,PHB 能高达7.35 g/L,占干重的10.2%[77]。然而,PHA的性质取决于其分子量和分子结构,例如属于scl-PHA的PHB力学性能通常较差,弹性性能不如mcl-PHA,而更适用于特定的医学材料[78]。研究发现铜绿假单胞菌PHA 合酶(PhaC1)对R-3-羟基辛酰辅酶A 具有特异性,在解脂耶氏酵母中多拷贝表达经密码子优化的PhaC1 编码基因可以增加mcl-PHA的积累[79]。Rigouin 等[78]通过油酸诱导型启动子POX2 过表达MFE 蛋白促进脂肪酸降解生产mcl-PHA 共聚物,而过表达MFE 蛋白的2-烯脂酰辅酶A水合酶结构域以避免3-羟基脂肪酸进一步降解生成mcl-PHA 均聚物。另外,研究发现,解脂耶氏酵母中的酰基辅酶A 氧化酶(AOX)编码基因pox1-6对不同链长脂肪酸具有偏好性,可通过表达对非目标链长有特异性的pox 基因使得非目标链长的脂肪酸降解从而生产特定链长的PHA[80]。
4 营养化学品
4.1 共轭亚油酸
共轭亚油酸(CLA)是亚油酸(C18:2)的同分异构体,具有抗肥胖、抗动脉粥样硬化、预防代谢性疾病以及参与免疫系统调节的作用,常用作膳食补充剂[81]。然而各种异构体中只有顺-9,反-11 共轭亚油酸和反-10,顺-12 共轭亚油酸具有上述功能。工业化生产CLA 主要是利用植物油碱性异构化生产,得到是多种异构体的混合物,限制了在营养化学品方面的应用。因此,利用微生物中酶的特异性合成特定异构体的CLA 是可行的替代方法。近年来,人们着眼于研究代谢工程改造解脂耶氏酵母生产CLA,因为其体内存在大量用于生产CLA 的前体亚油酸。目前,已经成功挖掘出来自痤疮丙酸杆菌(Propionibacterium acnes)合成反-10,顺-12 共轭亚油酸的亚油酸异构酶以及两个来自生孢梭菌(Clostridium sporogenes) 和 罗 伊 氏 乳 杆 菌(Lactobacillus reuteri)合成顺-9,反-11 共轭亚油酸的亚油酸异构酶[36,82]。在解脂耶氏酵母中多拷贝表达经过密码子优化痤疮丙酸杆菌来源的亚油酸异构酶基因,在葡萄糖培养基中成功获得占总脂肪酸5.6%的反-10,顺-12 共轭亚油酸[83]。进一步,将UAS1B 与原启动子hp4d 融合构建hp16d 强启动子,并用多拷贝整合质粒共表达高山被孢酶来源的Δ12去饱和酶和密码子优化过的痤疮丙酸杆菌来源的亚油酸异构酶基因,能合成占总脂肪酸10%的反-10,顺-12 共轭亚油酸[84]。当重组菌在大豆油中培养38.5 h 后,目标产物占总脂肪酸44%[84]。然而,共轭亚油酸会通过解脂耶氏酵母中的β-氧化途径降解,针对该问题,可通过抑制降解途径提高其产量。Imatoukene 等[85]在解脂耶氏酵母中敲除pox1-6 基因以破坏β-氧化途径,同时敲除油脂积累基因dga1、dga2、are1 和lro1 以提供更多游离脂肪酸作为前体。最终在表达自身的Δ12 去饱和酶和2 拷贝的痤疮丙酸杆菌来源的亚油酸异构酶基因后,能够积累总脂肪酸6.5%的反-10,顺-12 共轭亚油酸,并且菌株共轭亚油酸的降解速率明显降低。
4.2 多不饱和脂肪酸
多不饱和脂肪酸指含有两个及以上双键且碳链长度为18~22 个碳原子的直链脂肪酸,根据其分子结构式中双键距羧基端的位置,分为Omega-3 和Omega-6两类。多不饱和脂肪酸能够赋予细胞膜系统以柔韧性、流动性和选择通透性,是人类和其他哺乳动物的营养必需品[86-87]。多不饱和脂肪酸的传统来源是基于植物和动物组织提取获得,这种方法不仅目标产物含量低,而且生产受季节和地理位置的限制。充分利用自然界微生物的代谢潜能可以使其大量积累人们所需的各种多不饱和脂肪酸。解脂耶氏酵母中天然存在的两种不饱和脂肪酸C18:1 和C18:2,可作为其他不饱和脂肪酸的前体,为代谢工程改造解脂耶氏酵母合成多不饱和脂肪酸提供了可能。
为了实现Omega-3 的α-亚麻酸(ALA)的生物合成,Damude 等[88]尝试性在解脂耶氏酵母中导入双功能镰刀菌(Fusarium moniliformis)来源的Δ15去饱和酶,最终获得了占总脂肪酸28%的ALA。Cordova等[89]选择一株能够积累高含量(80%)油酸的解脂耶氏酵母作为出发菌株,在其中表达3 个拷贝来自Rhodosporidium kratochvilovae 的Δ15 去饱和酶RkΔ 12-15,ALA 的含量由0.1%提高到8.1%。研究表明,脂肪酸组分与细胞膜的组成和流动性相关,所以培养条件如温度会影响微生物的脂肪酸组成[90]。总的来说,降低培养温度后微生物会为了维持膜的流动性而提高膜中脂肪酸成分的不饱和度。于是,Cordova 等[89]进一步将RkΔ12-15 三拷贝菌株处于20℃低温发酵,最终ALA 产量提高至总油脂的17.0%,达到了1.4 g/L。二十碳五烯酸(EPA)具有多种生理与保健功能,是最重要的一种Omega-3 多不饱和脂肪酸。EPA 在微生物中具有天然的合成途径,包括厌氧聚酮合酶途径和需氧去饱和延长途径两种[91]。目前,代谢工程改造解脂耶氏酵母合成EPA 主要是基于需氧去饱和酶和延长酶途径。美国DuPont 公司在这方面首开先河,选择来源于不同微生物的去饱和酶和延长酶在解脂耶氏酵母中表达,并基于启动子工程、多拷贝策略和蛋白质融合策略进行菌株改造,获得了一株能够积累占总脂肪酸58%的EPA高产菌株[92]。经过一系列的发酵优化和工业放大,DuPont 公司成功地将其推向产业化,基于所获得的高产菌株开发了两款富含EPA 的产品(New Harvest ™EPA oil 和Verlasso®salmo)[93]。DuPont 公司采用类似的策略在解脂耶氏酵母中构建了需氧去饱和延长途径合成了另一种重要的Omega-3 多不饱和脂肪酸二十二碳六烯酸(DHA),通过导入来自高山被孢霉的Δ4,Δ5,Δ6,Δ7 去饱和酶、C18~C20 延长酶,以及Thraustochytrium aureum来源的C20~C22 延长酶,并敲除内源的酰基转移酶和去饱和酶基因,最终获得了占总脂肪酸5.6%的DHA[94]。为了进一步提高解脂耶氏酵母合成DHA的能力,Gemperlein 等[95]在其中引入了DHA 合成的厌氧聚酮合酶途径,通过异源表达经过密码子优化后的4′-磷酸泛乙烯基转移酶(PPTase)和长链多不饱和脂肪酸合成酶生物基因簇,能合成占总脂肪酸10.5%的DHA。与利用好氧途径相比,该DHA 合成途径不依赖内源性脂肪酸作为生物合成前体,并降低了NAD(P)H的消耗。
除了上述3 种Omega-3 多不饱和脂肪酸,Omega-6 多不饱和脂肪酸,包括γ-亚麻酸(GLA)和花生四烯酸(ARA)也具有重要的生理功能,是重要的营养化学品[96]。本课题组[97]在解脂耶氏酵母中过表达了来源于高山孢酶的Δ6去饱和酶,合成了占总脂肪酸6.1%的GLA。此外,本课题组[98-100]还基于ARA在自然界微生物中存在的两条合成途径(Δ6和Δ9),通过比较不同途径的效率,并基于一步组装和连接肽融合表达等措施优化了合成的异源代谢途径,在解脂耶氏酵母中实现了ARA的高效合成。
5 其他化学品
解脂耶氏酵母合成的脂肪酸及其衍生物除了应用于上述能源、材料和营养化学品等方面,还广泛应用于食品、医药及日化等领域。如其胞内丰富的脂肪酸前体可被脂氧合酶(LOX)和过氧化氢裂解酶(HPL)催化合成己醛[101],其中富含的油酸经羟基化生成蓖麻油酸,接着经过四轮β-氧化,生成前体4-羟基癸酸,随后可被异构化和乳糖化形成γ-癸内酯[102],己醛和γ-癸内酯可作为香精香料使用,是重要的食品添加剂。此外,奇数链脂肪酸和脂肪醇也在医药和日化领域有着重要的应用。
5.1 奇数链脂肪酸
微生物中的脂肪酸主要是碳原子数为偶数且介于16~20 之间,较为稀有的奇数链脂肪酸因其功能独特性而具有很高的商业价值[103]。例如顺-9-庚烯酸对银屑病、过敏和自身免疫性疾病具有抗炎作用[104]。十五烷酸和七烷酸可以作为评估冠心病风险和Ⅱ型糖尿病风险的生物标记物[105]。在工业上,奇数链脂肪酸可以作为添加剂以改变生物燃料的性能[106]。此外,奇数链脂肪酸及衍生物是很多化学品的前体,如杀菌剂、香料、液压液、增塑剂、涂料等工业化学品。微生物中合成奇数链脂肪酸,可以通过丙酸酯转化为丙酰辅酶A,丙酰辅酶A 与丙二酰辅酶A 缩合生成五碳化合物3-氧杂戊酰-ACP,随后每个循环增加两个碳合成各种奇数链脂肪酸。Park 等[107]实验证明了解脂耶氏酵母可以在100 g/L高浓度丙酸盐作为唯一碳源的培养基上生长,并且可以合成占总脂肪酸35%左右的奇数链脂肪酸。2-甲基柠檬酸脱水酶(PHD1)是一种线粒体蛋白,在柠檬酸甲酯循环中催化2-甲基柠檬酸转化为2-甲基顺式乌头酸。缺失PHD1会阻止TCA 循环并抑制柠檬酸进入线粒体从而改善油脂的合成。研究发现,丙酰辅酶A 可通过柠檬酸甲酯循环分解成丙酮酸和琥珀酸,这会竞争奇数链脂肪酸合成途径,因此,敲除PHD1 后在葡萄糖与丙酸盐混合培养基中能够合成占总脂肪酸46.82%的奇数链脂肪酸。Park 等[108]进一步成功地在解脂耶氏酵母中构建了以葡萄糖为底物从头合成奇数链脂肪酸的代谢途径。利用内源苏氨酸合成途径,在苏氨酸脱氨酶的作用下,催化苏氨酸生成α-酮丁酸,然后,丙酮酸脱氢酶复合体(PDH)将α-酮丁酸转化为丙酰辅酶A用于奇数链脂肪酸合成。用TEF 启动子过表达苏氨酸生物合成途径相关的7 个基因,能够在葡萄糖作为唯一碳源的培养基中合成占总脂肪酸3.86%的奇数链脂肪酸。接着,在敲除了POX1-6、脂肪酶(TGL4)、过表达二酰甘油酰基转移酶(DGA2)和3-磷酸甘油脱氢酶(GPD1)的高产油脂菌株中过表达上述基因,进一步将奇数链脂肪酸提高至总脂肪酸含量的5.64%。
5.2 脂肪醇
脂肪醇广泛应用于化妆品、表面活性剂、个人护理产品和制药领域。脂肪醇目前主要由石化产品或植物油催化加氢生成,由于过度依赖化石原料和占用农用耕地,人们开始尝试利用微生物合成脂肪醇。该过程主要涉及两种代谢途径:一是将脂肪酰ACP 转化为脂肪醛,然后将其还原为脂肪醇;二是脂酰辅酶A 经过脂酰辅酶A 还原酶(FAR)直接转化为脂肪醇。事实上,针对微生物合成脂肪醇,研究者们选用了大肠杆菌和酿酒酵母在内的多种宿主[6]。解脂耶氏酵母由于其脂肪酸合成能力较强,被认为是合成脂肪醇的最有竞争力的宿主。Xu等[39]在解脂耶氏酵母中共表达Synechococcus elongatus 来源的脂肪酰ACP 还原酶(SeFAR)和大肠杆菌来源的醛还原酶(EcAHR),发现仅能够积累少于2.5 mg/L 的脂肪醇,可能是因为胞内脂肪酰ACP不足引起的。通过在过表达Marinobacter aquaeolei来源的脂酰辅酶A 还原酶(MaQu2220)的基础上,过表达大肠杆菌来源的脂酰辅酶A 合成酶(EcFadD)以增加前体脂酰辅酶A 的供应,能够合成205.4 mg/L 的脂肪醇,比MaQu2220 的单一过表达增加了2.6倍。这表明提高胞内的脂酰辅酶A含量能够为合成脂肪醇提供前体。Wang 等[109]采取了三种策略利用脂酰辅酶A还原酶途径逐步提高了解脂耶氏酵母中脂肪醇产量。首先敲除脂肪醇氧化酶(FAO1)减少脂肪醇的降解,进一步过表达5 个拷贝脂酰辅酶A还原酶(FAR)编码基因,最后敲除DGA1 增加脂酰辅酶A 的供应,最终脂肪醇产量提高了63 倍。Zhang 等[110]发现脂肪醇能够使糖酵解途径上调,于是尝试利用糖酵解途径中不同基因的启动子来控制FAR 的表达。在FBAin 启动子的控制下,脂肪醇生产与FBAin 的表达相互促进,在优化葡萄糖浓度后脂肪醇产量达到报道最高产量5.75 g/L。上述研究中由于选用的FAR 底物特异性宽泛,目标产物脂肪醇多是以混合物存在,为了获得单一组成的脂肪醇,Rutter 等[111]发现拟南芥来源的FAR 能够特异性催化癸酰辅酶A 生产1-癸醇,通过敲除与过氧化物酶体合成相关的编码基因pex10 进一步阻止1-癸醇的氧化,最终产量超过500 mg/L。另外,Cordova等[112]通过比较FAR 对不同链长脂肪酸的特异性,最终选择Marinobacter hydrocarbonoclasticus VT8 来源的MhFAR,使解脂耶氏酵母能够合成亚麻油醇。同样地,Wang 等[109]也通过选择猫头鹰(Tyto alba)来源的TaFAR,在解脂耶氏酵母中实现了十六醇的特异性积累。因此,研究FAR 的特异性能够帮助人们更好地生产有特定价值的目标脂肪醇产品。
针对提高解脂耶氏酵母合成特定脂肪酸及其衍生物,除了一些通用的代谢工程策略外,不同的产品均有相应独特的改造策略(表1)。值得一提的是,一方面脂肪酸类产品可通过增强油脂积累途径拉动其积累至无毒性的TAG 中以增加产量,另一方面一些脂肪酸衍生物则需要抑制油脂积累途径以增加相应脂肪酸前体的供应。因此,在未来的研究中,应权衡好脂肪酸前体的供应和脂肪酸积累成TAG 二者之间的关系。另外,增加乙酰辅酶A 含量是提高脂肪酸合成的一种通用策略,β-氧化途径可以降解脂肪酸合成乙酰辅酶A,但这一过程造成了前体脂肪酸的损失。可依赖pox1-6 基因对不同链长脂肪酸的底物特异性,降解非目标链长脂肪酸生成乙酰辅酶A 供给目标链长脂肪酸及其衍生物的合成。

表1 解脂耶氏酵母合成特定脂肪酸及其衍生物的代谢工程策略Table 1 Metabolic engineering strategies to produce the tailored fatty acids and their derivatives in Yarrowia lipolitica
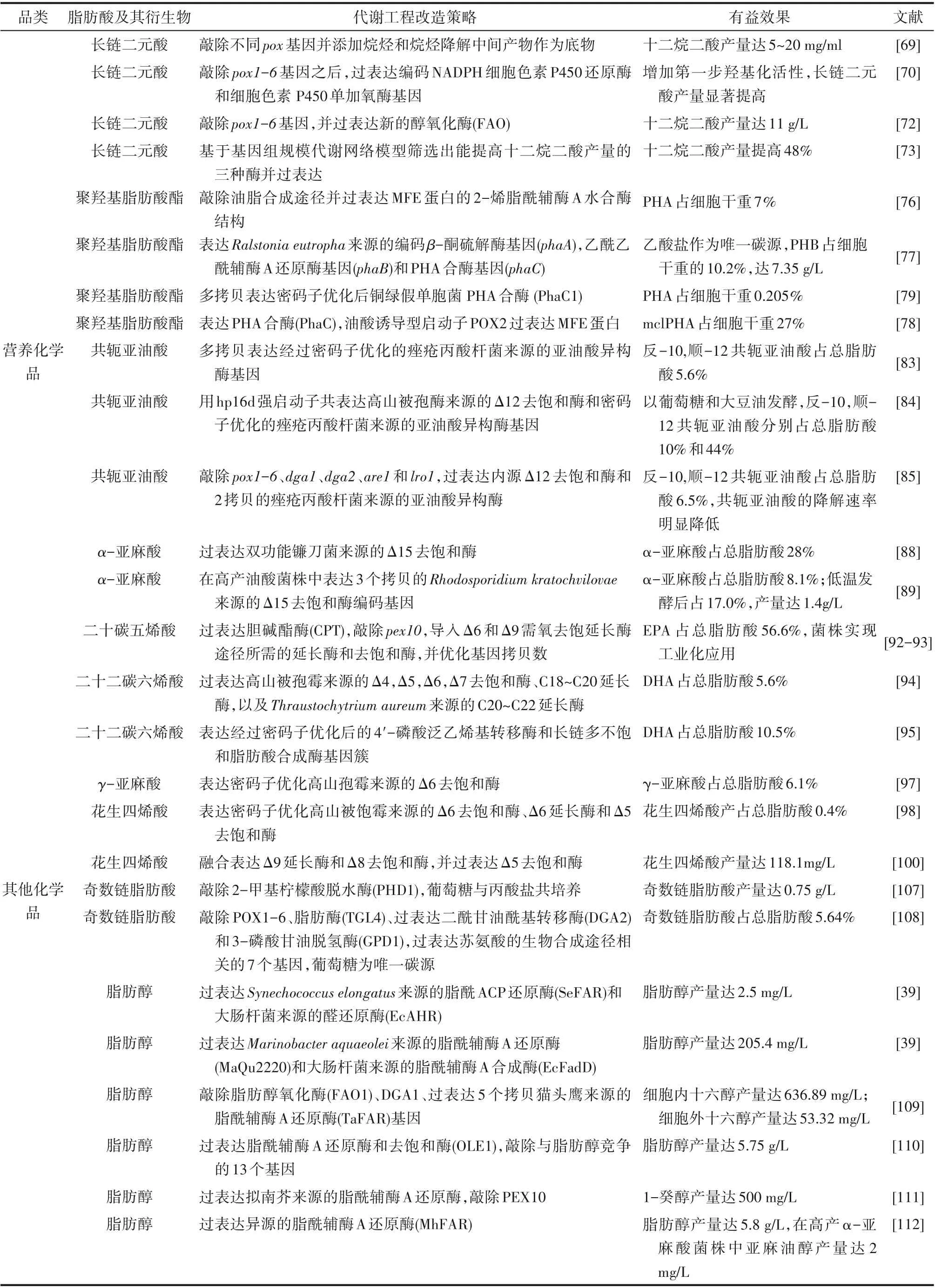
续表1
6 结论与展望
近年来,脂肪酸及其衍生物被广泛利用在能源、材料和营养化学品等领域,对其进行进一步深度开发利用引起了人们的广泛关注。利用微生物合成这些脂肪酸及其衍生物有着独特的优势,符合可持续发展的需求。解脂耶氏酵母作为高产油脂的微生物,是研究最为透彻的非常规酵母,随着研究的不断深入,其遗传操作工具不断完善,使其成为生产脂肪酸及其衍生物的优越宿主。本文综述了构建解脂耶氏酵母细胞工厂生产特定脂肪酸及其衍生物的研究进展,着重介绍了改造解脂耶氏酵母合成面向能源、材料和营养化学品的脂肪酸及其衍生物所用的代谢工程策略。这些策略主要包括利用基因敲除或过表达的手段理性设计,如:①过表达相关基因提高乙酰辅酶A和丙二酰辅酶A等脂肪酸合成前体的供应;②基因敲除β-氧化途径相关元件减少脂肪酸的胞内降解;③通过基因敲除或过表达改造FAS 途径、脂肪酸延长去饱和途径、硫酯酶途径以控制目标产物的链长和不饱和度。然而,这些传统的基因敲除和过表达等静态代谢工程手段,通常会给细胞带来负担,影响细胞生长,其局限性逐渐显现。能够时空特异性响应细胞环境变化的动态调控系统,已成为平衡细胞生长和产物合成的有力武器。为实现这一目标,未来可通过基于新型诱导型启动子、响应中间代谢物的生物传感器等动态调控的方法来实现。此外,为防止过多的基因工程改造带来的代谢负担而驱使细胞逃避选择压力以恢复细胞生长,可通过代谢成瘾策略将细胞的生长必需基因与目标产品合成途径进行关联,以富集并奖励积极生产的细胞,从而更好地为生产服务。最后,除了针对细胞代谢的理性设计外,还可通过非理性设计寻找并验证新的基因靶标,不断优化目标产物的合成能力。这些策略可以更好地指导构建解脂耶氏酵母细胞工厂以生产特定脂肪酸及其衍生物,加快其工业化进程。
