一步法制备生物相容油核微胶囊及其可控释放
2021-01-30石盼颜肖潇王行政冯乐耘陈东
石盼,颜肖潇,王行政,冯乐耘,陈东,2
(1 浙江大学能源工程学院,浙江杭州310027; 2 浙江大学流体动力与机电系统国家重点实验室,浙江杭州310027)
引 言
具有核壳结构的微胶囊可以装载各种活性物质,将活性物质包裹在一个小型密封的微胶囊壳层内,从而保护活性物质不受外界环境的影响,并且控制活性物质的释放[1-2]。当对微胶囊施加振动、改变温度或者改变pH 等刺激时,可以破坏微胶囊的壳层结构,从而控制囊内活性物质的释放[3-6]。微胶囊技术适用于各种场景下活性物质的传递,有助于提高活性物质的存储时间,并且在适当场合下释放活性物质,在食品、生物、医药等领域具有重要的应用价值[7-11]。
微胶囊的制备方法通常分为自下而上和自上而下两种方法[12]。传统制备微胶囊通常采用自下而上的方法,通过两次剪切制备得到双乳模板。以油核微胶囊为例,首先将油相在水相中剪切乳化形成油相液滴,然后将包含油相液滴的水相在另一种油相中剪切乳化,从而得到包裹油核的微胶囊[13]。自下而上方法制备微胶囊较容易实现规模化生产,但由于在自下而上方法制备微胶囊的过程中,无法准确控制剪切作用,因此无法准确控制每个微胶囊的制备过程,得到的微胶囊尺寸不均、壁厚难以控制、包裹效率低,并且导致微胶囊后续无法很好地提高活性物质的存储时间和控制活性物质的释放,极大地限制了微胶囊的应用[14-18]。
随着微流控技术的发展,自上而下制备微胶囊的技术开始应用于实际生产中[19],这一方法通过对流体进行精确的控制,从而精确地控制剪切过程,能够一步法生成双乳,然后以双乳为模板,已成功实现一步法制备各种壳层材料的微胶囊,如脂质体、水凝胶、聚合物微胶囊等[20-23]。在制备过程中,微流控技术可以有效地控制微胶囊的结构[24-28],制备得到的微胶囊具有尺寸均一、壁厚可控、包裹效率高、装载率高等诸多优势[29-31],这使得微流控技术制备微胶囊开始广泛应用于食品、生物、医药等领域[32-36]。随着社会的发展,人们对微胶囊的要求越来越高,尤其是无任何有机溶剂、完全由生物相容材料组成的微胶囊具有广阔的应用前景。
本文通过设计玻璃毛细管微流控器件,将微流控和重力相结合,成功实现自上而下一步法制备生物相容油核微胶囊,有效简化了微胶囊的制备过程和后期处理,所得到的微胶囊尺寸均一、壁厚可控、具有较高的包裹效率和装载效率。通过改变微流控器件结构、内相流速和外相流速,系统研究了这些参数对油核数量、微胶囊直径、壁厚等性质的影响规律。同时,生物相容油核微胶囊作为活性物质的理想载体,实现了pH 改变触发的快速释放和壁厚调节的缓慢释放,为其实际应用奠定了基础。
1 实验材料和方法
1.1 材料
实验采用的材料包括:异壬酸异壬酯(山东优索化工科技有限公司,分析纯)、双氨端硅油、氯化氢溶液、海藻酸钠、氯化钙、磷酸氢二钠、柠檬酸钠和正己烷(阿拉丁试剂有限公司,分析纯);实验采用的设备主要包括:拉伸仪(P-1000,Sutter Instrument Company)、注射泵(保定兰格恒流泵有限公司)、玻璃毛细管(北京中成石英玻璃有限责任公司)、磁力搅拌热台(IKA)、ME 电子天平(梅特勒-托利多仪器有限公司)、光学显微镜(舜宇光学科技有限公司)和高速摄像机(PCO.dimax,德国PCO公司)。
1.2 玻璃毛细管微流控器件和油核微胶囊的制备
选取两根圆柱形玻璃毛细管,其中一根小尺寸玻璃毛细管内径为0.55 mm、外径为0.96 mm,另一根大尺寸玻璃毛细管内径为1 mm、外径为1.4 mm。用拉伸仪将玻璃毛细管的一端拉伸成锥状,并将小尺寸玻璃毛细管管口直径打磨为200 μm,大尺寸玻璃毛细管管口直径打磨为600 μm。管口尺寸通过体显微镜进行精确测量。然后将小尺寸玻璃毛细管锥状端插入大尺寸玻璃毛细管,使得小尺寸玻璃毛细管管口伸出大尺寸玻璃毛细管管口,伸出距离为300 μm。内管和外管是通过AB胶环氧树脂固定在载玻片上,固定过程中缩进、伸出距离通过体显微镜进行调整,最终得到玻璃毛细管微流控器件。
内相油性物质采用异壬酸异壬酯,其中添加1%(质量)双氨端硅油作为表面活性剂,并通过注射泵将内相油相注入内管;外相采用1%(质量)海藻酸钠溶液,并通过注射泵将外相水凝胶相注入外管,内外相流体主要物性参数如表1所示。内相油相在外相水凝胶相的剪切下形成液滴,同时外相水凝胶相在重力的作用下,脱离管口形成包裹油相液滴的微胶囊。当微胶囊落入接收池,接收池中氯化钙[5%(质量)]的钙离子与海藻酸钠分子交联,形成稳定的水凝胶壳层。最后在光学显微镜下观察微胶囊的形态。

表1 内外相流体物性参数Table 1 Physical properties of inner or outer fluids
初始内相流速为0.5 ml/h,初始外相流速为0.5 ml/h。在保持内相流速不变的情况下,外相流速逐次增加0.5 ml/h 或1 ml/h 直至12 ml/h;然后内相流速增加0.5 ml/h 并保持不变,外相流速从0.5 ml/h 逐次增加0.5 ml/h 或1 ml/h 直至12 ml/h;如此重复,直至内相流速为5 ml/h,外相流速为12 ml/h。最终确定制备油核微胶囊的相图。
1.3 玻璃毛细管微流控器件结构对油核微胶囊相图的影响
参照1.2 节制备玻璃毛细管微流控器件的方法,制备内管管口与外管管口平齐的微流控器件和内管管口缩进外管管口,缩进距离为300 μm的微流控器件。参照1.2 节确定制备油核微胶囊相图的方法,分别确定上述两种微流控器件制备油核微胶囊的相图。
1.4 流速对油核微胶囊的影响
参照1.2 节制备油核微胶囊的方法,保持外相流速为10 ml/h,调节内相流速从0.5 ml/h 逐次增加0.5 ml/h 直至不能形成微胶囊,并在显微镜下观察分析微胶囊的直径和壁厚与内相流速的关系;保持内相流速为0.5 ml/h,调节外相流速从1.5 ml/h逐次增加0.5 ml/h 或1 ml/h 直至12 ml/h,并在显微镜下观察分析微胶囊的直径和壁厚与外相流速的关系。
1.5 油核微胶囊的智能响应
参照1.2 节制备油核微胶囊的方法,制备得到包裹单个油相液滴的微胶囊。利用HCl溶液调节溶液pH 为1.0,在光学显微镜下观察油核微胶囊在酸性溶液中随时间的变化。利用Na2HPO4调节溶液pH 为9.3,在光学显微镜下观察油核微胶囊在碱性溶液中随时间的变化。
参照1.2 节制备油核微胶囊的方法,制备得到包裹单个油相液滴的微胶囊。配制5%(质量)柠檬酸钠溶液,在光学显微镜下观察油核微胶囊在柠檬酸钠溶液中随时间的变化。
1.6 油核微胶囊的释放
参照1.2 节制备油核微胶囊的方法,采用正己烷和蚕丝油[49.5%(质量)正己烷和49.5%(质量)蚕丝油]作为内相溶液,其中添加1%(质量)双氨端硅油作为表面活性剂,采用1%(质量)的海藻酸钠溶液作为外相溶液。设置内相流速为1 ml/h,外相流速为4 ml/h,制备得到第一组油核微胶囊样品;设置内相流速为1 ml/h,外相流速为6 ml/h,制备得到第二组油核微胶囊样品;设置内相流速为1 ml/h,外相流速为8 ml/h,制备得到第三组油核微胶囊样品。测试前将相同质量的油核微胶囊放置于干燥箱内保持相同时间,在去除水分后,分别放置于电子天平上观察油核微胶囊质量随时间的变化。
2 实验结果与讨论
2.1 油核微胶囊液滴制备及相图
小尺寸玻璃毛细管管口伸出大尺寸玻璃毛细管管口的微流控器件实物图如图1(a)。控制乳化过程制备油核微胶囊。液滴生成过程如图1(b)所示,通过注射泵,将内相异壬酸异壬酯油相由内管注入微流控器件,外相海藻酸钠水凝胶由外管注入微流控器件,如图1(b)所示。内相油相在外相水凝胶相的剪切作用下,在微流控器件下端出口乳化形成液滴。同时油相液滴和外相水凝胶在重力的作用下,脱离管口形成尺寸和壁厚均一的包裹油相液滴的微胶囊。当微胶囊落入接收池,接收池中的钙离子与海藻酸钠分子交联,形成稳定的水凝胶壳层,如图1(c)所示。由该微流控器件控制乳化生成的微胶囊通常只含有一个油核液滴,并且是精准的一对一包裹,包裹效率可达100%。在微胶囊制备过程中,内相油相和外相水凝胶相的流速均会影响微胶囊的稳定生成;通过系统改变内相流速和外相流速确定了制备微胶囊的相图,如图1(d)所示。总体来说,当内相流速较小外相流速较大时,均可以得到尺寸和壁厚均一的包裹一个油相液滴的微胶囊。
2.2 流速对油核微胶囊直径和壁厚的影响
微流控技术的优点在于其对乳化过程的精准控制,通过调节内相和外相的流速,可以对油核微胶囊的直径和壁厚进行精准的调控,如图2 所示。当内相流速为0.5 ml/h,外相流速为10 ml/h 时,微胶囊的直径约为2.7 mm,壁厚约为0.73 mm。当固定外相流速为10 ml/h,内相流速从0.5 ml/h 逐渐增大到3 ml/h 时,微胶囊直径保持在2.7 mm 左右,壁厚从0.73 mm 逐渐减小到0.42 mm,如图2(a)、(b)所示。当固定内相流速为0.5 ml/h,外相流速从1.5 ml/h 逐渐增大到12 ml/h,直径保持在2.7 mm 左右,壁厚从0.35 mm 逐渐增大到0.79 mm,如图2(c)、(d)所示。通过调节内相和外相流速,油核微胶囊的装载率(装载率=油核体积/微胶囊体积)可以高达57%。微流控器件制备得到的微胶囊均具有较好的均一性,尺寸偏差小于5%。

图1 玻璃毛细管微流控器件及其制备油核微胶囊:内管管口伸出外管管口的玻璃毛细管微流控器件(a);微胶囊生成过程(b);油核微胶囊(c);制备微胶囊的相图(红色圈表示可以形成单核微胶囊,黑色叉表示无法形成微胶囊)(d)Fig.1 Preparation of oil-core microcapsules by glass-capillary microfluidic device.Glass capillary microfluidic device with inner nozzle extending from outer nozzle(a).Microcapsule formation process(b).Oil core microcapsules(c).Phase diagram of the prepared microcapsules,the red circle indicates that mononuclear microcapsules can be formed,and the black cross indicates that microcapsules cannot be formed(d)
在微流控器件中,微胶囊的形成受到内相和外相流速、黏度、界面张力等因素的影响[37-38]。为了更深入地了解微胶囊的形成过程,高速摄像机拍摄了微胶囊的形成过程,如图2(e)所示。首先,微胶囊从微流控器件管口脱落的过程,主要与重力和界面张力有关,重力使微胶囊脱离管口,界面张力使微胶囊悬挂在管口。重力和界面张力的共同作用决定了微胶囊的生成过程。当重力大于界面张力时,内相油相和外相水凝胶相在重力的作用下脱离管口形成微胶囊。因此,微胶囊的形成过程可以通过邦德数Bo来描述。邦德数是重力与界面张力的比值,如式(1)所示:
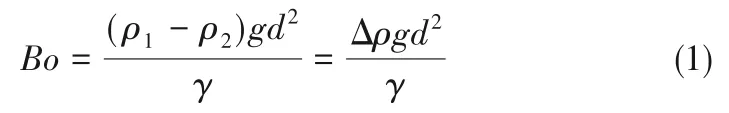
式中,ρ1表示流体密度;ρ2表示空气密度;Δρ 表示ρ1与ρ2的差值;g 表示重力加速度;d 表示流体特征长度;γ 表示流体界面张力。由邦德数可以看出,邦德数不依赖于内相流速和外相流速。因此,当调节内相流速或外相流速时,微胶囊的尺寸基本不变,与实验结果吻合,如图2(a)、(c)所示。
对于微胶囊的油核液滴,其生成与外相的剪切力、内相的惯性力和内外相间的界面张力有关。外相的剪切力和内相的惯性力使内相脱离内相管口,内外相间的界面张力使内相悬挂在内相管口,在这三种力的作用下,内相脱离管口形成油核液滴。当保持外相不变,即外相剪切力不变,增加内相流速时,内相的惯性力增加,此过程可以通过韦伯数We来描述。韦伯数是惯性力与界面张力的比值,如式(2)所示:

式中,ρ 表示流体密度;d 表示流体特征长度;U表示流体特征速率;γ 表示流体界面张力。由韦伯数可以看出,当内相流速增加,内相惯性力增大,油核液滴增大,与实验结果吻合,如图2(a)所示。当保持内相不变,即内相惯性力不变,增加外相流速时,外相的剪切力增加,此过程可以通过毛细管数Ca来描述。毛细管数是黏滞力与界面张力的比值,如式(3)所示:

式中,μ 表示流体运动黏性系数;U 表示流体特征速度;γ 表示流体界面张力。在液滴形成过程中,黏滞力使内相脱离内相管口,界面张力使内相悬挂在内相管口,在这两个相互竞争的作用力下,内相最终脱离管口形成油核液滴。因此,由毛细管数可以看出,当外相流速增大,外相剪切力增大,油核液滴变小,微胶囊壁厚增大,与实验结果吻合,如图2(c)所示。
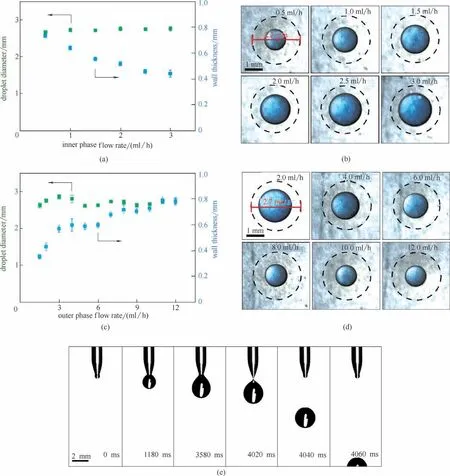
图2 内相流速和外相流速对油核微胶囊直径和壁厚的影响:内相流速对微胶囊直径和壁厚的影响,外相流速保持10 ml/h不变(a);不同内相流速下生成的微胶囊实物图,外相流速保持10 ml/h不变(b);外相流速对微胶囊直径和壁厚的影响,内相流速保持0.5 ml/h不变(c);不同外相流速生成的微胶囊实物图,内相流速保持0.5 ml/h不变(d);高速相机拍摄的微胶囊形成过程(e)Fig.2 Effect of inter phase flow rate and outer phase flow rate on the diameter and wall thickness of the oil-core microcapsules.Effect of inter phase flow rate on the diameter and wall thickness of the microcapsules,external phase flow rate remains constant at 10 ml/h(a).The physical map of the microcapsules generated at different inter phase flow rates,external phase flow rate remains constant at 10 ml/h(b).Effect of external phase flow rate on the diameter and wall thickness of the microcapsules,inter phase flow rate remains constant at 0.5 ml/h(c).The physical map of the microcapsules generated at different external phase flow rates,inter phase flow rate remains constant at 0.5 ml/h(d).The formation process of microcapsules captured by a high-speed camera (e)
2.3 微流控器件结构对油核微胶囊的影响
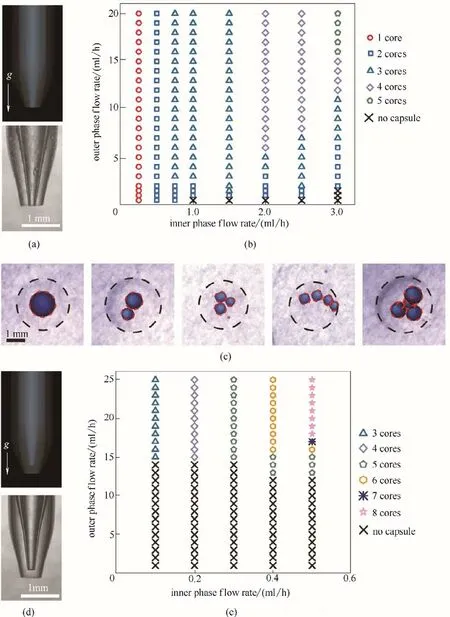
图3 玻璃毛细管微流控器件结构对油核微胶囊的影响:内管管口与外管管口平齐的玻璃毛细管微流控器件(a);管口平齐微流控器件制备微胶囊的相图(b);管口平齐微流控器件制备得到的多核微胶囊实物图(c);内管管口缩进外管管口的玻璃毛细管微流控器件(d);内管缩进外管微流控器件制备微胶囊的相图(e)Fig.3 Effect of glass capillary microfluidic devices on the oil-core microcapsules.Glass capillary microfluidic device with inner tube orifice flush with outer tube orifice(a).Phase diagram of microcapsules prepared by microfluidic devices with flush nozzles (b).Physical image of multi-core microcapsules prepared by a flush nozzle microfluidic device (c).Glass capillary microfluidic device with inner tube orifice retracted into outer tube orifice(d).Phase diagram of microcapsules prepared by microfluidic device with inner tube retracted into outer tube(e)
进一步研究了微流控器件结构对油核微胶囊的影响(图3)。图3(a)、(d)分别示出了内管管口与外管管口平齐和内管管口缩进外管管口的玻璃毛细管微流控器件。通过系统改变内相流速和外相流速,分别确定了管口齐平和内管缩进外管的微流控器件制备微胶囊的相图,如图3(b)、(e)所示。与内管伸出外管微流控器件相比,在管口齐平和内管缩进外管的微流控器件中,由于外管的聚焦作用,外相水凝胶相对内相油相的剪切作用明显增强,生成的油核液滴较小;并且随着内相油相流速的增加,油核由一个油相液滴逐渐增加到两个、三个、四个、五个等多个油相液滴,如图3(c)所示。管口齐平微流控器件与内管缩进外管的微流控器件相比,外相水凝胶相对内相油相的剪切作用更强,在较小的外相流速下就能剪切内相形成油相液滴。对应200 μm管口的内管和600 μm管口的外管,所得微胶囊的油核尺寸最小可达300 μm。
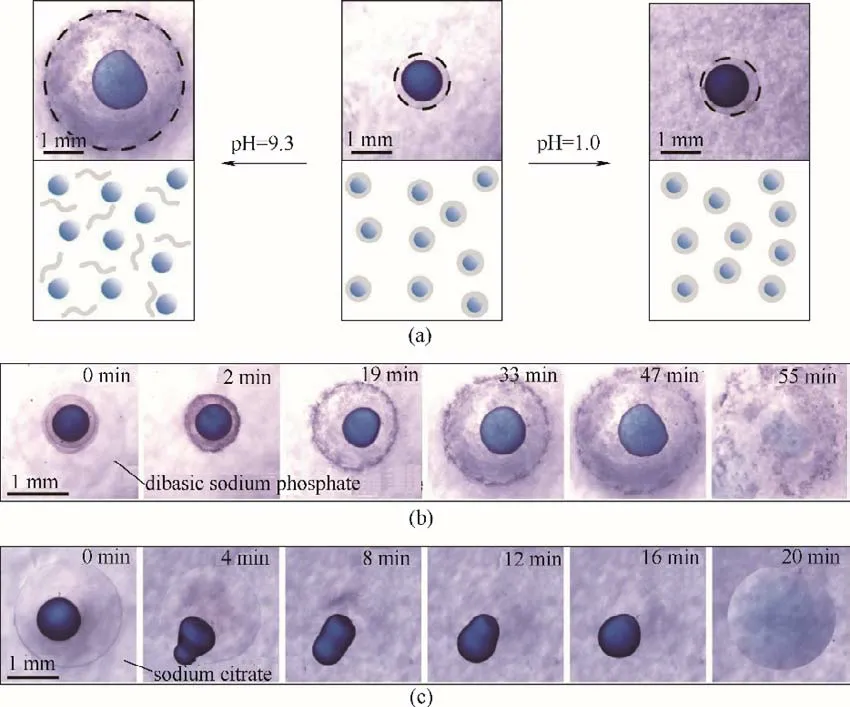
图4 生物相容油核微胶囊的pH响应和快速释放:油核微胶囊的pH响应(a);磷酸氢二钠激发油核微胶囊的快速释放(b);柠檬酸钠激发油核微胶囊的快速释放(c)Fig.4 pH-triggered fast release of oil cores from biocompatible microcapsules.pH response of oil core microcapsules(a).Dibasic sodium phosphate stimulates rapid release of oil core microcapsules(b).Sodium citrate stimulates rapid release of oil core microcapsules(c)
2.4 油核微胶囊的可控释放
所制备的油核微胶囊具有良好的生物相容性,是各种活性物质的理想载体,通过调节微胶囊的壁厚和壳层的物理化学性质,能够实现pH 响应的快速释放、壁厚调控的缓慢释放等多种功能,从而可以根据实际情况,实现活性物质的可控释放。相比多核微胶囊,单核微胶囊的应用较为广泛,针对油核微胶囊的可控释放,均采用单核微胶囊作为载体进行测试。由于油核微胶囊的壳层是由海藻酸钠水凝胶通过二价钙离子交联形成,油核微胶囊在酸性环境下能够长时间保存,但在碱性环境下海藻酸钠水凝胶与二价钙离子的结合能力变弱,交联网络被破坏,从而快速释放油核液滴,如图4(a)所示。例如,在溶液中加入Na2HPO4,由于磷酸氢根对应的盐溶液呈弱碱性,二价钙离子倾向于与磷酸氢根结合,交联网络被破坏,如图4(b)所示。同样的柠檬酸钠也可以破坏水凝胶的交联网络,实现油核液滴的快速释放,如图4(c)所示。因为油核密度小于水,当壳层被破坏后,油核在浮力作用下上升,离开显微镜焦平面,从而在显微镜视野中消失。
除了通过破坏油核微胶囊的壳层实现油核的快速释放,微胶囊的壳体还可以充当活性物质缓慢释放的有效屏障,并且因为微胶囊的尺寸均一可控,可以通过改变微胶囊的壁厚调节活性物质的释放速率,如图5 所示。通过在内相异壬酸异壬酯中加入易挥发的正己烷,作为易挥发活性物质的模型。然后将油相液滴包裹在微胶囊中,制备得到不同壁厚的微胶囊,如图5(b)所示。将微胶囊从水中取出,在干燥箱中去除微胶囊壳层中的水分后,观察得到不同壁厚微胶囊的释放曲线,如图5(a)所示。在未包裹条件下,正己烷快速挥发。当包裹在微胶囊中,正己烷的挥发速率显著减小,并且随着壁厚的增加逐渐减小。这些结果表明,除了外界条件改变触发的快速释放,本文制备的微胶囊还提供了一种简单的调节活性物质缓速释放的平台,可以应用于香氛的可控释放等场景。
3 结 论
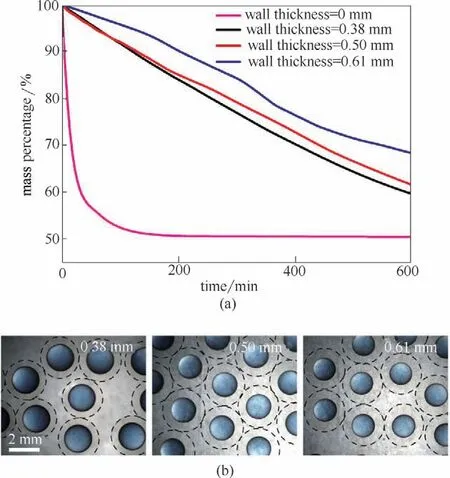
图5 油核微胶囊的缓慢释放:不同壁厚油核微胶囊中活性物质的缓慢释放曲线(a);不同壁厚油核微胶囊的实物图(b)Fig.5 Sustained release of oil-core microcapsules.Sustained release curves of active substances in oil-core microcapsules with different wall thicknesses(a).Physical image of oil core microcapsules with different wall thicknesses(b)
本文采用玻璃毛细管微流控器件一步法制备油核微胶囊,并系统研究了微流控器件结构、内相流速、外相流速等参数对油核微胶囊油核数量、微胶囊直径、壁厚等性质的影响规律。采用内相为活性油相物质,外相为水凝胶相,成功一步法制备得到尺寸均一、直径和壁厚可控、包裹效率和装载率高的生物相容油核微胶囊。并利用微胶囊作为活性物质的载体,展现了微胶囊快速释放、缓慢释放活性物质等功能。这些结果表明了油核微胶囊作为多用途的载体,可针对实际情况需求,调节微胶囊的性质,选择合适的释放方式,在食品、生物、医药等领域具有重要应用价值。
