血清白蛋白-铜酞菁纳米粒子用于线粒体靶向光疗
2021-01-30于富强杜健军路杨马贺樊江莉孙文龙飒然彭孝军
于富强,杜健军,2,路杨,马贺,樊江莉,2,孙文,2,龙飒然,2,彭孝军
(1 大连理工大学精细化工国家重点实验室,辽宁大连116024; 2 大连理工大学宁波研究院,浙江宁波315016)
引 言
光动力治疗,作为一种新型肿瘤治疗方法,可与传统治疗方法(如化疗、放疗和手术)优势互补实现协同治疗肿瘤的效果。光动力治疗主要是利用光敏剂在光照条件下通过能量或电子转移等方式与周围氧气、溶剂等小分子反应产生有毒的活性氧物种(reactive oxygen species,ROS),从而杀死肿瘤细胞。由于肿瘤细胞的恶性繁殖,大量消耗氧气,实体肿瘤内部的乏氧环境严重影响了光动力治疗、化疗及放疗的治疗效果[1-2]。同为光疗策略,光热治疗的原理是基于小分子的光热转换能力,将光能转化为热能,通过提升局部微环境的温度杀死肿瘤细胞[3]。由于光热治疗不依赖于氧气,且同为光激发治疗方法,因此常和光动力治疗联合使用[4]。目前,各类无机或无机-有机杂化材料被开发用于光动力-光热联合治疗[5-7],如金纳米粒子[8]、碳纳米管[9]、二氧化钛[10]等。但上述无机材料的生物相容性及其生物代谢成为阻碍其临床应用的障碍。然而,多数文献中报道的光疗小分子大多只具备单一的光热治疗或光动力治疗能力[3]。近期,研究发现Cy7菁染料同时具备光动力与光热治疗效果,但其光、热稳定性需要极大提升以满足临床应用[11]。因此,开发具有良好生物相容性及光热稳定性的功能染料分子是实现光热-光动力联合治疗的有效途径。
酞菁类化合物具有吸收波长长(λmax>660 nm)、消光系数高(εmax>105L·mol-1·cm-1)、稳定性好等特点,被广泛应用于太阳能电池、传感器和催化等领域[12]。研究发现,锌酞菁可以作为一种光敏剂,用于光动力治疗[13-15]。Li 等[16]报道了通过超分子自组装的方法,即直接用抗癌药物米托蒽醌和锌酞菁光敏剂组装成纳米结构,该纳米结构表现出核酸响应分解的能力,能够用于肿瘤成像,并显著提高了抗癌效果。Li等[17]报道了铜酞菁(CuPc)可用于光热治疗,可有效地避免因肿瘤缺氧而导致治疗效果下降的情况。Jiang等[18]报道了石墨烯作为CuPc的载体,有效增加了其光热治疗效果。药物输送系统能够有效地增加循环时间并且能够在病变部位释放药物[19-21],不仅可以应用于化疗药物[22-23]、基因药物的输送[24],还适用于光热治疗[25]与光动力治疗[26-27]试剂的输送。血清白蛋白是血液中最主要的转运蛋白之一,在血液循环中具有良好的稳定性,是构建纳米药物输送系统最合适的原料之一[28]。小分子药物与蛋白质相互作用时一般存在以下几种作用力:(1)小分子药物进入血清白蛋白质大分子的空腔中,药物的疏水基团与血清白蛋白质疏水空腔的疏水作用;(2)药物与血清白蛋白超分子化合物形成过程中产生的氢键作用和范德华力;(3)药物所带的电荷与血清白蛋白所含电荷存在静电作用[29]。血清白蛋白不但可以增加体系的生物相容性,还可以有效地携带药物穿透细胞膜到达细胞质,作用于细胞核或各种亚细胞器[30-31]。线粒体是细胞内产生ROS 的主要来源,在基因表达、细胞凋亡、细胞氧化应激等细胞活动中都有着重要的调控作用。基因突变、代谢异常等会引起线粒体功能障碍从而导致ROS 的聚集,进而使线粒体结构损伤、代谢异常,进而促进细胞死亡。肿瘤细胞具有快速增殖的特点,致癌基因的活化会使线粒体为其代谢活动提供足够的能量。靶向线粒体的治疗策略会影响线粒体的相关代谢活动,进而对细胞造成损伤[32]。
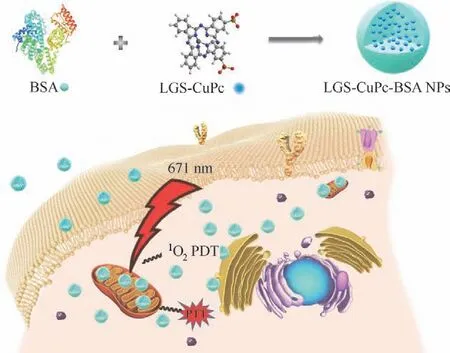
图1 用于线粒体靶向光疗的血清白蛋白-铜酞菁(LGSCuPc-BSA)纳米粒子的制备及光疗过程Fig.1 Schematic illustration of preparation of LGS-CuPc-BSA NPs for mitochondrial targeted phototherapy
综上,如图1,本文利用牛血清白蛋白(BSA)与β位磺酸二取代的铜酞菁染料直接蓝86(LGS-CuPc)自组装,制备了LGS-CuPc-BSA 纳米粒子。结果表明,在671 nm 光源激发下,LGS-CuPc-BSA 表现出明显光动力效果,其ROS 产率约为23.3%;同时,LGS-CuPc-BSA 展现出其固有光热治疗效果(光热转换效率为36.8%)。测试结果表明,BSA 不仅能够增加体系的生物相容性,还可以提升光热效果以及增加ROS 产率。经BSA 负载的LGS-CuPc 纳米粒子具有很好的稳定性和较低的生物毒性,能够穿透细胞膜定位于肿瘤细胞线粒体,为光动力-光热联合靶向治疗肿瘤提供了一种有效的方法。
1 实验材料和方法
1.1 实验材料
牛血清白蛋白(BSA);直接蓝86(LGS-CuPc,C.I.Direct Blue86,购于上海染料研究所有限公司,结构如图A1);磷酸缓冲盐溶液(PBS);1,3-二苯基异苯并呋喃(DPBF);亚甲基蓝(MB);锌酞菁(ZnPc);培养基(DMEM);消化酶(EDTA);噻唑蓝(MTT);钙黄素(AM);碘 化 丙 啶(PI);Mito-Tracker Green;ROS 试 剂 盒(DCFH-DA); Hoechst33324;无水甲醇;实验所用的去离子水均来自milli-Q 系统。人乳腺癌细胞(MCF-7)从中国医学科学院基础医学研究所(IBMS)购买。
1.2 分析测试仪器
Cary60紫外可见分光光度计(美国Aglien公司);HT7700 EXALENS 透射电子显微镜(日本日立公司);ZS90 型纳米粒径/Zeta 电位分析仪;FV1000-IX81 共 聚 焦 荧 光 显 微 镜(日 本Olympus 公 司);Thermo VarioskanTMLUX 多功能酶标仪(赛默飞世尔科技有限公司);小动物活体成像系统(NightOWL ⅡLB983)。
1.3 LGS-CuPc-BSA NPs的制备
将2 mg 的LGS- CuPc 分散在1 ml 甲醇中,将LGS-CuPc 甲醇溶液(1 ml)与BSA(30 mg)水溶液(11 ml)室温搅拌12 h,然后用透析法透析除去游离的染料分子,离心后冷冻干燥得到LGS-CuPc-BSA 纳米粒子。
1.4 LGS-CuPc-BSA NPs的表征
采用紫外-可见分光光度计进行吸收测试,使用透射电子显微镜对纳米粒子进行形貌分析以及粒径检测,采用纳米粒径/Zeta 电位分析仪进行粒径大小和电位测试以及稳定性测试。
1.5 LGS-CuPc-BSA NPs 的包封率以及载药率的测定
首先测定不同浓度LGS-CuPc在DMF中的标准吸收曲线,将5 μg LGS-CuPc-BSA NPs 分散在10 ml含有1 mg·ml-1胰蛋白酶溶液,37℃搅拌过夜。上层清液过滤,用紫外可见分光光度法测定在671 nm 处的吸光度,通过标准吸收曲线计算滤液的浓度C0,载药率和包封率计算如式(1)~式(2)[33-34]:
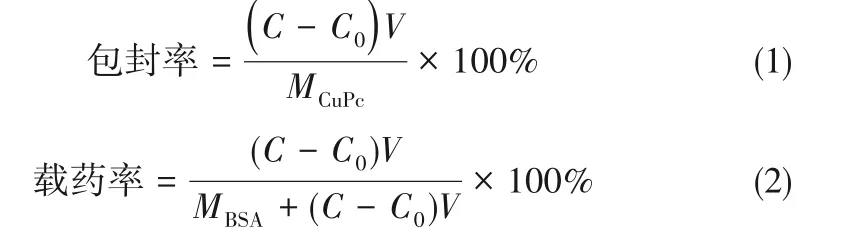
式中,C是LGS-CuPc浓度,μg·ml-1;C0是滤液中LGS-CuPc 浓度,μg·ml-1;V 是溶液体积,ml;MCuPc是LGS-CuPc总质量,μg;MBSA是BSA总质量,μg。
1.6 活性氧的检测
采用活性氧响应探针DPBF 评价LGS-CuPc-BSA NPs 的ROS 生成能力,MB 作为标准光敏剂,在DMF 中ROS 产率为0.52。将DPBF(30 μmol·L-1)与含LGS-CuPc 和LGS-CuPc-BSA NPs DMF 溶 液 混合,混合溶液在波长671 nm 光功率密度为2 mW·cm-2光照射每10 s 一次,在照射过程中记录不同时间的吸收变化。此外,还记录了DPBF 和LGS-CuPc以及LGS-CuPc-BSA NPs 溶液的吸收光谱变化。LGS-CuPc 和LGS-CuPc-BSA NPs 的ROS 产率ΦΔ计算公式如式(3)[35]:
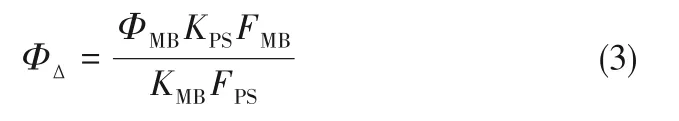
式中,Φ 是单线态量子产率;K 是DPBF 随时间增加吸光度值逐渐减小的斜率;F 是吸光度校正因子(F=1~10-OD,OD 为光敏剂的吸光度值);下角标MB是标准光敏剂;PS是待测染料。
1.7 光热转换效率测试
用热红外摄像机实时记录样品的热成像。LGS-CuPc 和LGS-CuPc-BSA NPs 在PBS 中的浓度分别为20、30 和40 μmol·L-1,以PBS 作为对比,采用波长671 nm,功率为800 mW·cm-2的激光照射每1 min 记录实时温度,观察温度变化,共照射10 min。为评价LGS-CuPc-BSA NPs 的光热稳定性,记录100 min 对应的温度变化,每个循环20 min,共五个循环,利用式(4)~式(6)计算光热转换效率:
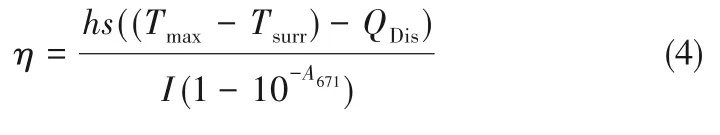
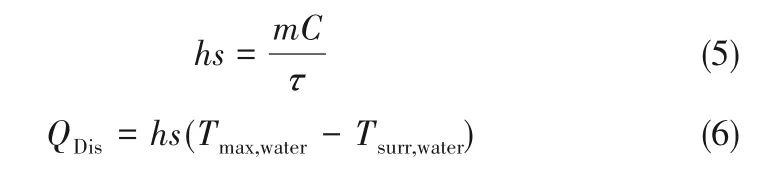
式中,η 是光热转换效率;h 是传热系数;s 是容器光辐射表面积;Tmax是系统最高温度,℃;Tsurr是环境温度,℃;QDis是石英样品池与水系统内部产生的基准能量,W;τ 是系统内时间常量;I 是光照功率,W·cm-2;m 是 溶 液 质 量,g;C 是 溶 液 比 热 容,J·g-1·℃-1;Tmax,water是水的最高温度,℃;Tsurr,water是水的环境温度,℃;A671是溶液在671 nm波长处的吸光度。
1.8 MTT法测定细胞毒性实验
将接种MCF-7 细胞(100 μl,1×105个/毫升)的96孔细胞培养板置于5%CO2,37℃条件下培养24 h。用含有不同浓度染料的培养基替换,继续培养4 h。用激光(800 mW·cm-2)照射10 min 后继续放入培养箱中培养,用含有5 mg·ml-1MTT (100 μl)的培养基替换并继续培养4 h,在观察到有大量蓝紫色的结晶生成后移走培养基,加入100 μl DMSO 后轻轻摇晃,用酶标仪分别检测570 nm和630 nm的吸光度值,依据式(7)计算细胞活性[36-37]:
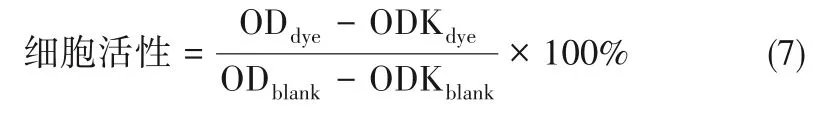
式中,ODdye是染料分子孔的吸光度值;ODKdye是染料分子孔的空白吸光度值;ODblank是对照孔的吸光度值;ODKblank是对照孔空白吸光度值。
1.9 活死细胞染色成像实验
Calcein AM/PI 双染试剂盒可以实现多活死细胞的标记。将MCF-7 细胞在含2 ml 培养基的共聚焦皿中于37℃、5% CO2环境下培养24 h 后,800 mW·cm-2的激光照射10 min,同时加入2 μl Calcein AM 和PI 对细胞进行染色处理30 min,在共聚焦显微镜下观察荧光。
1.10 细胞内活性氧的产生成像实验
取100 μl 的MCF-7 细胞(1×105个/毫升)在含2 ml 培养基的共聚焦皿中培养24 h(37℃,5%CO2),随后加入负载荧光染料的LGS-CuPc-BSA NPs,孵育1 h。PBS 清洗3 次后加入2 ml 含有10 μmol·L-1的DCFH-DA 培养基溶液,孵育30 min 后,用PBS 清洗3 次,加入2 ml 培养基,再用671 nm 的激光照射10 min后进行共聚焦成像。
1.11 细胞核染色
取100 μl 的MCF-7 细胞(1×105个/毫升)在含2 ml培养基的共聚焦皿中在37℃、5%CO2环境下培养24 h 后,加入负载荧光染料的LGS-CuPc-BSA NPs(10 μmol·L-1),孵育1 h 后用Hoechst33342 进行细胞标记,孵育10 min 后用PBS 清洗3 次后加入2 ml 培养基,最后进行共聚焦成像。
1.12 线粒体共定位成像
取100 μl 的MCF-7 细胞(1×105个/毫升)在含2 ml 培养基的共聚焦皿中在37℃、5%CO2环境下培养24 h 后,加入负载荧光染料的LGS-CuPc-BSA NPs,孵育1 h,之后选用商业化染料(Mito-Tracker Green,λex=488 nm,λem=510~560 nm)孵育30 min 后,用PBS清洗3 遍,加入新鲜的培养基。共聚焦进行成像观察,并且记录荧光通道图像,并进行叠加检测纳米粒子的定位。
1.13 体内荧光成像
Balb/c 雌性小鼠(雌6 周龄左右)购自大连医科大学SPF 实验动物中心,动物实验是根据美国国立卫生研究院出版的《实验动物护理和使用指南》进行的,该动物实验得到了大连理工大学动物伦理委员会的批准。
将5×106个/毫升细胞PBS 悬液进行皮下注射,7 d后进行体内荧光成像。由于LGS-CuPc 没有荧光,引入亚甲基蓝(MB)构建LGS-CuPc/MB-BSA NPs;另一方面,采用具有荧光信号的ZnPc 代替CuPc。通过肿瘤小鼠尾静脉注射50 μl PBS配制的药物,使用小动物成像仪进行不同时间的体内荧光成像,采用665 nm激发激光和700 nm发射滤光片。
2 实验结果与讨论
2.1 LGS-BSA-CuPc NPs的表征
对LGS-CuPc 和LGS-CuPc-BSA NPs 进行了紫外-可见吸收光谱的测试,如图2(a)所示,CuPc 和LGS-CuPc-BSA NPs 的最大吸收波长均为671 nm。BSA 的透射电镜图如图A2所示,并没有形成明确的纳米结构。LGS-CuPc 通过疏水作用、范德华力以及静电作用与BSA 相结合[38-39],如图2(b)所示,LGSCuPc-BSA 体系呈现均匀分散的球形结构(粒径约55 nm),证明LGS-CuPc与BSA自组装形成了球形纳米粒子。动态光散射(DLS)结果显示LGS-CuPc-BSA NPs 的平均粒径约为60 nm(图A3),这是由于LGS-CuPc-BSA NPs 与溶剂层结合的水化粒径略大于TEM 测量的结果[40]。LGS-CuPc-BSA NPs 的zeta电位约为-9.8 mV,表面带负电荷和较小的粒径能够使其增强通透性和在肿瘤部位积聚滞留的效应(图A4)[41]。如图A5 所示,制备的LGS-CuPc-BSA NPs 具有良好的稳定性,从而可以延长纳米颗粒的循环时间。
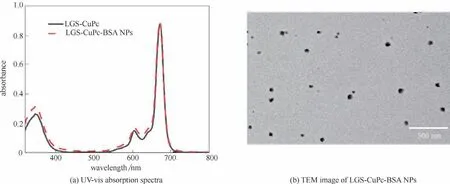
图2 LGS-CuPc 和LGS-CuPc-BSA NPs的吸收光谱(a)和LGS-CuPc-BSA NPs的透射电镜图(b)Fig.2 UV-vis absorption spectra of LGS-CuPc and LGS-CuPc-BSA NPs(a)and TEM image of LGS-CuPc-BSA NPs(b)
2.2 LGS-CuPc-BSA NPs载药率与包封率的计算
LGS-CuPc-BSA NPs 的制备是将BSA 与LGSCuPc 混合,然后在纯水中透析去除游离的LGSCuPc,离心后冷冻干燥后得到纳米粒子。基于LGS-CuPc在671 nm处的标准曲线(图A6,图A7),通过式(1)、式(2)计算LGS-CuPc-BSA NPs中LGS-CuPc的加载率为90.5%,包封率为5.8%。
2.3 LGS-CuPc与LGS-CuPc-BSA NPs 的光致活性氧产率的检测
以亚甲基蓝为参比,将DPBF(30 μmol·L-1)与LGS-CuPc 和LGS-CuPc-BSA NPs 溶液分别混合,使用波长671 nm(2 mW·cm-2)的光照射。其中,亚甲基蓝样品每5 s 照射一次[图3(a)],LGS-CuPc-BSA NPs[图3(b)]和LGS-CuPc[图3(c)]每10 s 照射一次,DPBF在410 nm 处的吸光度随时间增加而不断下降,表明LGS-CuPc 和LGS-CuPc-BSA NPs 产生了ROS。通过式(3)计算,LGS-CuPc 的ROS 产率为18.5%,LGSCuPc-BSA NPs 为23.3%[图3(d)]。LGS-CuPc 会以二聚体或多聚体的形式存在,导致其吸光程度减弱,进而降低了ROS 的产率,而BSA 可以使其LGSCuPc 均匀分散,进而增强对光的吸收,从而增加ROS 产率[17]。此外,带有磺酸基的LGS-CuPc 与BSA的胺基的相互作用,导致系间窜跃效率增加,有利于ROS的产生[42]。
2.4 光热转换效率测试
为了测定LGS-CuPc-BSA NPs 的光热转换效率,用波长671 nm(800 mW·cm-2)激光照射10 min。如图4(a)所示,和PBS 对比溶液比较,不同浓度的LGS-CuPc 溶液温度升高明显,表明LGS-CuPc 可以快速将近红外光有效地转换为热能。如图4(b)所示,在相同浓度的条件下,LGS-CuPc-BSA NPs 比LGS-CuPc 的温度平均升高2℃左右,这是由于单纯的LGS-CuPc 部分会以二聚体或多聚体的形式存在,导致其吸光程度有所减弱,进而降低了光热转换效果;而BSA 的加入会使其分散均匀,展现良好的光热效果[17]。如图4(c)所示,LGS-CuPc-BSA NPs在5次循环周期下还具有很好的光热稳定性。通过式(4)~式(6)和图4(d)计算其光热转换效率为36.8%,高于文献中已报道的无机纳米结构[43],如Cu2-xSe(22%)和Cu3BiS3(27.4%)等[44]。因此,LGS-CuPc-BSA NPs的高光热性能和优异的光稳定性使其可以作为治疗癌症的光热试剂。
2.5 LGS-CuPc与LGS-CuPc-BSA NPs 的细胞毒性研究
选用MCF-7细胞作为研究对象,采用相同浓度梯度的LGS-CuPc 与LGS-CuPc-BSA NPs 进行细胞毒性评价,测试结果如图5(a)、(b)所示,在不同浓度(0~32 μmol·L-1)的LGS-CuPc-BSA NPs 与LGS-CuPc孵育下,细胞没有表现出明显的毒性(细胞存活率>90%)。经波长671 nm,功率为800 mW·cm-2光照射10 min后,LGS-CuPc-BSA NPs 与LGS-CuPc 对细胞都造成了明显的杀伤,且LGS-CuPc-BSA NPs 对细胞损伤的效果明显优于LGS-CuPc。通过钙黄素(calcein-AM,绿色)和碘化丙啶(PI,红色)的细胞染色实验结果进一步证实了光照后细胞的凋亡。如图6所示,LGS-CuPc 组细胞在未经激光照射时细胞正常存活,而经激光照射后的细胞则表现出红色荧光和部分绿色荧光,说明部分细胞死亡。LGS-CuPc-BSA NPs组细胞在未经激光照射时细胞几乎未死亡(绿色荧光);而经激光照射后,视野内细胞均表现出均匀的红色荧光,证明细胞完全死亡,表明LGSCuPc与BSA 自组装后能够显著地提升其治疗效果,与MTT实验结果一致。
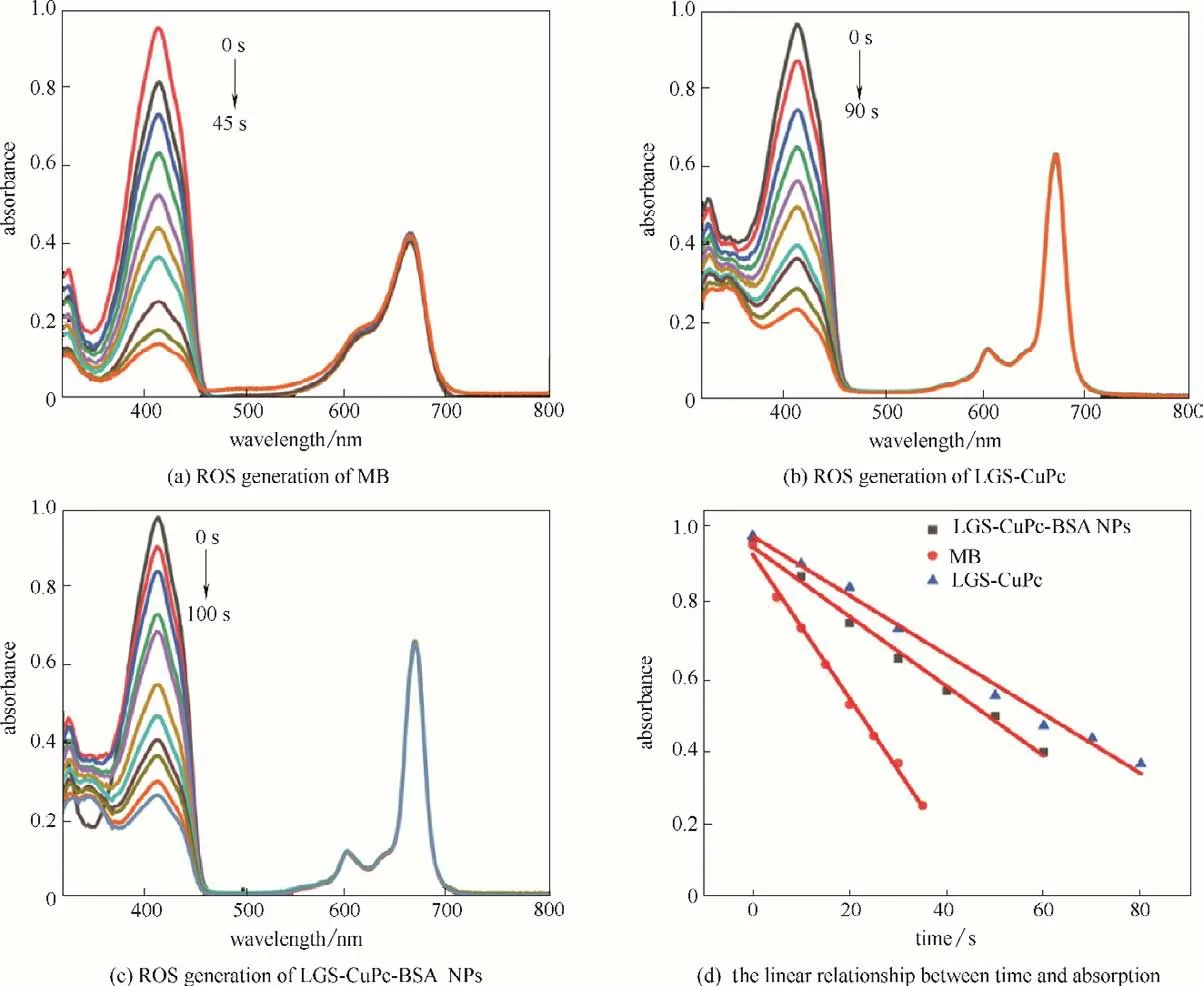
图3 在DMF中DPBF检测MB(a)、LGS-CuPc(b)、LGS-CuPc-BSA NPs(c)体系ROS的产生;MB、LGS-CuPc和LGS-CuPc-BSA NPs的时间与吸收的线性关系(d)Fig.3 Singlet-oxygen generation of MB(a),LGS-CuPc(b),LGS-CuPc-BSA NPs(c)in DMF with DPBF,and the linear relationship between time and absorption of MB,LGS-CuPc,and LGS-CuPc-BSA NPs(d)
2.6 细胞内活性氧荧光成像
为了验证LGS-CuPc-BSA NPs 的光动力治疗机理,使用DCFH-DA(商业化的ROS 捕获剂),跟踪光动力治疗过程中的ROS 产生。如图7 所示,在671 nm 光照射下,发现DCF 有强烈的荧光,表明LGSCuPc-BSA NPs作为一种有效的光敏剂,在光的照射下能在细胞内产生ROS。
2.7 细胞核染色与线粒体共定位成像
将近红外荧光染料共同负载于LGS-CuPc-BSA NPs中,在MCF-7细胞中培养2 h。共聚焦成像如图8所示,LGS-CuPc-BSA NPs的荧光主要分布于细胞的细胞质,表明纳米粒子有着良好的生物相容性和快速进入细胞的能力,并且发现纳米粒子不定位于细胞核。
线粒体是细胞生产ATP 的主要场所,一旦线粒体遭到破坏将导致整个细胞的凋亡[45-48]。为了验证LGS-CuPc-BSA NPs 的定位能力,选取商业化染料Mito-Tracker Green 与LGS-CuPc-BSA NPs 在MCF-7 细胞中共同孵育。如图9 所示,绿色通道采集到的Mito-Tracker Green 染料信号与红色通道LGSCuPc-BSA NPs的荧光信号有很好的叠加,共定位系数为0.86,表明LGS-CuPc-BSA NPs 进入细胞后主要分布于细胞的线粒体中。由细胞荧光成像和线粒体共定位成像表明BSA 能够有效地提升LGSCuPc 的生物相容性和促进其穿透细胞膜的能力,并靶向线粒体中,经光激发破坏线粒体进而使整个细胞凋亡。
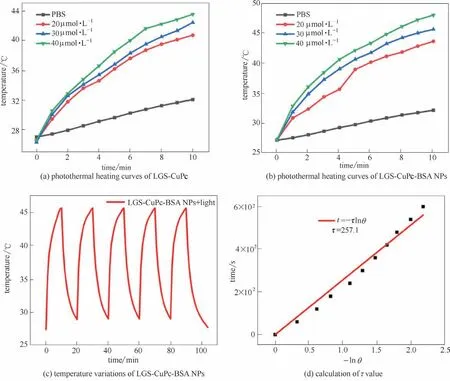
图4 光照(671 nm,800 mW·cm-2)不同浓度的LGS-CuPc(a)和LGS-CuPc-BSA NPs(b)的光热曲线温度变化,LGS-CuPc-BSA NPs五个循环的温度变化(每个循环20 min)(c)和τ值的计算曲线(d)Fig.4 Photothermal heating curves for the change of temperature with time in different concentrations (20,30,and 40 μmol·L-1)of LGS-CuPc(a),LGS-CuPc-BSA NPs irradiated by 671 nm laser(800 mW·cm-2)(b).The temperature variations of LGS-CuPc-BSA NPs for 5 cycles(20 min per cycle)(c).Calculation of τ value(d)
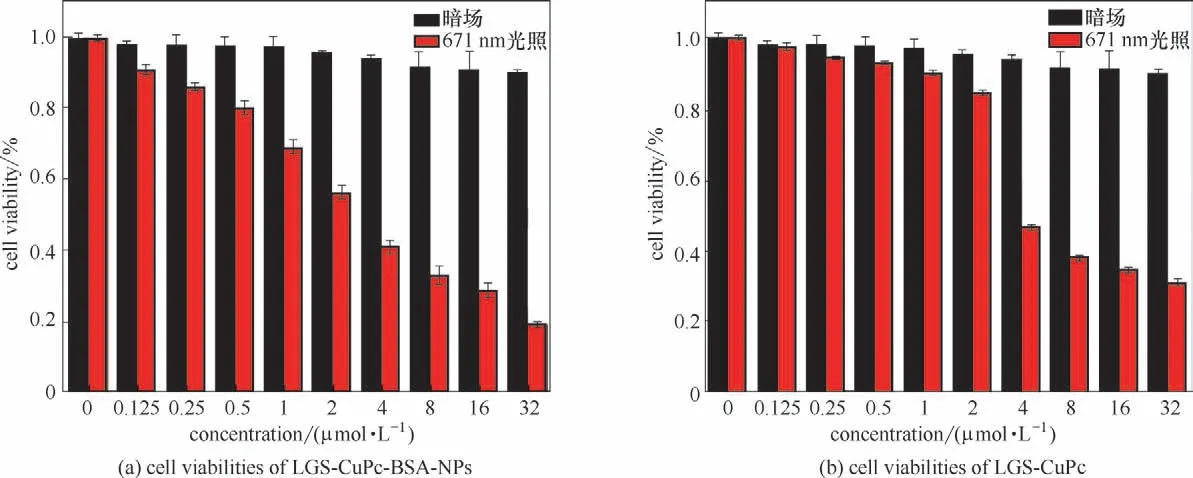
图5 在671 nm(800 mW·cm-2)激光照射10 min下经不同浓度的LGS-CuPc-BSA NPs(a)和LGS-CuPc(b)处理的细胞活性Fig.5 Cell viabilities after treatments with different concentrations of LGS-CuPc-BSA NPs (a)and LGS-CuPc(b)with and without 671 nm(800 mW·cm-2)laser irradiation for 10 min

图7 在MCF-7细胞中ROS的产生Fig.7 ROS generation in MCF-7 cells
2.8 小鼠体内荧光成像
静脉给药后随着时间的延长(图A8),LGSCuPc/MB-BSA NPs 在肿瘤部位的富集逐渐提高,且荧光强度在24 h 达到最大,随后逐渐减少,在72 h后依然有少量富集,说明LGS-CuPc-BSA NPs 在小鼠体内具有很好的靶向效果及保留效率。相反,ZnPc(代替CuPc)在4 h肿瘤处的荧光强度达到最大,24 h后只有少量保留。同时小鼠不同器官有大量的染料分子富集,说明染料分子的靶向效果与保留效率不足,且在小鼠体内的循环时间明显短于纳米粒子的循环时间。
3 结 论
(1)通过LGS-CuPc 和BSA 自组装构建得到LGS-CuPc-BSA NPs 纳米颗粒,LGS-CuPc-BSA NPs在PBS缓冲溶液中分布均匀,平均粒径约为60 nm。
(2)实验证明LGS-CuPc-BSA NPs 具有光动力和光热治疗效果,且LGS-CuPc-BSA 的ROS 产率和光热效果均高于LGS-CuPc。这是由于BSA 的加入可以抑制LGS-CuPc 自身的聚集,从而增加对光的吸收程度及利用。
(3)细胞实验表明LGS-CuPc-BSA NPs 具有较低的细胞毒性和良好的光疗效果,并且在体内循环时间可以达到72 h。共定位实验证明该纳米粒子能够穿透细胞膜并且定位于细胞线粒体中,通过使线粒体凋亡进而促进癌细胞凋亡。
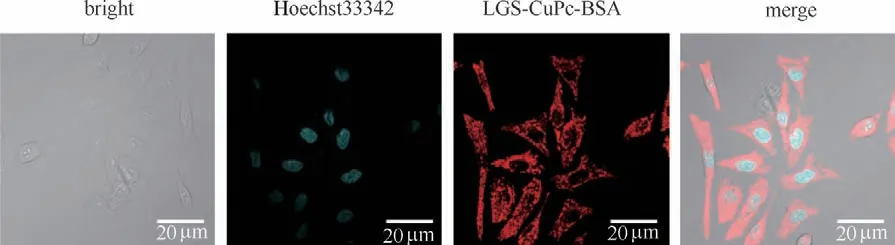
图8 Hoechst33342和LGS-CuPc-BSA NPs在MCF-7细胞中的荧光共聚焦成像Fig.8 Confocal fluorescence images of Hoechst33342 and LGS-CuPc-BSA NPs in MCF-7 cells

图9 LGS-CuPc-BSA NPs与Mito-Tracker Green共定位成像Fig.9 Co-localization imaging of LGS-CuPc-BSA NPs and Mito-Tracker Green in MCF-7 cells
(4)提供了一种光动与光热联合治疗的方法,为肿瘤治疗提供了一种有应用前景的光疗染料。
