预后营养指数与食管鳞癌放疗疗效及预后的相关性
2021-01-29张建国陆颖芝邵艳杨云云黄关宏马兆明
张建国 陆颖芝 邵艳 杨云云 黄关宏 马兆明
连云港市第二人民医院连云港市肿瘤医院食管肿瘤科 222023
我国是全球食管癌新发病例最多的国家,最新的流行病学数据显示,食管癌高居我国恶性肿瘤死亡第4 位;2015 年我国因食管癌死亡人数大约有18.8 万例[1-2]。虽近年来治疗食管癌的技术、手段、设备有了很大进步,也出现一些新的化疗、抗血管生成及免疫治疗药物[3-7],但食管癌的治疗效果仍较差。食管鳞状细胞癌是我国食管癌患者中最常见的病理类型,对放射线敏感,放射治疗是其重要治疗手段。因此,研究可在治疗前甄别出与放疗近期疗效及预后相关的特异指标来指导临床治疗将有重要意义。
预后营养指数(prognostic nutritional index,PNI)由血清白蛋白值和外周血淋巴细胞计数计算而来,起初用于评估胃肠外科和心脏外科患者的手术风险。近年许多研究发现,PNI 与消化道恶性肿瘤的预后密切相关,其在食管鳞状细胞癌手术患者中的研究显示,PNI是食管癌预后的一个正相关指标,并与食管癌患者术后并发症发生率关系密切[8-10]。目前PNI 在食管鳞状细胞癌放射治疗方面的研究较少,本研究探讨PNI 在食管鳞状细胞癌放射治疗后近期疗效及预后判断中的价值。
1 资料与方法
1.1 临床资料 收集2015 年1 月至2017 年12 月就诊于本院的食管癌患者。纳入标准:⑴经病理诊断为食管鳞状细胞癌;⑵放疗前7 d 内有完整的血常规、肝功能报告;⑶所有患者均行放疗或同步放化疗;⑷未行手术治疗者;⑸无远处转移。排除标准:⑴治疗前合并有其他系统疾病,如血液疾病,心、脑、肾脏等疾病;⑵治疗前存在感染;⑶存在自身免疫相关性疾病,如类风湿关节炎、炎症性肠病等;⑷入院前外院进行过治疗者;⑸临床资料及随访不完整。共入组152 例,男102 例,女50 例,中位年龄是72岁(54~86岁);病变部位:食管颈段16例,胸上段36 例,胸中段77 例,胸下段23 例;参照非手术治疗食管癌的临床分期标准进行临床分期[11],其中Ⅰ期69 例,Ⅱ期43 例,Ⅲ期40 例。本院伦理委员会批准本研究,所有患者均签署知情同意书。
1.2 PNI 计算 所有患者均在放疗前1 周内检测血常规和检查肝功能,根据其结果,计算PNI 值。计算公式为PNI=血清白蛋白值(g/L)+5×外周血淋巴细胞计数(×109/L)[10]。
1.3 放疗方法 采用瓦里安直线加速器,6MV-X 线放疗。所有患者均仰卧位使用螺旋CT 进行定位扫描,勾画靶区及周围正常器官。肿瘤靶区(GTV):综合CT 扫描图像、食管造影、胃镜、PET-CT 检查结果确定;GTVnd(转移淋巴结):CT 所见的短径≥1.0 cm 转移性颈部及纵隔肿大淋巴结(转移淋巴结与食管原发病灶距离较远时独立勾画);临床靶体积(CTV)包括GTV、GTVnd 及相应淋巴引流区,并在GTV 上下方向外扩3.0~5.0 cm,或在有淋巴结转移的CT 层面上下各放1.5 cm,GTV 和GTVnd 前后左右外扩0.8 cm,计划靶体积(PTV)为CTV 外放0.5 cm。放疗方法采用三维适形放疗或调强放疗,由物理师按照放疗计划单制定治疗方案,要求95%的PTV接受100%以上的处方剂量。PTV放疗剂量60.0~63.0 Gy,30次/6周,2.0~2.1 Gy/次,1次/d,5次/周。双肺V20≤25%,肺平均剂量≤13.0 Gy,心脏V30≤40%,V40≤30%,脊髓最大剂量≤43.0 Gy。
1.4 评价指标 放疗结束后1~3 个月行食管钡餐造影检查,近期疗效评价采用万钧食管癌放射治疗后即时疗效评价标准[12]:完全缓解(CR)、部分缓解(PR)、无效(NR),以CR+PR计算有效率。
1.5 统计学方法 数据分析采用SPSS 21.0 统计软件进行。其中计数资料对比采用χ2检验。生存数据来自患者电子病历记录、电话及微信随访。OS 是从放疗开始时间计算至随访终点或患者死亡时间。所有患者随访均从放疗开始计算至死亡,随访至2019年12月。通过受试者工作曲线(ROC)确定PNI 的最佳截点值。采用Kaplan-Meier 方法构建生存曲线,组间差异比较用Log-rank 检验,单因素及多因素的分析运用Cox 比例风险模型。P<0.05 为差异具有统计学意义。
2 结 果
2.1 ROC 曲线 本研究采用2 年OS 根据ROC 曲线确定 PNI 最佳截点值,PNI 曲线下面积(AUC)为 0.717,P<0.001。最大 Youden 指数为 0.372,对应 PNI 值为 48.9,敏感度为89.1%、特异度72.6%,将152 例患者,按PNI 截点值48.9 分为高 PNI 组(>48.9)56 例及低 PNI 组(≤48.9)96 例。见图1。
2.2 PNI 与食管鳞癌患者临床资料的关系 PNI 与ESCC 患者的食管癌病灶长度、T 分期、临床分期、有无淋巴结转移密切相关,差异有统计学意义(均P<0.05),与患者年龄、性别、肿瘤部位无相关性(均P>0.05)。见表1。
2.3 PNI 与食管鳞癌放疗疗效的关系 152 例食管鳞癌患者放疗有效121 例,有效率为79.60%。高PNI 组患者放疗近期疗效为98.2%,明显高于低PNI 组的68.8%,差异有统计学意义。见表2。

表1 PNI与食管鳞癌患者临床资料的关系
2.4 PNI 与食管鳞癌患者预后的关系 152 例患者随访 6~56 月,截止随访时间,38 例患者生存,1 年生存率66.4%,2 年生存率38.2%,中位生存时间为18.2 个月。将患者年龄、性别、肿瘤部位、病灶长度、T分期、临床分期及淋巴结转移作为影响ESCC 患者的预后因素,行log-rank 检验,并用 Kaplan-Meier 构建生存曲线。结果显示:PNI≤48.9 组(中位生存期13 个月)较PNI>48.9(中位生存期26 个月)组缩短(P<0.05,图2);肿瘤长度≤5.0 cm(中位生存期25 个月)组OS 与肿瘤长度>5.0 cm(中位生存期13 个月)组比较延长(P<0.05,图3);化疗组(中位生存期19 个月)OS 较未化疗组(中位生存期1 个月)延长(P<0.05,图4),临床T 分期中 T1、T2、T3、T4 期中位生存时间分别为 27 月、23 月、15 月、11 月。无淋巴结转移组(中位生存期19 个月)组OS较有淋巴结转移组(中位生存期12 个月)组延长,但差异无统计学意义(P=0.072);临床分期Ⅰ期、Ⅱ期、Ⅲ期中位生存时间分别为25月、17月、11月。
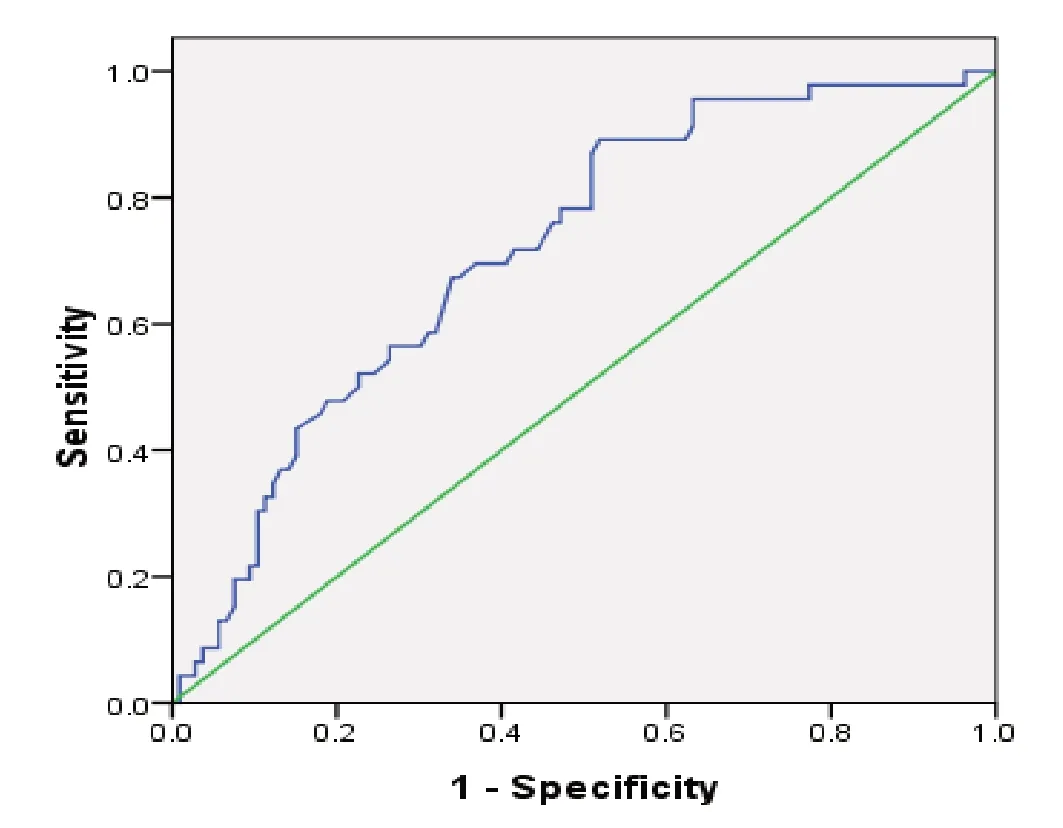
图1 预后营养指数的ROC曲线(曲线下面积=0.717)
2.5 单因素及多因素分析 在单因素回归分析中,与OS有显著相关性的因素为肿瘤长度、T分期、有无淋巴结转移、临床分期、是否化疗及PNI,见表3;将单因素分析有意义的变量纳入多因素分析显示:PNI(P=0.005)及是否化疗是影响食管鳞癌放疗患者预后的独立因素,见表3。

图2 PNI两组食管鳞癌放疗患者总生存时间曲线
3 讨 论
免疫因素和营养状态与恶性肿瘤的发生发展关系密切,已被大量研究证实[13]。血液淋巴细胞和血清白蛋白决定PNI 的大小,在一定程度可反映人体免疫及营养状态[14-15]。许多研究数据表明,PNI与多种消化系统恶性肿瘤的预后相关[16-18]。
PNI 与恶性肿瘤患者的预后相关,以下因素可能解释。⑴淋巴细胞几乎占正常人白细胞总数的30%,具有对肿瘤细胞的免疫监视和防御能力;另外淋巴细胞能分泌一些细胞因子如干扰素-γ、肿瘤坏死因子-α,这些细胞因子具有抑制肿瘤细胞增殖、促进肿瘤细胞凋亡的作用,因而淋巴细胞数量减少、功能降低,损害机体的抗肿瘤能力,进而影响患者预后[14,19-22]。⑵白蛋白在人体内发挥很重要的生理功能,如维持胶体渗透压、充当抗氧化剂清除氧自由基、抗血小板等。Kim S 等[23]研究认为以下3 种方式可能是低白蛋白血症影响患者预后的原因。第一,白蛋白是一种人体营养状况的标记物,低白蛋白血症预示患者营养状况差,提示预后不佳。其次,白蛋白也是一种抗氧化剂,且是一种有药理学特性的转运蛋白,白蛋白减少或缺乏致使这种能力降低,甚至缺乏,导致患者预后差。第三,白蛋白也是一种负性急性期蛋白,低白蛋白血症提示患者炎症状态的上升,可导致预后不良。
在食管癌手术治疗方面,PNI 的研究较多。Hirahara N等[10]的研究入组了169 例行根治性手术治疗的食管鳞状细胞癌患者,其将术前PNI 水平的最佳截点值设为49.2,多变量分析显示pTNM- III 期、PNI<49.2 是肿瘤特异性生存率(CSS)的独立不良预测因素;年龄>70、pTNM-III 期、PNI<49.2 是OS 的独立不良预测因素;在非老年患者中,pTNM-III 期和 PNI<49.2 为 CSS 和 OS 的独立不良预测因素。Okadome K 等[17]通过免疫组化方法检测了337 例手术治疗的食管癌组织中肿瘤浸润淋巴细胞(TILS)及CD8的表达水平,分析了PNI、TILS、CD8的相关性及其与临床结果间的关系,45.0作为PNI最佳截止值,结果显示:低PNI组患者的总生存率明显差于高PNI 组,PNI 与TILS 表达水平和CD8阳性细胞计数显著相关;PNI也是影响食管手术患者的独立预后因素。王岩等[18]研究了PNI 与手术治疗老年食管腺癌患者的关系,结果发现PNI 与患者肿瘤大小、淋巴结转移、TNM 分期、术后排气相关;PNI 也是影响老年食管腺癌手术患者预后的独立因素。日本的一项研究入组了191 例至少接受过1 次顺铂和5-氟尿嘧啶化疗的食管癌患者,该研究显示:0~2 级血液毒性患者的PNI 为(47.5±5.8),高于3~4 级患者的(40.3±6.7),差异有统计学意义;PNI 组患者的中位生存期为15 月,显著低于高PNI 组患者的66 月;COX 多因素分析显示,PNI 及分期是影响食管癌化疗患者OS 的独立预后因素[24]。以上研究表明,PNI 在预测手术治疗及非手术治疗(化疗为主)食管癌患者的预后方面有重要价值。

图3 食管鳞癌放疗患者病灶长度总生存时间曲线

图4 食管鳞癌患者是否化疗总生存时间曲线

表3 影响食管鳞癌患者总生存时间的单因素及多因素分析
目前关于PNI 与食管鳞状细胞癌放疗疗效及预后关系的研究较少。最近徐莹莹等[25]研究报道了放疗前PNI(最佳cut off 值为50.1)与老年食管鳞状细胞癌放疗患者的关系,该研究显示,高PNI 组老年患者放疗有效率高于低PNI组;高 PNI 组 1、2、3 年总生存率明显高于低 PNI 组;多因素分析显示,PNI为影响老年食管鳞状细胞癌患者放疗的独立预后因素。本研究显示,放疗前PNI 与患者病灶长度、T 分期、淋巴结转移及临床TNM 分期相关;高PNI组患者放疗近期疗效明显高于低PNI 组;PNI≤48.9、病灶长度>5.0 cm、T3+T4 期、有淋巴结转移及临床分期Ⅱ+Ⅲ期患者较PNI>48.9、病灶长度≤5.0 cm、T1+T2、无淋巴结转移及临床分期Ⅰ期患者预后差;多因素分析显示,PNI 是影响食管鳞癌放疗患者的独立预后因素。与以上研究结果一致。本研究PNI最佳截止值为48.9,与以上研究也相近。
综上所述,在预测食管癌放疗疗效及预后方面,放疗前PNI可能是一个简单、便捷、无创、不增加患者费用且有效的指标。但本研究是单中心、小样本的回顾性研究,在患者选择及数据收集过程中可能存在选择性偏倚。因此,仍需要更大样本的前瞻性临床及基础研究来明确PNI 在食管癌患者预后判断中的作用及机制。另外,由于不同研究中所使用的PNI 临界值不同,如何更科学、更准确地设定PNI 临界值来获得最佳的敏感度及特异度也需进一步研究。
