流式细胞分选仪高效分选条件的探索
2021-01-29黄莹莹徐琴姜宇
黄莹莹 徐琴 姜宇
1浙江大学医学院公共技术平台,杭州 310058;2浙江大学医学院附属邵逸夫医院风湿免疫科,杭州 310016;3浙江大学基础医学系,杭州 310058
近年来,流式细胞术作为临床检验中无可替代的重要技术之一[1],已普遍应用于免疫学、神经生物学、肿瘤学、血液学、造血干细胞移植等研究领域[2-5],甚至也是农业学科的有效检测方法[6],使用广泛。流式细胞仪是应用流式细胞术的有效工具,分选型流式细胞仪一般还有筛分的作用,可以根据所检测颗粒的某种性质进行分选和回收,用于后续功能试验。并且,如果整个分选的过程是在无菌条件下进行的,分选下来的细胞还可以用来继续培养。但分选之前仪器的条件设置和调试都比较繁琐、费时[7],在实际运行中受到多种因素的制约[8]。其中,分选的3 大要素,分选纯度、速度、得率是呈三角制衡关系的[9]。高效地获得高得率、高纯度的靶生物颗粒,是完成一个完美分选及下游试验的需要。然而分选速率、分选模式及不同尺寸的喷嘴均是影响分选得率的较大因素。如何优化流式细胞分选仪的关键要素,探索高效的分选条件,提高分选得率和纯度的研究,国内外并不多见。
BD FACS Sorp Aria II 是BD 公司推出的定制型高端流式细胞分选仪,与传统Aria II 相比,该仪器在激光器功率、光路设计方面都做了优化。本研究以该Sorp 机型为例,通过比较不同分选速率、分选模式及喷嘴条件下分选得率及纯度的高低,探索优化试验条件,并将优化后的条件应用于原代naïve T 细胞(初始T 细胞)的高效分选,以期达到最佳分选效果,从而为相关研究提供技术支撑与参考。
1 材料与方法
1.1 仪器、细胞与主要试剂 流式细胞分选仪(FACS Sorp Aria II)、Rainbow 荧光微球(货号:556291)及Accudrop微球(货号:345249)均购自美国Becton Dickinson 公司。CytoFLEX LX 流式细胞分析仪购自美国Beckman Coulter 公司。5 ml 无菌流式管(货号352003)购自美国BD-FALCON公司。PBS 片剂(货号252122)购自瑞典Medicago 公司。ddH2O 源自平台自有的Millipore 纯水仪(美国Millipore 公司)。6~8 周龄B6 品系小鼠由合作实验室提供;流式抗体购自BioLegend公司。
1.2 方法
1.2.1 样本制备 光路校准微球:500 μl ddH2O 加1 滴Rainbow 荧光微球;液滴延迟校准试剂:500 μl ddH2O 加1滴Accudrop 微球。上样样品:500 μl ddH2O 中加 3 滴 Rainbow荧光微球和2滴Accudrop微球,充分混匀后备用。
1.2.2 分选仪常规校准 本仪器以无菌PBS 为鞘液。启动FACS Sorp Aria II 流式细胞分选仪,打开Diva 8.0.1 软件。开启“Fluidics Startup”程序,完成后,选择合适的喷嘴及鞘液压力,再打开主液流。待液流稳定后,微调液滴频率和振幅,使卫星滴在6 滴之内与主液滴融合,点击主液流框的“sweet spot”键,仪器会自动调节液滴频率、振幅,使液流稳定在设定状态[10]。ddH2O 上样 30 min 清洗仪器管路,同时使激光器预热稳定。打开质控程序,用上述配好的光路校准微球手动进行激光延迟的校准等,质控通过后可进行后续试验。每更换1 次喷嘴须重新按照上述步骤调节仪器。
1.2.3 侧液流调校及液滴延迟计算 打开侧液流窗口的偏转电压板电压,然后打开分选测试(test sort)和waste drawer,校准收集管位置,再调节主液流振幅,并逐步调整2nddrop、3rddrop 和4thdrop 3 个指标,使液流分束清楚且光斑聚集明亮。上样上述配制的液滴延迟校准试剂,在分选设定窗口将分选模式设为fine tube 模式,计算液滴延迟。这时test sort 窗口会出现2 个框,测试时需要左右2 框数值相加等于100%,左框达到90%以上,仪器状态为可用。最后记录Drop Delay 值。每更换1 次喷嘴或分选持续进行4 h以上须重新按照上述步骤调节仪器。
1.2.4 不同分选速率、分选模式、喷嘴尺寸下分选纯度及得率的计算 以同一浓度的荧光微球(见1.2.1 上样样品配制),用purity 模式,70 μm 喷嘴,在flow rates 1.0、3.0、5.0、7.0 4 种模式下分别进行分选,每个样收10 万events。收集管用1.5 ml EP 管,预加400 μl ddH2O。分别计算分选得率、分选纯度及分选效率。
以同一浓度的荧光微球(配制同上),在一个上样速率(flow rate 1.0)下,用 70 μm 喷嘴,分别以 purity、yield 和4-way purity 3种模式进行分选,收集方式同上,分别计算分选得率、分选纯度及分选效率。
以同一浓度的荧光微球(配制同上),在一个上样速率(flow rate 1.0)下,用purity 模式,以不同尺寸的喷嘴(70、85、100 μm)分别进行分选,收集方式同上,分别计算分选得率、分选纯度及分选效率。
分选效率用Diva 软件记录后统计;分选纯度的鉴定在刚分选后使用流式细胞仪进行回测分析(回测前仪器需充分清洗干净),结果分析使用Flowjo V10 软件进行。回收率是指设定通过测量点的目标颗粒与实际收获的目标颗粒之间的比例[11]。分选后目标颗粒的计数使用CytoFLEX LX进行。
1.2.5 naïve CD4+T 细胞的分选 取6~8 周龄B6 品系Ppp2ca+/+dLck-Cre WT 和 Ppp2cafl/fldLck-Cre KO 小鼠脾脏及外周淋巴结,制成单细胞悬液。按照EasySep ™Mouse CD4+T Cell Isolation Kit 说明书分选CD4+T 细胞。富集后细胞制成5×107/ml 淋巴细胞悬液,加入流式抗体FITC-CD44、PE-CD25 、PE/cy5.5-CD4 、APC-CD62L ,按照体积比1∶200 加入细胞悬液,4℃静置 30 min,加入 2.0 ml PBS,1 400 r/min 离心5 min,并过滤制成1×107/ml~2×107/ml细胞悬液。将标记过的单细胞悬液置于BD FACS Sorp Aria II 进行分选,分选后样本取200 μl立即回测。
1.3 统计学处理 使用SPSS 16.0 软件进行统计学分析,符合正态分布的计量资料以均数±标准误(-x±s)表示,采用Duncan检验,P<0.05差异有统计学意义。
2 结 果
2.1 分选仪调试 FACS Sorp Aria II 常用喷嘴大小为70、85、100 μm,其主要参数见表1,包括鞘液压力、振荡频率及最大进样速度。由表1 可知,喷嘴孔径越大,鞘液压力越小,每秒最大进样速度也越低。仪器通过光路校准调试后,调节主液流,如图1 A所示,70 μm喷嘴在上1/3左右处开始断点,且卫星滴能在6滴之内与主液滴融合,Gap值趋于稳定状态,液流状态良好。打开分选测试框,调节侧液流相关参数,4个分叉斑点清晰可见,且分束清楚、无“散花”现象(图1 B)。通过液滴延迟调试,当Drop Delay值为40.57时分选效果最佳,左框达到99.3%(图1 C)。85、100 μm喷嘴亦能调试到良好状态(数据未展示),其Drop Delay值分别为26.60、26.80。
2.2 不同分选速率对分选效率、纯度及得率的影响70 μm 喷嘴,purity 模式下以不同的 flow rate 分选 1.2.1 配制的同一管上样样品,flow rate 1.0 条件下,分选效率最高,为(95.33±1.33)%,随着flow rate 数值的增加,分选效率显著降低(均P<0.05)。flow rates 1.0、3.0、5.0 时分选得率差异无统计学意义(均P>0.05),但flow rate 7.0 时得率显著低于1.0 和3.0 条件下得率(均P<0.05)。由此可知,上样的flow rate 值越高,分选效率和得率都会下降,尤其是该值超过5.0 时得率仅为(74.07±10.26)%。4 种模式分选下的分选纯度均达到98%以上(分选前纯度为9.23%),符合一般下游试验的要求。见表2。
2.3 不同分选模式对分选效率、纯度及得率的影响以 70 μm 喷嘴,flow rate 1.0 条件分选 1.2.1 配制的同一管上样样品,yield 模式的分选效率和得率都是最高的,分别为(99.67±0.33)%、(79.78±7.14)%。但yield 模式的纯度显著低于purity和4-way purity的(均P<0.05)。见表3。
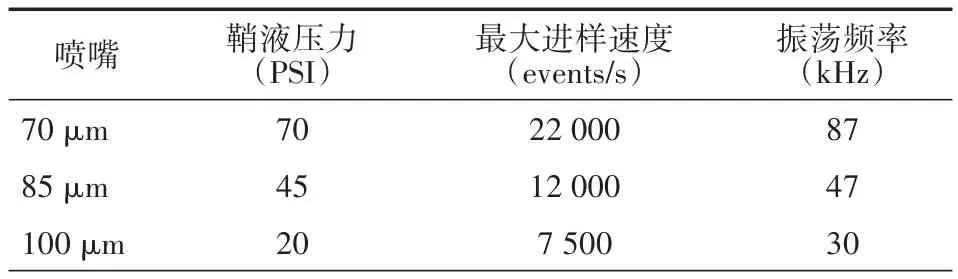
表1 FACS Sorp Aria II不同大小喷嘴下的主要参数
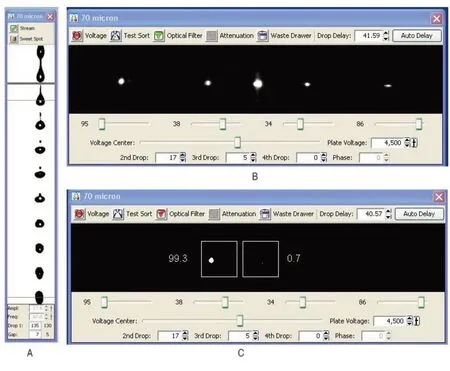
图1 分选仪液流调试图
2.4 不同尺寸的喷嘴对分选效率、纯度及得率的影响 以purity 模式,flow rate 1.0 条件分选1.2.1 配制的同一管上样样品,70 μm喷嘴分选的效率为(95.00±1.53)%,显著高于85 μm 喷嘴的(90.33±0.33)%和100 μm 喷嘴的(84.67±0.88)%(均P<0.05)。分选前目的颗粒群比例为8.90%,而3 种喷嘴条件下分选后的纯度均达到98%以上,且分选得率差异无统计学意义(均P>0.05)。见表4。
表2 不同分选速率下分选结果的比较(n=3,±s,%)
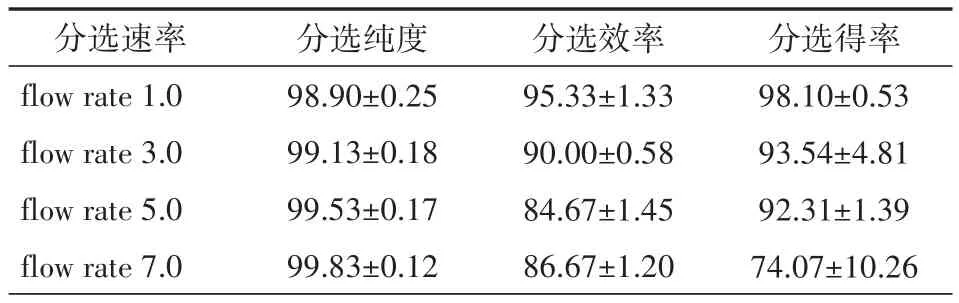
表2 不同分选速率下分选结果的比较(n=3,±s,%)
分选速率flow rate 1.0 flow rate 3.0 flow rate 5.0 flow rate 7.0分选纯度98.90±0.25 99.13±0.18 99.53±0.17 99.83±0.12分选效率95.33±1.33 90.00±0.58 84.67±1.45 86.67±1.20分选得率98.10±0.53 93.54±4.81 92.31±1.39 74.07±10.26
表3 不同分选模式下分选结果的比较(n=3,±s,%)
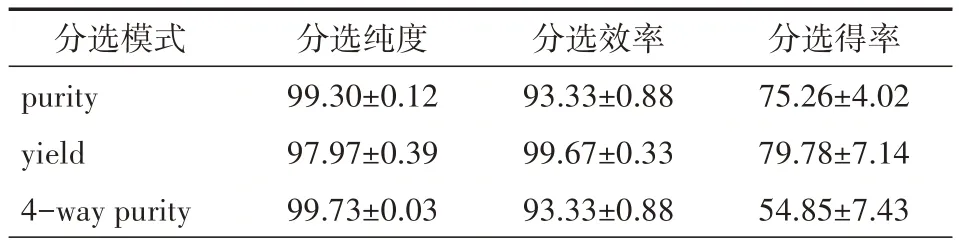
表3 不同分选模式下分选结果的比较(n=3,±s,%)
分选模式purity yield 4-way purity分选纯度99.30±0.12 97.97±0.39 99.73±0.03分选效率93.33±0.88 99.67±0.33 93.33±0.88分选得率75.26±4.02 79.78±7.14 54.85±7.43
表4 不同尺寸喷嘴下分选结果的比较(n=3,±s,%)
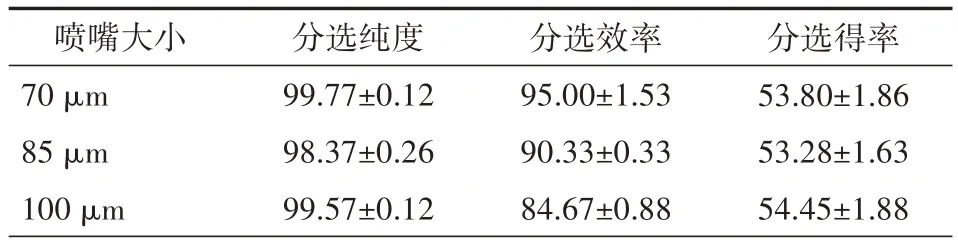
表4 不同尺寸喷嘴下分选结果的比较(n=3,±s,%)
喷嘴大小70 μm 85 μm 100 μm分选纯度99.77±0.12 98.37±0.26 99.57±0.12分选效率95.00±1.53 90.33±0.33 84.67±0.88分选得率53.80±1.86 53.28±1.63 54.45±1.88
2.5 naïve CD4+T 细胞的分选 以Ppp2ca+/+dLck-Cre WT样本为例,70 μm喷嘴、flow rate 1.0、purity模式条件下分选。P5 门为naïve CD4+T 细胞群,分选该亚群后马上进行了回测,如图2 所示,分选后纯度达到了99.2%,且从FSC/SSC的物理参数图可知,分选前,样本中有不少状态不好的或粘连的细胞,目的细胞亚群P1 门仅占75.8%,但分选后,P1 门比例达到了97.8%;说明该条件下分选得到的细胞状态较好。另外,笔者也测试了KO样本,亦得到了类似结果(数据未展示)。WT 和KO(4 只小鼠)分别分选回收了2 400 万naïve CD4+T细胞,足够下游刺激活化试验用,分选得率高。
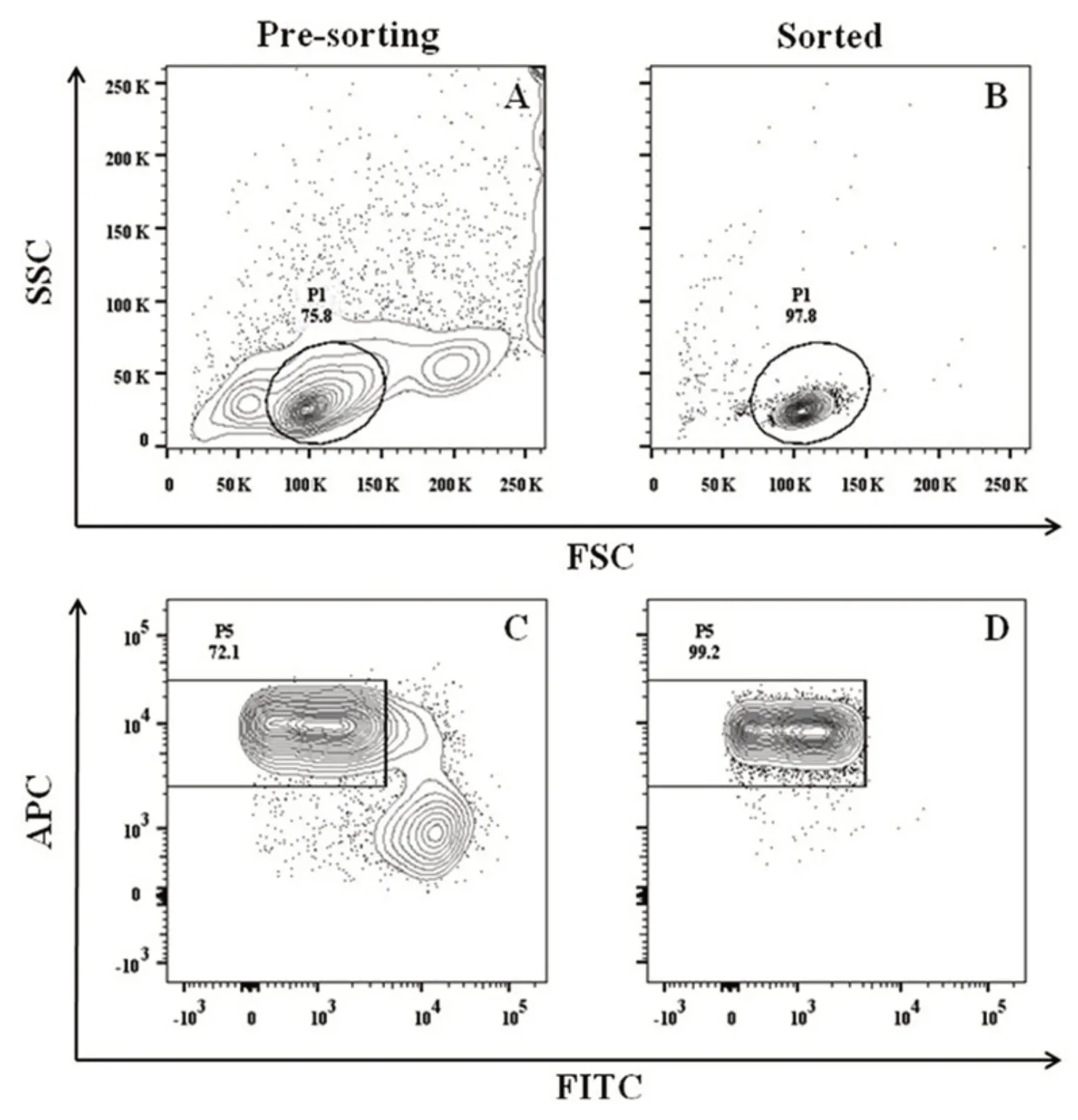
图2 FACS Sorp Aria II检测分选后目的细胞的分选纯度
3 讨 论
利用流式细胞分选仪进行分选试验,其分选纯度和得率往往会受很多因素影响[12],如仪器状态、样品状态、仪器调试情况、上样参数设置等。因此,如何平衡以上因素,高效地完成一个分选试验一直是需要探索的问题。Vorobjev IA等[13]通过优化流式分选仪滤光片配置,高纯度、高得率地分选到了被带绿色荧光蛋白(GFP)表达的寄生虫感染的红细胞,从而用于下游的显微镜及成像流式分析试验。Kabacaoglu G 等[14]通过优化侧向位移分离装置(DLD)以促进细胞的有效分选,从而有利于许多疾病的快速医疗诊断。Higdona LE 等[15]通过优化孔板分选的参数,证明稀有的人淋巴细胞亚群比较适合用70 μm 喷嘴、低速的条件进行单细胞分选。作为公共技术平台的仪器,测试时间紧张,因此,高效分选条件的探索为更主要的亟待解决的问题。
FACS Sorp Aria II流式细胞分选仪可使用4-way purity、purity、yield、single cell、initial 和 fine tube 6 种模式进行分选,single cell模式主要用于单细胞分选,本仪器暂未配置单细胞分选模块,initial 和fine tube 模式主要用于手动液滴延迟的调试。因此,在本仪器实际试验中,purity、yield 和4-way purity 模式应用较多,但每种模式对得率和纯度的影响都不一样。本研究中,yield 模式的分选效率和得率都是最高的,纯度为(97.97±0.39)%,虽显著低于 purity 的(99.30±0.12)%和 4-way purity 的(99.73±0.03)%(表 3),但接近98%的纯度也满足很多下游试验的要求。本研究上样的样品是直径小于10 μm 的微球,分布均一;由此推测,如果分选试验上样的颗粒是直径小于10 μm 的,又能制成很好的单细胞悬液,且分群清楚,那么选用yield模式分选也能得到高纯度的目的颗粒,且能保证高的得率,尤其对于一些珍贵稀有的样本可以尝试此模式分选。但对于直径较大又容易粘连的细胞,yield 模式会注重高得率而导致分选纯度下降,如果下游试验对样本纯度要求高的,那么可能需要考虑选用purity 或4-way purity 模式。当然purity 模式偏重于纯度,含非目标细胞该液滴就不分选;当分选样本比较稀少时,二次分选法(yield+purity)既能保证高得率又能提高分选纯度[16]。
FACS Sorp Aria II 分选仪常用的有 70、85 和 100 μ m 3种喷嘴,喷嘴尺寸越大,对应的鞘液压力越小,对细胞的活性保护更好些,一般待分选细胞直径应小于等于喷嘴孔径的1/4[8];但喷嘴尺寸越大,上样速度越慢,一定量的样本相对分选时间较长,细胞在体外时间越久,活性越差,不利于下游试验。因此,实际试验建议以分选目的颗粒种类来选择合适的喷嘴。另外,笔者研究了不同flow rates 条件下的分选结果,4 种模式分选下的分选纯度均较高,但flow rate 7.0的得率是显著下降的。由此可知,上样的flow rate 越高,分选效率和得率都会下降,尤其是该值超过5.0时得率降低明显(表2)。因此,流式分选上样时flow rate 最好不要超过5.0;另外,适当调整样本浓度,使flow rate 1.0 的进样速度尽量接近该喷嘴的最大进样速度为宜。
本研究以优化后的条件尝试高效分选小鼠naïve CD4+T细胞。由于T细胞直径小于10 μm,每个样本都需要分选上千万目的细胞,不能耗时太长,所以选择了70 μm 喷嘴;样本浓度为 1×107/ml~2×107/ml、flow rate 1.0 时 Thresold rate能达到15 000~22 000 events/s,未超过该喷嘴的最大进样速度(表1);下游试验需要做多组刺激活化试验,对纯度和得率要求都较高,试验样本为原代细胞,有一定粘连和死细胞碎片,因此选用purity模式。试验表明,该分选条件下,可以得到较理想的分选结果。
综上所述,不同的分选速率、分选模式及喷嘴大小对分选结果影响很大,试验者应根据当次试验的样本进行平衡选择。稳定良好的仪器性能是不断重现试验数据结果的基础[17],因此,操作者仪器条件的选择对研究结果有较大影响。本研究探索的分选条件可以帮助试验者快速、准确地设置流式细胞分选仪的参数,从而获得较好的试验结果,对流式分选技术的应用起到一定的参考作用。
利益冲突:作者已申明文章无相关利益冲突。
