果胶季铵盐衍生物的合成、表征及抗菌活性
2021-01-29雷万学
雷万学
河南财政金融学院 化学与环境学院,河南 郑州 450046
果胶(pectin) 是一类易溶于水的酸性天然多糖类的高分子化合物,在高等植物的细胞壁中含量丰富,其主要成分为具有较高聚合度的D-半乳糖醛酸,分子内各单元之间通过α-1,4糖苷键相连,分子中的部分羧基被甲酯化[1]。市场上销售的果胶通常是以农产品废弃物如苹果皮、橘子皮、柚子皮、葵花盘等为原料提取得到,在食品、制药、医疗、生物工程和环境保护等行业中广泛应用,一般用作乳化剂[2]、稳定剂[3]、胶凝剂[4]、增稠剂[5]、解毒剂[6]、药物载体和吸附剂等[7-8]。果胶分子上带有较多的羟基与羧基,有利于进行物化改性及化学修饰,从而改善其理化性质与功能[9-12]。而研究果胶与季铵盐的交联反应,给果胶分子表面固载抗菌基团,有望用于食品包装和医用敷料,为扩大果胶的应用范围开辟新的途径。作者研究了果胶与二甲基十八烷基[3-(三甲氧基硅基)丙基]氯化铵的交联反应,得到果胶季铵盐衍生物(P-OSA),并对其进行了抗菌性能测定。
1 材料与方法
1.1 测试仪器
傅里叶变换红外光谱仪:美国 Nicolet公司;AvanceⅢ400 MHz核磁共振波谱仪:瑞士 Bruker公司;纳米粒度和Zeta电位仪:英国 Malvern仪器有限公司;扫描电子显微镜:美国 FEI公司。
1.2 试剂与材料
二甲基十八烷基[3-(三甲氧基硅基)丙基]氯化铵(OSA):美国AEGIS公司;果胶:自制;卵磷脂、吐温-80等试剂均为分析纯。
1.3 菌种与培养基
抗菌实验中所用的3种菌种均为具有代表性的致病菌:第1种是革兰氏阴性菌的代表,大肠杆菌Escherichiacoli(8099);第2种是革兰氏阳性菌的代表,金黄色葡萄球菌Staphylococcusaureus(ATCC6538);第3种为真菌的代表,白色念珠菌Candidaalbicans(ATCC10231)。沙堡氏液体培养基、营养肉汤培养基、沙堡氏琼脂培养基、伊红美蓝琼脂培养基、营养琼脂培养基均为青岛海博生物技术有限公司生产。
1.4 果胶季铵盐衍生物的制备
1.4.1 果胶的制备
称取500 g去蒂的新鲜柑橘皮,水洗晾干,压榨出橘油。将固体用95%乙醇浸没1 h,过滤,压榨滤饼。如此反复3次,滤液合并后用于提取色素及回收乙醇,橘渣用水漂洗3次后压榨脱醇。称取200 g脱醇后的橘渣,加1.8 L水,用盐酸调pH值为1.8,水浴加热至95 ℃水解1 h,压滤,滤渣用热水洗涤2次。滤液浓缩后快速冷却,用等体积的乙醇沉淀,压滤,滤饼用乙醇充分洗涤3次后,80 ℃真空干燥,粉碎,过100目筛,得到类白色果胶粉[13]。
1.4.2 果胶季铵盐衍生物的制备
称量2.00 g自制的果胶粉6份,分别用质量分数为5%、10%、15%、20%、25%、30%OSA的乙醇水溶液在室温浸没8 h,过滤,80 ℃真空干燥,置于索氏萃取器中用乙醇于80 ℃萃取24 h,以除去未反应的OSA(或以其他分子间的作用力吸附在果胶上的OSA),干燥,粉碎,过100目筛,得到果胶季铵盐衍生物(P-OSA)。用微量凯氏定氮仪测定P-OSA的含氮量,计算固载率Y。
式中:N表示P-OSA中氮的质量分数;451.18为OSA的分子量;14.01为氮的原子量。
OSA与果胶反应制备果胶季铵盐衍生物的化学反应分为两步,其化学反应方程式分别见图1和图2。
图1为OSA与果胶反应制备果胶季铵盐衍生物的化学反应的第1步。OSA在常温(或加热)条件下与水发生水解反应,OSA分子中的3个硅甲氧基水解形成相应的硅羟基,主要产物为二甲基十八烷基[3-(三羟基硅基)丙基]氯化铵,副产物为甲醇。

图1 OSA的水解反应Fig.1 Hydrolysis reaction of OSA
图2为OSA与果胶反应制备果胶季铵盐衍生物的化学反应的第2步。在加热的条件下,二甲基十八烷基[3-(三羟基硅基)丙基]氯化铵分子中的硅羟基与果胶分子中的碳羟基发生分子间的缩水反应,生成果胶季铵盐衍生物。

图2 水解后的OSA与果胶的反应Fig.2 Reaction between hydrolyzed OSA and pectin
1.5 测试和表征
采用FTIR 红外光谱仪、AvanceⅢ400 MHz核磁共振波谱仪和 Zeta电位分析仪分别对产物进行红外、1H NMR和Zeta电位测试。并采用扫描电子显微镜观察产物的形貌结构。
1.6 抗菌实验
在3个250 mL 无菌锥形瓶中分别加入0.5 g 所制备的P-OSA(Y=15.64%)及90 mL无菌水,再各加入10 mL浓度为108cfu·mL-1的菌悬液,置入20 ℃恒温水浴振荡器中,控制转速200 r/min,时间分别为5、15、30 min时,在相应的锥形瓶中分别加入中和剂,再继续振荡作用10 min,分别将作用后的菌悬液各取0.5 mL,用10倍的梯度进行稀释后,进行活菌计数实验,培养温度为37 ℃,培养时间为48 h,计算原菌液的含菌数与实验样品溶液的存活菌数以及杀菌率[14]。
2 结果与讨论
2.1 果胶和P-OSA红外光谱分析
在常温下,果胶和P-OSA的红外光谱如图3所示。
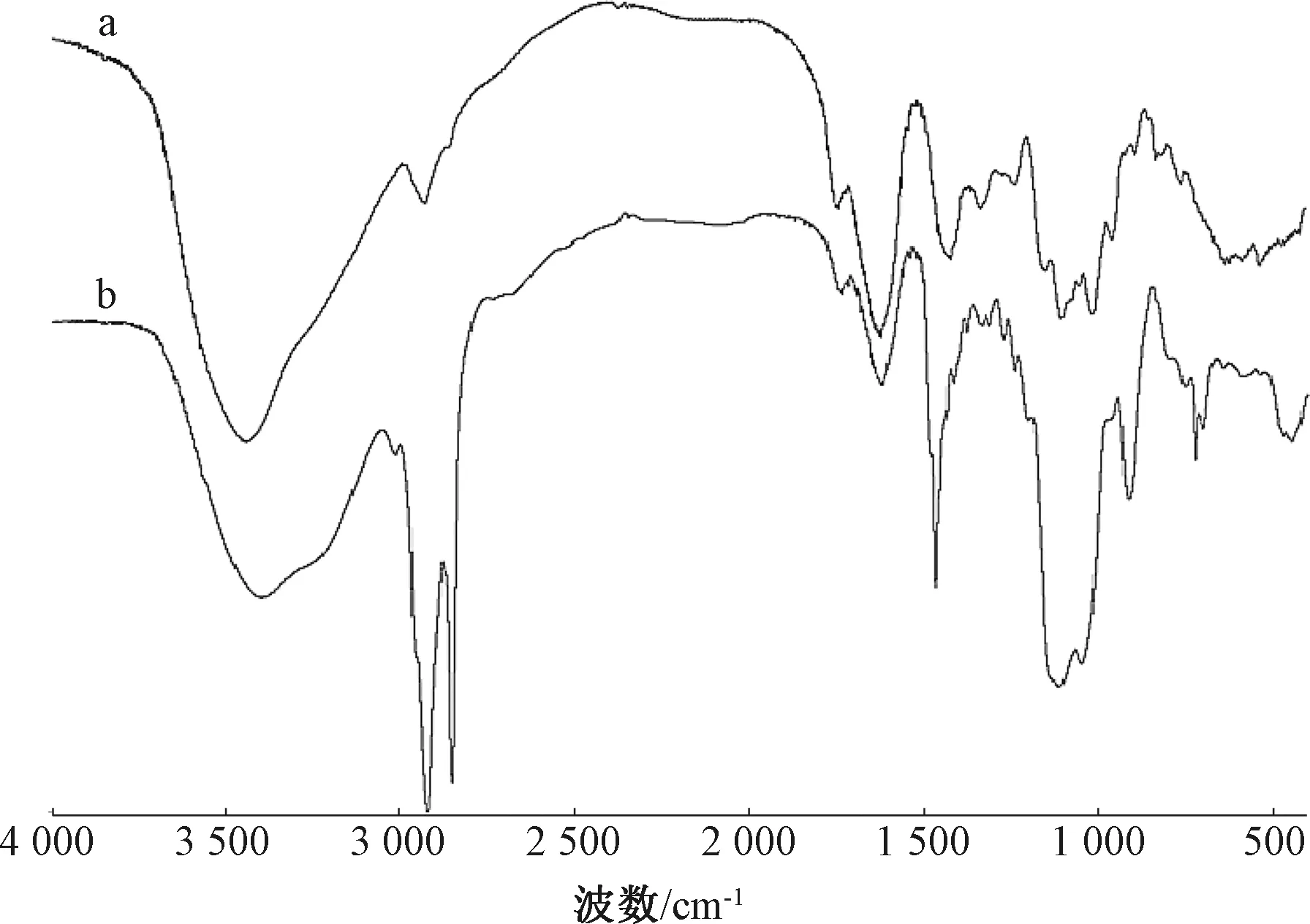
图3 果胶(a)和P-OSA(b)的红外谱图Fig.3 FTIR spectra of pectin(a) and P-OSA(b)

2.2 果胶、OSA和P-OSA的1H NMR分析
果胶、OSA和P-OSA的1H NMR如图4所示。

图4 OSA(a)、果胶(b)和P-OSA(c)的1H NMRFig.4 1H NMR spectra of OSA(a), pectin(b) and P-OSA(c)
由图4可知,在P-OSA的波谱中,除了出现果胶上的质子共振峰外,还出现了OSA侧链上的质子共振峰,在δ0.88~0.91处出现了甲基(N+—C1~C17—CH3)的质子共振峰,在δ1.29~1.39处出现了亚甲基[N+—C—C—(CH2)15—C]的质子共振峰,在δ1.80~1.90处出现了亚甲基(N+—C—CH2—C—)的质子共振峰,在δ3.11处出现了与氮相连接的甲基(N+—CH3)的质子共振峰等,而且,在P-OSA波谱中OSA分子中的硅甲氧基的质子共振峰(δ2.87,Si—O—CH3)已经消失,这表明OSA已经固载到果胶上,得到了目标产物P-OSA。
2.3 Zeta电位分析
溶液pH值对果胶和P-OSA的Zeta电位的影响见图5。从图5可以看出,果胶的零电位pH值较低,pH≈3.4,当溶液的pH <3.4 时,果胶的表面带正电荷;当溶液的pH >3.4时,果胶的表面带负电荷,而且,随着溶液pH值的增加,果胶Zeta电位的绝对值也相应增大。从图5同样可以发现,果胶季铵盐衍生物P-OSA的零电位pH值较高,pH≈8.2,而且其表面所带电荷随溶液pH值的改变而变化的规律与果胶的情况类似。
由图5可以看出,由于果胶的零电位在pH 3.4附近,在水溶液中带负电荷,而且随pH值的增大其负电荷增加。而P-OSA的零电位在pH 8.2附近,在水溶液中带正电荷,这是由于P-OSA的表面固载了季铵盐阳离子。

图5 果胶和P-OSA的Zeta电位Fig.5 Zeta potential of pectin and P-OSA
2.4 SEM结果与分析
果胶与P-OSA的SEM照片如图6所示。

图6 果胶和P-OSA的SEM照片Fig.6 SEM characterization of pectin and P-OSA
从图6可以看出,果胶与P-OSA两个样品中都存在较多的微孔,P-OSA的微孔大小及分布与果胶的相比没有显著差别,这说明在季铵盐和果胶进行化学反应形成果胶季铵盐衍生物P-OSA的反应过程中,没有对果胶的外观、形貌等方面产生显著影响。
2.5 抗菌效果
通过悬菌定量实验可以发现,果胶季铵盐衍生物P-OSA分别和白色念珠菌、金黄色葡萄球菌以及大肠杆菌接触不同的时间,其杀菌效果亦不相同,具体情况见表1。
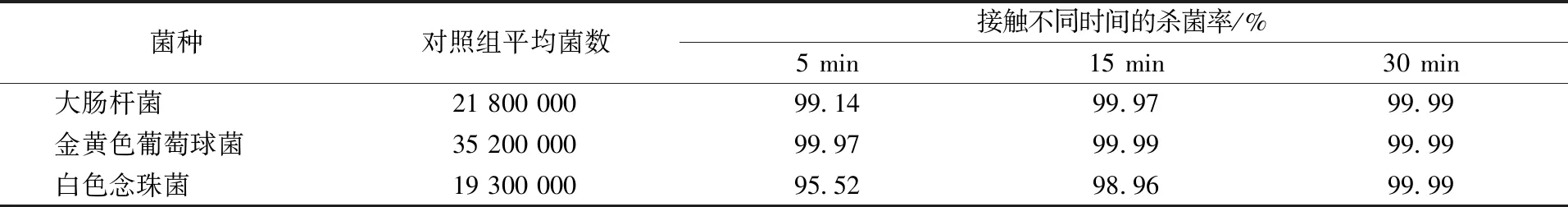
表1 P-OSA与实验菌接触不同时间的杀菌率Table 1 Bactericidal rate of P-OSA in contact with experimental microorganisms at different time
通过表1可以发现:所制备的样品P-OSA的抗菌效果与作用时间呈正相关。随着P-OSA分别与3种实验微生物作用时间的延长,其杀菌率也随之相应提高,当作用时间为30 min时,P-OSA对3种实验微生物的杀菌率均达到了99.99%。其中,当接触时间≤15 min时,P-OSA对金黄色葡萄球菌和大肠杆菌的抗菌效果较好,而对白色念珠菌的抗菌效果稍差。这是由于P-OSA中带正电荷的季铵基团容易与带负电荷的细菌细胞膜结合,并对其进行干扰破坏,使胞内物质泄漏导致菌体死亡[15]。
3 结论
二甲基十八烷基[3-(三甲氧基硅基)丙基]氯化铵通过化学键可以固载到果胶表面,制备果胶季铵盐衍生物;果胶的零电位pH≈3.4,所制备的果胶季铵盐衍生物的零电位pH≈8.2,季铵基团的引入导致其零电位显著提高;抗菌实验结果表明,所制备的果胶季铵盐衍生物对大肠杆菌、金黄色葡萄球菌以及白色念珠菌均有良好的杀菌作用,接触15 min的杀菌率分别为99.97%、99.99%和98.96%,接触30 min的杀菌率均为99.99%。
