Lactobacillus plantarum M616生长及代谢特性研究
2021-01-29王金水
程 强,陈 迪,王金水
河南工业大学 生物工程学院,河南 郑州 450001
传统酸面团在我国有悠久历史,又称酵子、面肥、酵头等,其体系复杂,包含乳酸菌、醋酸菌、酵母菌等多种微生物[1]。在酸面团发酵过程中,多菌种相互作用,协同发酵,产生丰富的营养及风味物质[2]。相对于单一的酵母发酵,酸面团具有以下优势:酸面团在发酵过程中乳酸菌会产生乳酸、甲酸、乙酸等有机酸,能有效降低酸面团体系的pH值,同时,低pH值环境能激活面团内源蛋白酶,促进面团面筋蛋白的降解,提高面团延展性[3];乳酸菌在发酵过程中利用酸面团中的麦芽糖产生胞外多糖,提高面团的营养价值,并改善面团结构[4];在酸面团体系中,乳酸菌与酵母菌相互作用,发酵产生酸类、醇类、醛类、芳香族化合物等风味物质,形成了面团体系的风味丰富性[5];在酸面团发酵过程中,乳酸菌会产生细菌素、乙醇、过氧化氢等抑菌物质,对大肠杆菌、金黄色葡萄球菌等致病菌具有一定的抑制作用,有利于延长酸面团产品的保质期[6]。
在酸面团体系众多的微生物中,植物乳杆菌作为体系中的优势种群之一,对酸面团的品质有着重要贡献[7]。植物乳杆菌M616为作者所在实验室保藏的菌株,作者对其生长及代谢特性展开分析,主要研究了植物乳杆菌M616的生长特性、产酸能力,耐酸、耐盐、耐胆盐的能力,以及对大肠杆菌、金黄色葡萄球菌、单增李斯特菌等致病菌的抑制能力,为其在酸面团中的应用提供理论依据。
1 材料与方法
1.1 试验材料
菌种:植物乳杆菌M616、金黄色葡萄球菌、大肠杆菌、单增李斯特菌,均为河南工业大学生物工程实验室保藏菌种。
MRS液体培养基:蛋白胨10.0 g,牛肉膏5.0 g,酵母粉4.0 g,葡萄糖20.0 g,磷酸氢二钾2.0 g,乙酸钠5.0 g,柠檬酸二铵2.0 g,硫酸镁0.2 g,硫酸锰0.005 g,用蒸馏水定容至1 000 mL,煮沸,调节pH 6.2~6.7,将培养基分装入锥形瓶内115 ℃灭菌后,冷却备用[8]。
MRS固体培养基:在MRS液体培养基的基础上加入营养琼脂15 g/L,调节pH 6.2~6.7,将培养基分装灭菌。
LB培养基:胰蛋白胨10.0 g, 酵母提取物5.0 g,氯化钠10.0 g, 用蒸馏水定容至1 000 mL,煮沸,调节pH 7.2~7.6,将培养基分装入锥形瓶内115 ℃灭菌后,冷却备用, 固体培养基另补加琼脂粉15.0 g。
营养琼脂培养基:蛋白胨10.0 g,氯化钠 5.0 g,牛肉膏粉 3.0 g,琼脂 15.0 g,用蒸馏水定容至1 000 mL,煮沸,调节pH 7.2~7.3,将培养基分装入锥形瓶内115 ℃灭菌后,冷却备用。
1.2 仪器设备
恒温培养箱:上海精宏实验设备有限公司;超净工作台:苏州开泰实验技术有限公司;Forma 88000 超低温冰箱:美国Thermo 公司;恒温培养摇床:上海一恒科学仪器有限公司;电子分析天平、实验室pH计:梅特勒-托利多仪器有限公司;真空冷冻干燥机:美国Pekin Elme公司;紫外-可见光分光光度计:广州步步宏科学仪器设备有限公司;高速冷冻离心机:郑州金友宁有限公司;QUANTA FEG 250 扫描电镜:美国FEI公司。
1.3 试验方法
1.3.1 菌种活化
在超净工作台上无菌操作。将植物乳杆菌M616菌种接种至灭菌后的100 mL MRS液体培养基中,放置摇床中37 ℃恒温培养16 h,活化。取1 mL活化好的菌液到已灭过菌的100 mL MRS液体培养基中,再次放于摇床中37 ℃下培养8 h,使菌株OD600 nm值达到0.5左右,菌液备用。
1.3.2 菌种形态观察
取已经活化好的菌液用无菌水依次稀释10-1~10-5,然后取1 mL接种至装有MRS固体培养基的平板中,用玻璃涂布棒轻轻涂抹均匀。将平板倒置,放入培养箱中37 ℃培养48 h。培养结束后,用接种环刮取少量菌,进行革兰氏染色,在光学显微镜下进行细胞形态观察。
2.5%戊二醛配制:将0.2 mol/L磷酸缓冲液(pH 7.4)50 mL与25%戊二醛水溶液10 mL混合,用蒸馏水定容至1 000 mL。固定:挑取固体培养基表面菌体少许,加入到含有2.5%戊二醛固定液的离心管中,振荡至分散均匀,固定2~4 h,然后3 000 r/min离心15 min,去除上清液。漂洗:在离心管中加入PBS缓冲液清洗3次,再用超纯水清洗2次,每步均在3 000 r/min下离心15 min,去除上清液。脱水:在离心管中依次加入30%、50%、70%、90%乙醇脱水15 min,离心后用乙醇、叔丁醇各自置换10 min,每一步骤后均需离心弃去上清液,最后制成叔丁醇菌悬液。取叔丁醇菌悬液1 mL滴加在锡箔纸上,-20 ℃预冻后放入冷冻干燥机进行冷冻干燥。干燥完成后喷金并进行扫描电镜观察。
1.3.3 生长曲线的测定
在超净工作台上,取活化后的菌悬液1 mL至灭过菌的100 mL MRS液体培养基中,放至37 ℃摇床中180 r/min振荡培养。每隔3 h取样,以没有加入活化菌株的液体培养基作为对照,在600 nm处测定其光密度OD600 nm。以培养时间为横坐标,对应的光密度为纵坐标绘制菌株的生长曲线。
1.3.4 产酸性能测定
在超净工作台上,取活化后的菌液2 mL至100 mL MRS液体培养基中,放至37 ℃摇床中振荡培养,每隔3 h取出菌液,用pH计测量菌液的pH值。以培养时间为横坐标,对应的pH值为纵坐标,绘制菌株的产酸特性曲线。
1.3.5 耐酸性能测定
在超净工作台上,分别取活化过的菌液1 mL至用盐酸分别调至pH值为2.0、3.0、4.0 的100 mL MRS培养基中。37 ℃恒温振荡培养,每隔1 h取出菌液,取至第6小时。以未添加盐酸的菌悬液培养基为对照,在600 nm处测定菌液的光密度。
1.3.6 耐盐性能测定
在超净工作台上,分别取活化后的菌液1 mL至NaCl的质量分数分别为2%、4%、6%、8%、10%、12%、14%的100 mL MRS液体培养基中,放置于摇床中37 ℃恒温振荡培养,以没有加入NaCl的液体培养基作为对照,24 h后测定600 nm下的发酵液光密度。
1.3.7 耐胆盐性能测定
在超净工作台上,分别取活化后的菌液1 mL至分别加有0.03、0.1、0.2、0.3 g牛胆盐灭过菌的100 mL MRS培养基中,放置在摇床中37 ℃恒温振荡培养。每隔1 h取出菌液,取至第4小时,在600 nm处测定菌液的光密度。
1.3.8 抑菌性测定
1.3.8.1 指示菌的活化
在超净工作台内,将大肠杆菌、金黄色葡萄球菌、单增李斯特菌3种致病菌分别接种至灭过菌的100 mL LB培养基中,在37 ℃、200 r/min摇床中培养16~20 h。
1.3.8.2 双层平皿的制备
取灭菌过的培养皿,分别对平皿倾注固体LB培养基20 mL,在平皿内均匀摊铺,水平放置使冷却凝固作为底层备用。然后另取灭过菌的营养琼脂培养基冷却至48~50 ℃,每100 mL加入40 μL活化好的致病菌菌悬液,混匀后取5 mL倒入凝固的底层培养基上,并使其均匀分开,作为培养基的第2层。最后,取灭过菌的牛津杯4个,保持间隔距离相同,放置平板中,使其自然沉降,待第2层凝固,备用。
1.3.8.3 植物乳杆菌M616抑菌实验
取活化好的乳酸菌发酵液,6 000 r/min离心15 min,把上清液梯度稀释,分别为1×稀释、5×稀释、10×稀释,在每个双层平皿中的牛津杯中分别用移液枪滴装200 μL稀释液,封口,放入冰箱4 ℃静置3 min,取出放入生化培养箱37 ℃培养16~20 h,测量各个抑菌圈直径。牛津杯外径为8 mm,抑菌圈C=8 mm为无抑菌活性,8 mm
2 结果与分析
2.1 植物乳杆菌M616形态观察
植物乳杆菌M616的形态观察结果如图1所示。从图1a可以看出,乳酸菌在培养箱中恒温培养48 h后,MRS固体平板上长出许多乳白色光滑的菌落,呈圆形,表面凸起,湿润易挑起。从图1b可以看出,经过革兰氏染色后,在光学显微镜下可观察到植物乳杆M616呈紫色,由此可判断植物乳杆菌M616是革兰氏阳性菌。用扫描电镜观察植物乳杆菌M616的形态如图1c所示,该菌呈直或弯的短杆状,菌体大小约为2.0 μm×0.4 μm,无芽孢,无鞭毛,单个或成对、成链状排列。

图1 植物乳杆菌M616的形态观察结果Fig.1 Morphology of Lactobacillus plantarum M616
2.2 植物乳杆菌M616的生长曲线和产酸曲线
植物乳杆菌M616生长曲线如图2所示,在0~3 h内菌体增长缓慢,处于生长延迟期;4 h后,菌株快速增殖,进入对数生长期;在20 h后曲线趋于平缓,此阶段活菌数变化不大,生长与死亡菌体数量达到平衡。

图2 植物乳杆菌M616的生长曲线Fig.2 Growth curve of Lactobacillus plantarum M616
产酸曲线如图3所示,植物乳杆菌M616可在较短时间内大量产酸,使菌液pH值迅速下降。在前15 h,pH值由初始6.07下降至4.48,经过30 h后下降到了3.89,显示了菌株良好的产酸能力。pH值判断法是评价乳酸杆菌的产酸性能方法之一[9]。张艳萍等[10]在筛选乳酸菌抑菌作用的研究中,从88株乳酸菌中筛选出29株产酸能力较好的菌株,其pH值在4.50~4.65之间。
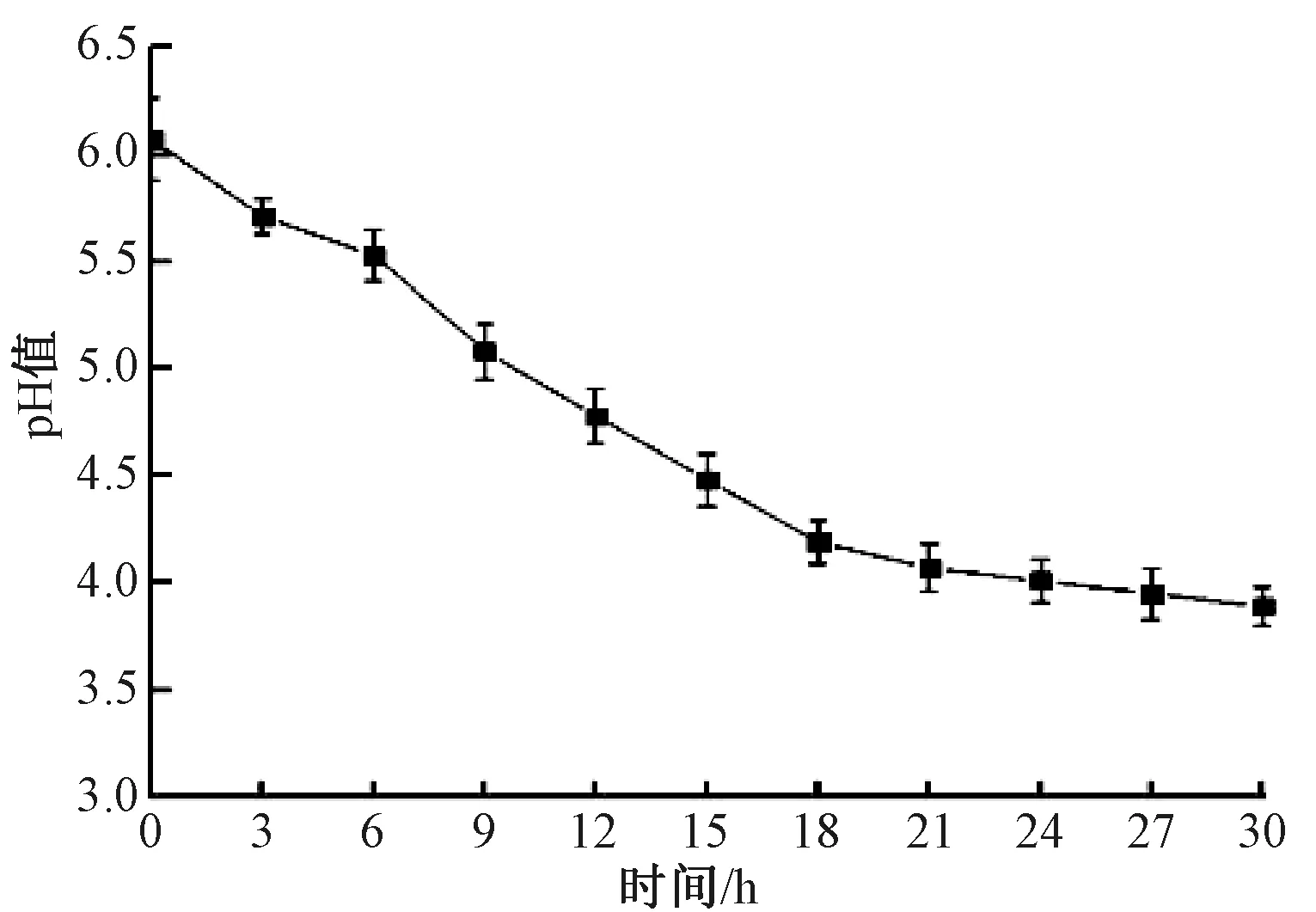
图3 植物乳杆菌M616的产酸能力Fig.3 Acid production ability of Lactobacillus plantarum M616
与之相比,植物乳杆菌M616生长迅速,培养4 h即可进入快速生长期,同时菌株还具有较强的产酸能力,在进入稳定期后,产酸仍在继续。由此可见,植物乳杆菌M616具有良好的生长活性,可初步判断该菌株具有潜在的发酵性能。
2.3 植物乳杆菌M616耐酸性能
植物乳杆菌M616在pH值为2.0、3.0、4.0时的生长情况如图4所示。

图4 不同pH值对植物乳杆菌M616生长的影响Fig.4 Effects of different pH values on the growth of Lactobacillus plantarum M616
图4表明,不同的pH值对菌体生长影响不同,植物乳杆菌M616在接种初期的6 h内,随着pH值升高,生长速率呈现出明显的上升趋势,pH 4.0时菌株生长最快。在pH 2.0和pH 3.0的液体培养基中,菌株生长缓慢。在3 h后植物乳杆菌在pH 3.0的环境下较pH 2.0生长速率快,表明低pH值对菌株生长有抑制作用。在pH 4.0条件下,菌株在2 h之后逐渐适应了酸性环境,生长速率快速增长,OD600 nm由2 h的0.05快速增长至6 h的0.25,而在pH 2.0、3.0条件下,变化不明显。
2.4 植物乳杆菌M616耐盐性能
植物乳杆菌M616在NaCl不同质量分数下的生长情况如图5所示。

图5 不同质量分数的NaCl对植物乳杆菌M616生长的影响Fig.5 Effects of different mass fractions of NaCl on the growth of Lactobacillus plantarum M616
由图5可知,随着NaCl质量分数的增大,菌体的生长速率持续降低。在NaCl质量分数小于4%时其生长速率下降缓慢,抑制作用较弱;NaCl质量分数为4%~8%时生长速率快速下降,在NaCl质量分数大于8%时菌株生长缓慢,随着NaCl质量分数升高,菌体生长抑制效应愈明显,当NaCl质量分数达到8%以上时菌株几乎不能生长。由此可见,菌株生长速率和NaCl质量分数呈负相关,环境中NaCl质量分数越高,菌体生长越受抑制。对比汤伟等[11]分离的消化乳杆菌W639 菌株的耐盐试验,其实验结果显示在NaCl质量分数为10%条件下仍然可以生长,可判断出M616的耐盐性能一般。植物乳杆菌在泡菜以及肉制品中发酵的条件是在不低于5%的盐水条件下仍然可以正常存活。由此可见,植物乳杆菌M616具有一定的耐盐性,可适用于食品发酵和工业生产。
2.5 植物乳杆菌M616耐胆盐性能
研究了植物乳杆菌M616在4种不同胆盐质量浓度的培养基中培养4 h后,其生长的变化情况如图6所示。
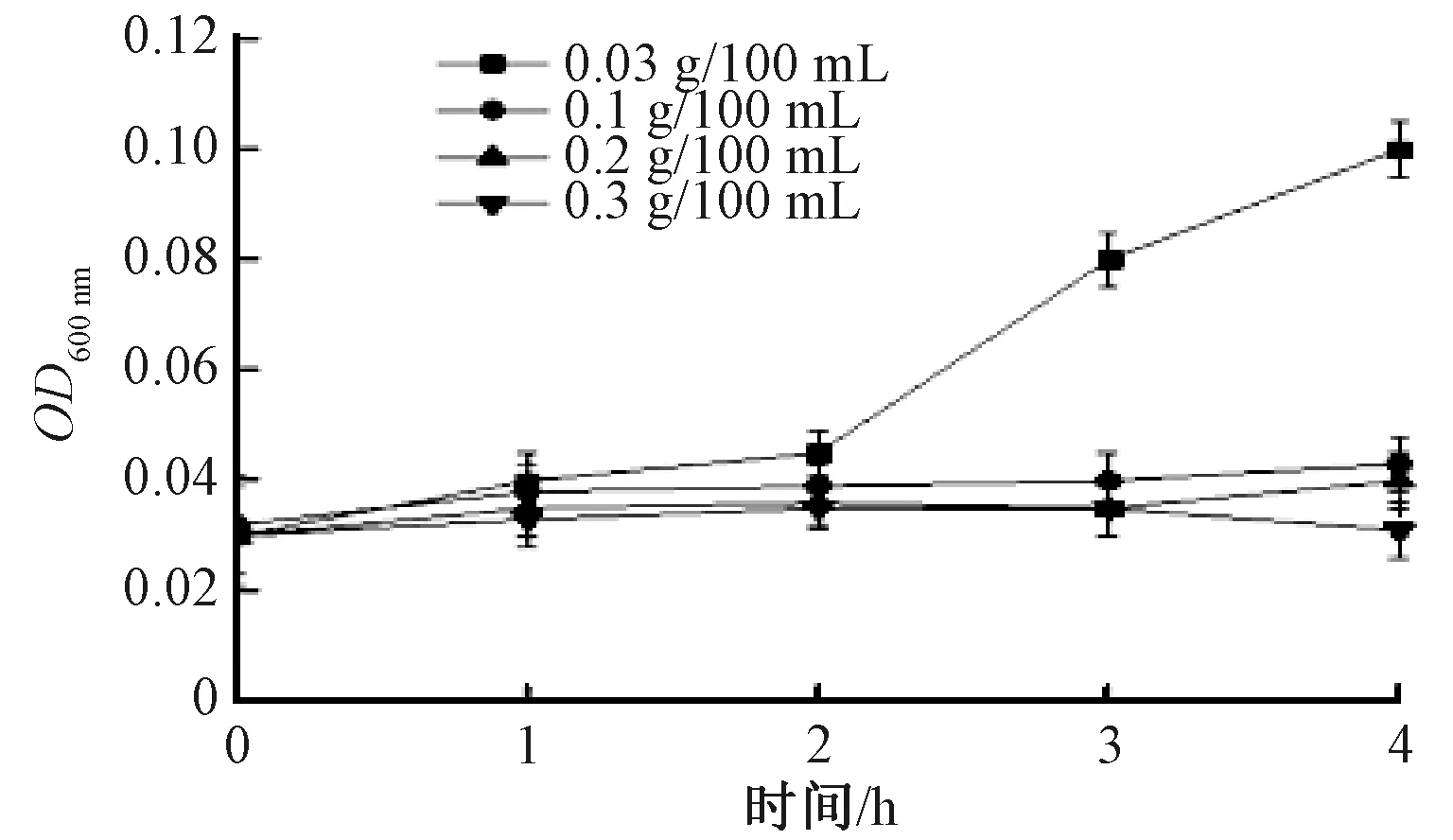
图6 不同质量浓度的牛胆盐对植物乳杆菌M616生长的影响Fig.6 Effects of different mass concentrations of bile salt on the growth of Lactobacillus plantarum M616
图6显示,在胆盐质量浓度为0.03 g/100 mL的条件下,植物乳杆菌M616的生长受抑制较小,随培养时间延长,其光密度呈快速增长趋势,说明在0.03 g/100 mL的低胆盐质量浓度环境中菌株的生长几乎不受影响。菌株在胆盐质量浓度分别为0.1、0.2、0.3 g/100 mL条件下,其生长速率均缓慢地上升,其中在0.3 g/100 mL的条件下生长最慢。4 h时,菌株在0.3 g/100 mL条件下的生长速率略微降低。对比蒙月月等[12]的植物乳杆菌KLDS1.0318的耐胆盐试验结果,植物乳杆菌M616在胆盐质量浓度分别为0.03、0.1、0.2 g/100 mL时的生长速率均超过KLDS1.0318,表明植物乳杆菌M616具有良好的耐胆盐能力。
2.6 植物乳杆菌M616的抑菌性
对植物乳酸杆菌M616发酵产物进行抑菌性测试,选用大肠杆菌、金黄色葡萄球菌、单增李斯特菌作为测试菌,结果如图7、图8 所示。

图8 植物乳杆菌M616的抑菌圈直径Fig.8 Diameter of inhibition zone of Lactobacillus plantarum M616
图7显示,植物乳杆菌M616发酵液对大肠杆菌、金黄色葡萄球菌及单增李斯特菌均有一定的抑制作用。发酵液10倍稀释,仍对3种测试菌表现出抑菌效果,随着发酵液稀释倍数的降低,抑菌圈直径逐渐变大。从图8可看出,对大肠杆菌的抑菌直径由10倍稀释的10 mm增加到14 mm,对金黄色葡萄球菌的抑菌直径由10倍稀释的11 mm增加到15 mm,其中对单增李斯特菌的抑菌效果最为明显,由最小的11 mm增加到最大的17 mm,增加了54.5%。陆春波等[13]通过对植物乳杆菌DY6发酵液中的抑菌物质做初步分离研究,发现主要抑菌物质为小分子有机酸和脂肪酸。乳酸菌在发酵过程中产生多种抑菌成分,如有机酸(乳酸、甲酸、乙酸等)、乙醇、细菌素等[14]。有机酸对有害菌的抑制机制最常见有两种:一是有机酸通过与细菌细胞膜上脂多糖等成分结合,破坏了细胞膜的稳定性,降低了细胞的活性,从而达到抑菌效果;二是乳酸菌发酵产生的有机酸降低了细菌胞内的pH值,影响了细菌的代谢活动,从而达到抑制作用[15]。
3 结论
以植物乳杆菌M616作为研究对象,对其基本形态、生长曲线、产酸能力、耐酸、耐盐、耐胆盐及抑菌能力进行了研究。结果显示:植物乳杆菌M616为革兰氏阳性菌,菌株呈直或弯曲的杆状,无芽孢;植物乳杆菌M616生长较快,培养4 h后,开始进入了对数生长期;植物乳杆菌M616在37 ℃ MRS摇瓶中发酵30 h,pH值达3.89;该菌株能耐受pH 3.0的酸度和8%的NaCl及0.2%的牛胆盐;植物乳杆菌M616的发酵产物对大肠杆菌、金黄色葡萄球菌以及单增李斯特菌具有抑制作用,其中对单增李斯特菌的抑制效果最好。本实验的结果可为此菌株在酸面团发酵中的应用奠定一定的生物学基础。
