韩氏溶出-改善利托那韦片的流体力学和溶出行为
2021-01-29李素叶王正平吴恒乾
李素叶,王正平,吴恒乾,韩 军,,
(1.山东师范大学 化学化工与材料科学学院,山东济南 250014;2.聊城高新生物技术有限公司,山东聊城 252059;3.聊城大学 生物制药研究院,山东聊城 252059; 4.济南大学 化学化工学院,山东济南250022)
0 引言
药物溶出试验是药物开发和生产的重要组成部分,是制药行业在研发过程中验证药物释放过程和工艺配方选择的一种评价工具。另外,溶出试验也用来衡量生产过程中不同批次间的一致性。因此溶出试验具有很好的重现性和准确性,并对其可变性来源的识别变得十分重要。大多数固体口服剂型都需要进行溶出度测试,而因溶出试验失败(不一致的测量结果)而召回药品的情况并不少见,但是有些溶出度测试失败原因并不在于测试所要评估的产品质量,而是测试本身的性质。由于系统的复杂流体动力学特性,系统的再现性和准确性受到很大的影响,并且导致分析人员在系统的研究、校正和重新验证上浪费了大量的时间。所以为了避免出现这样的失败,可以通过减小溶出装置的物理参数对溶出试验变异性的影响,特别是因溶出装置的缺陷,而与产品的实际性能无关而造成的失败[1-4]。
溶出试验装置是模拟人体消化道器官,转篮和桨板以及转速是模拟胃部和小肠的蠕动。目前溶出仪有篮法、桨法、小杯法、桨碟法、转筒法、往复筒法、流池法等[5]。最常用的溶出试验设备是桨法和篮法,这两种设备涵盖了制药工业的大部分溶出测试。USP <711>部分对桨法和篮法进行了详细描述,包括仪器设备、溶出程序和产品规格等[6]。篮法和桨法适用于普通制剂、缓释制剂和控释制剂,具有装置简单、耐用及标准化的特点。特别是桨法是制药行业中常用的溶出测试设备,尽管其被广泛使用,溶出测试仍然容易出现重大错误和测试失败。一些研究者已经指出,溶出杯中的流体动力学可能是溶出测试结果不一致的原因[7]。标准USP方法除了溶出测试中的介质与产品最终暴露的环境(胃肠道环境)有很大的不同外,在溶出杯中流体力学也存在很大的差异[8]。而多篇文献已经研究证明了流体动力学影响溶出试验的性能, Morihara 等人通过篮法,桨法,流通池法等对溶出仪校准标准片水杨酸片(非崩解型)溶出试验,研究了片剂周围的流体动力学情况,表明以研究体外/体内关系和质量控制为目的而选择溶出试验时,应考虑体外试验之间流体力学流动的差异[9];Tahseen Mirza等人对不同溶出杯内流体动力学评估研究,有传统溶出杯,尖峰溶出杯及平底溶出杯,结果表明难溶性药物受不均一流场影响更大,由于这种流场的不均匀性,在溶解等质变过程中作为关键变量的应变率也在容器底部不均匀分布,反过来会对测试结果产生巨大的影响,进而影响了测试结果的重现性[10];Bai等人通过计算模型及实验研究,定量和详细地研究了片剂的位置对溶出速率和整体溶出过程的影响[11,12]。以上研究提示,影响流体动力学的三个主要因素是容器形状、操作特性和药物在溶出杯中的分散模式和沉降位置。
随着对溶出杯中流体动力学的深入研究,溶出设备的设计和操作可以而且应该受到挑战。为提高溶出试验的重现性,对桨法设备提出了一些改进建议并进行了研究,如倾斜的溶出杯,锥形的尖峰溶出杯(Peak vessel)[13]。这些改进,本质上,是通过改变流体动力学,占据因未被搅动的崩解颗粒在溶出杯底部形成的“死区”位置[10,14,15]。由于这些变化,溶出速率增大,测试结果变化幅度减小。在此基础上,本文提出了对溶出设备新的改进方式,并命名为韩氏溶出法。利用新改进的溶出杯开展实例的研究,减少了传统溶出杯装置的可变性。因流体动力学与药物在溶出杯中的分散模式和沉降位置有莫大的联系,且难溶性药物受此影响更大,重现性结果较差,故本文选择难溶性药物利托那韦片剂为典型模型开展试验[16]。另外,由雅培公司开发的利托那韦片(Norvir,100 mg)是采用热熔挤出工艺制备的片剂,利托那韦原料药以无定形状态分散于固体分散剂中,利托那韦片在与水介质接触时形成了纳米/微米级粒径的分散体,形成一种相对稳定的过饱和溶液。但是雅培公司在利托那韦片(Norvir,100 mg)上市两年后发现在制剂过程中利托那韦沉淀形成了一种热力学上更稳定新晶型,溶解性比晶型Ⅰ更差,从而影响了制剂的溶出速率和生物利用度,造成了较大的安全风险和损失。故在利托那韦片产品开发过程中,指导利托那韦仿制药开发时采用更具有区分力的溶出试验尤为重要。
1 实验部分
1.1 仪器与试剂
仪器:智能溶出仪(Distek 7100,兴和仪器有限公司);自动取样器(Distek 4300,兴和仪器有限公司);高效液相色谱仪(Vanquish,Thermo)
试剂:利托那韦原研片(批号:1078316,雅培制药);磷酸二氢钾(分析纯,天津市致远化学试剂有限公司);磷酸(色谱纯,Thremo Fisher);甲醇(色谱纯,Adamas);乙腈(色谱纯,Adamas);试剂用水均为超纯水(18.2 MΩ·cm)
1.2 改进的溶出设备
与现有传统溶出杯及尖峰溶出杯类似,均包括溶出杯、溶出杯内的搅拌桨。不同之处在于,所述溶出杯的弧形底部还设置有表面圆滑的辅助搅拌珠[17]。对辅助搅拌珠的材质要求:表面无划痕、裂缝、凹坑、污染和残留等问题,且不易漂浮于溶剂上,所述辅助搅拌珠的直径 < 25 mm,根据《药物溶出度仪机械验证指导原则》要求,搅拌桨和溶出杯底部距离25 ± 2 mm,辅助珠大于25 mm会对装置造成损坏,本文开展实验所使用的辅助搅拌珠的直径约为15 mm。装置如图1所示。

图1 不同溶出设备图
1.3 溶出方法开发
利托那韦片在USP41药典采用溶出装置第二法桨法,以0.06 M 聚氧乙烯月桂醇醚与900 mL水混合为溶出介质,由于利托那韦片处方中本身含有聚合物和表面活性剂,片剂在接触水介质时分散成纳米/微米级粒径的分散体,形成一种相对稳定的过饱和溶液。为开发具有区分力的溶出方法,以水为溶出介质(预先脱气处理),转速75 rmp,温度37 ℃,溶出取样时间点为5、10、15、20、30、45、60、90、120、150、180 min。在每个取样时间点,仪器自动取样3 mL,其中溶出试管中预先加入1 mL甲醇,使样品稳定防止样品析出。取出样品用斡旋振荡器混合均匀,立即用0.45 μm滤膜(聚四氟乙烯)过滤至流动相小瓶,进液相测试其累积溶出度。难溶性药物利托那韦片剂在传统溶出杯、尖峰溶出杯、改进的溶出杯中的溶出对比考察。
1.4 对照品溶液制备
取利托那韦原料药11 mg,精密称定,置10 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,对照品储备液,浓度为1.1 mg/mL。准确量取2 mL对照品储备液,用溶出介质稀释定容至20 mL,其中稀释时多加入2 mL甲醇,防止样品析出,摇匀,作为对照品溶液,浓度为0.11 mg/mL,使用液相色谱法进行检测。
1.5 液相检测
色谱条件为:色谱柱采用Inertsil C18柱(4.6×250 mm 5 μm),流动相为乙腈-缓冲液(4.1 g/L的磷酸二氢钾)55:45比例混合均匀后用磷酸调节pH至4.0 ± 0.1,流动相流速1.5 mL/min,色谱柱柱温25 ℃,进样体积为25 μL,检测波长:210 nm,对对照品及样品溶液含量检测。
2 结果与讨论
2.1 溶出方法开发
USP41药典中介绍利托那韦溶出方法为桨法,溶出介质是在900 mL水中加入0.06 M 聚氧乙烯月桂醇醚表面活性剂。因利托那韦片处方中本身含有聚合物和表面活性剂,而溶出介质中又加入表面活性剂,所以体外溶出结果并不能够很好的反应产品的内在品质,且不适合用于评估仿制制剂处方筛选和工艺开发,并且在仿制制剂与原研制剂体外溶出行为比较时不能很好的体现差异性,这并不是一类具有区分力的溶出度试验[18]。基于这点,需开发能指导制剂工艺开发且具有区分力的溶出方法。2010年,Tho等人研究报道了利托那韦挤出物在水中分散时,形成不透明或稍微浑浊的纳米/微米级分散体,并且在一定时间内为相对稳定的分散体系,而分散体随着时间的推移可能会发生缔合/聚集/絮凝,变得不稳定[19]。参考该研究,本文开发以水为溶出介质的溶出方法,并且将USP41中提出的120 min溶出取样时间延长为180 min,考察不透明或稍微浑浊的纳米/微米级分散体的稳定性。用改进的溶出方法能够很好的反应产品的内在品质,有效区分产品的质量差异,且指导仿制制剂的工艺开发。
2.2 改进溶出设备对溶出及重现性分析考察
采用开发的溶出方法对利托那韦原研制剂进行溶出考察时,总会出现因溶出试验重现性不好,RSD值较大情况。通过分析失败的溶出试验可能并不是因原研产品质量造成的,而是测试本身的性质,系统复杂的流体力学变异性原因。引言部分已经强调了影响流体动力学的三个主要因素,其中药物在溶出杯中的分散模式和沉降位置影响在利托那韦原研制剂溶出试验明显存在,且溶出过程观察到溶出杯底部有堆积现象出现。而且溶出杯中本身流场存在不均匀问题,特别是溶出杯底部,此外,难溶性药物利托那韦在水溶液中形成不透明或稍微浑浊的纳米/微米级分散体,更加剧了溶出杯中流场的不均匀情况,基于此原因,批内出现溶出结果差异大,RSD值大,重现性差问题就可解释。利托那韦原研制剂在水介质及在不同溶出设备中的溶出情况如图2所示。由图可知利托那韦原研制剂在不同溶出设备中的溶出趋势基本类似,利托那韦片的溶出随着时间的增加而上升,至60 min基本达到最大值,120-180 min区间均有下降趋势。而且通过对比发现,不论尖峰溶出杯还是加入辅助珠的溶出杯,在60 min时普通溶出杯溶出度为88%,尖峰溶出杯及改良溶出杯溶出度分别为95%和97%,后两者较传统溶出杯溶出高,推测因尖峰和辅助珠的存在占据因未被搅动的崩解颗粒在溶出杯底部形成的“死区”位置,消除桨下的未搅拌区域干扰,消除了传统溶出杯的流体力学问题。利托那韦原研制剂在不同溶出设备中的溶出重现性RSD分析结果如图3柱状对比图所示。在传统溶出杯中,参比制剂溶出曲线的变异系数较大,重现性较差,特别是前期(≤ 60 min)RSD 值大于15%。按照《普通口服固体制剂溶出度试验技术指导原则》对相对标准偏差的要求“第一个取样点的溶出量相对标准偏差不得超过20%,其余取样时间点的溶出量相对标准偏差不得超过10%”,普通杯溶出情况不符合要求;而在尖峰溶出杯和加入辅助珠的溶出杯中,参比制剂的变异系数明显减小,在可接受范围内,RSD值明显减小,反映出不论尖峰溶出杯还是对溶出设备新的改进对改善利托那韦在水溶液中纳米/微米级分散体在溶出杯中的分布问题明显改善,且相对尖峰溶出杯,加入辅助珠的RSD整体趋势较小,溶出重现性较好。
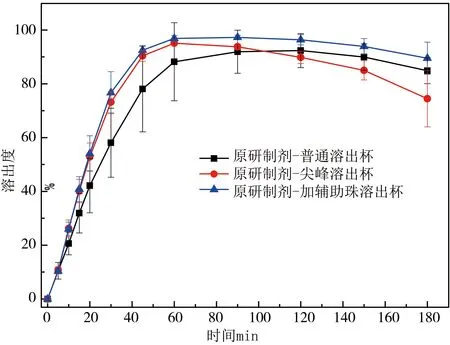
图2 利托那韦原研制剂在水介质及不同溶出设备中的溶出曲线。■●▲代表原研制剂在对应时间点累积溶出平均值。溶出趋势基本一致,溶出随着时间的增加而上升,60 min基本达到最大值,120-180 min区间有下降趋势。图中数据以均值 ± SD表示(n=3)

图3 利托那韦原研制剂在不同溶出设备中的溶出重现性RSD柱状图对比分析。黑色柱状图代表原研制剂在普通溶出杯中重现性情况,RSD值很大,表明重现性差。红色和蓝色分别代表原研制剂在尖峰溶出杯和加辅助珠溶出杯溶出重现性情况,RSD值较小,符合《普通口服固体制剂溶出度试验技术指导原则》相对标准偏差的要求
2.3 改进溶出设备优势分析
在不需要对溶出仪重新进行机械验证的前提下,添加辅助搅拌珠使得溶出杯底部不存在溶出死角问题,并改善了溶出杯中流场不均匀问题。通过改进的溶出装置减小溶出装置的物理参数对溶出试验的变异性影响,可大幅度提升重现性,避免了因测试本身的性质导致溶出试验的失败,从而进一步满足质量控制的要求,以保证研究者获得更好的体内外相关性。基于机械方面优势考量,加入辅助珠方式对溶出设备改进是在原桨法设备的基础上无损改进,既保留了桨法装置简单、耐用及标准化的特点,又解决对溶出试验的变异性影响问题。并且改进的溶出试验装置中所用的辅助珠,其材质耐用、不易被腐蚀、不易浮动、不易与药品产生反应,容易标准化和量产。
3 结论
本文通过对难溶性药物利托那韦溶出试验考察及RSD分析,很直观的表明了改善后溶出装置对其有利作用,也对改进的溶出设备的优势进行剖析汇总。但是在评估和理解流体在改进的溶出设备内的流体动力学还需进行深入研究。另外在不同品种的溶出实验中,辅助珠的使用数量,甚至尺寸都可能对溶出装置的物理参数产生影响,进而对溶出实验的变异性产生多变影响。这一点对固定锥形-尖峰溶出杯来说,加入辅助珠更具灵活可变性,同时也可以适用于篮式等其他溶出方法。对溶出装置的改善,减少了传统溶出装置的可变性。
溶出技术作为一种性能测试将继续为制药工业增加价值,该方法正在通过科学过程进行演变。在不久的将来,溶出方法的差异将会减少,能够对药品的内在品质更加有效评估,能够指导新配方开发和评估批次间的一致性,确保产品质量,并且这一技术的生物相关性也将会提高,从而大幅度提高生物等效性试验成功概率,推动药品生产企业对制剂工艺的充分、详尽研究。
