抗栓药物对内镜黏膜下剥离术术后出血的影响
2021-01-28陈佳园陈怡陈成帷张益光
陈佳园 陈怡 陈成帷 张益光

[摘要] 目的 探讨抗栓药物对内镜黏膜下剥离术(ESD)术后出血的影响。 方法 选取2016年1月至2020年12月期间接受ESD治疗的患者纳入本研究,分析抗栓药物对ESD术后出血的影响。 结果 肝素替代治疗(HR)、多重抗栓药物、切除标本直径超过38 mm、病灶位于胃上1/3均为术后出血的危险因素,连续使用阿司匹林不是术后出血的危险因素。在单抗血栓药物组,持续组与停药组的出血率比较,差异无统计学意义(4.5% vs. 4.4%,P=1.000);在多种抗血栓药物组,持续组出血率高于停药组(66.7% vs. 14.8%,P=0.020)。 结论 ESD术后出血风险与抗栓药物种类、组合、使用方法相关。在抗血栓药物ASA停用或连续使用的情况下,可行胃ESD术。使用多种抗栓药物或HR会增加ESD术后出血的风险。
[关键词] 抗栓药物;内镜黏膜下剥离术;术后出血;危险因素;药物管理
[中图分类号] R735.2 [文獻标识码] B [文章编号] 1673-9701(2021)34-0105-04
[Abstract] Objective To investigate the effect of antithrombotic drugs on postoperative bleeding after endoscopic submucosal dissection (ESD). Methods Patients who received ESD from January 2016 to December 2020 were included in this study. The effect of antithrombotic drugs on bleeding after ESD was analyzed. Results Heparin replacement therapy (HR),multiple antithrombotic drugs, the diameter of excised specimen exceeding 38 mm,and the focus located in the upper third of the stomach were all risk factors for postoperative bleeding. Continuous administration of aspirin was not a risk factor for postoperative bleeding.In the monotherapy antithrombotic drug group, there was no significant difference in bleeding rate between the continuous group and the drug withdrawal group (4.5% vs. 4.4%,P=1.000). In the multi-antithrombotic drug group,the bleeding rate in the continuous group was higher than that in the drug withdrawal group (66.7% vs. 14.8%,P=0.020). Conclusion The risk of bleeding after ESD is related to the type,combination and use of antithrombotic drugs. Gastric ESD is feasible when ASA, an antithrombotic drug, is discontinued or used continuously. The use of multiple antithrombotic drugs or HR will increase the risk of bleeding after ESD.
[Key words] Antithrombotic drugs; Endoscopic submucosal dissection; Postoperative bleeding; Risk factor; Drug management
内镜黏膜下剥离术(ESD)广泛应用于早期胃癌的治疗[1]。荟萃分析显示,术后出血是ESD最常见的并发症,发生率约4.5%,应用抗栓药的患者风险更高[2]。血栓栓塞高危患者停用抗栓药物可能引起严重的血栓事件,因此内镜围术期抗栓药物管理需引起高度关注。日本学者建议针对血栓栓塞高危患者,在持续使用阿司匹林(Acetylsalicylic acid,ASA)单药的情况下进行ESD[3]。美国、英国和欧洲指南也建议血栓栓塞高危患者在继续服用ASA情况下进行ESD[4-5]。少数研究指出单一持续使用抗血小板药物不会增加胃ESD术后出血的风险[6-7]。然而这些研究结果仍存在争议,本研究旨在根据对抗栓药物的管理评估ESD术后出血风险,现报道如下。
1 资料与方法
1.1 一般资料
本研究纳入2016年1月至2020年12月期间在本院接受ESD治疗的患者872例(1020个病灶),男652例,女220例,平均年龄(71.7±13.8)岁。纳入标准:接受ESD治疗的患者,临床及随访数据完整。排除标准:①有上消化道手术史者;②病理诊断为胃腺瘤或恶性肿瘤者;③临床资料不完善者。
记录:①患者因素:年龄、性别、基础疾病、幽门螺旋杆菌感染、抗栓药物管理;②病灶因素:病灶部位及大小、生长方式、病理类型;③操作因素:操作者熟练程度[8]、操作时间、整块切除率、穿孔。
抗栓药物管理遵照日本胃肠內镜学会2014年发布的《胃肠道内镜检查的抗血栓形成治疗》[3],分组如下:①对照组:不使用抗栓药物(814个病灶,690例患者);②停药组:在ESD术前停用所有抗栓药物而不接受HR(140个病灶,128例患者);③持续组:抗栓药物使用者继续使用ASA单药治疗(28个病灶,23例患者),包括接受多重抗血小板治疗的患者,在没有使用HR的情况下改用ASA单药治疗;④HR组:停止所有抗栓药物但接受HR(38个病灶,31例患者)。
1.2 ESD操作
首先确定病灶边界,使用APC、Hook刀或IT刀标记后行黏膜下注射。病灶隆起后预切开,然后开始黏膜下剥离。在黏膜下剥离的过程中,需要反复进行黏膜下注射,且需要保持剥离的层面位于黏膜下层以内。发生出血使用热凝等方法进行止血。最后,处理创面,需要时钛夹缝合。
1.3 方法
术后出血的诊断标准[9],符合以下观察指标中任意两项:①出现呕血、黑便等不适;②术后血红蛋白下降>10 g/L;③术后血压下降>20 mmHg或心率增加>20次/min;④内镜检查见手术创面活动性出血、血凝块或创面溃疡底部见裸露血管。
当发生术后出血,立即启动急诊内镜电凝、钛夹夹闭等措施,若无效则转外科行手术治疗。本研究中ESD术后出血的病例均经内镜止血,无需手术治疗。需要输血的患者13例(1.5%)。所有患者在围术期均未发生血栓栓塞,临床转归良好。
1.4 统计学方法
采用SPSS 26.0统计学方法进行数据分析。计量资料采用(x±s)表示,使用成组t检验;计数资料用χ2检验进行比较。多因素Logistic回归模型包括单因素分析中P<0.05的变量和既往研究中报道的与术后出血有关的一些重要指标[10-12]。采用Logistic回归计算OR值和95%置信区间(95%CI),确定术后出血的相关因素。P<0.05为差异有统计学意义。
2 结果
2.1 术后出血危险因素的单因素分析
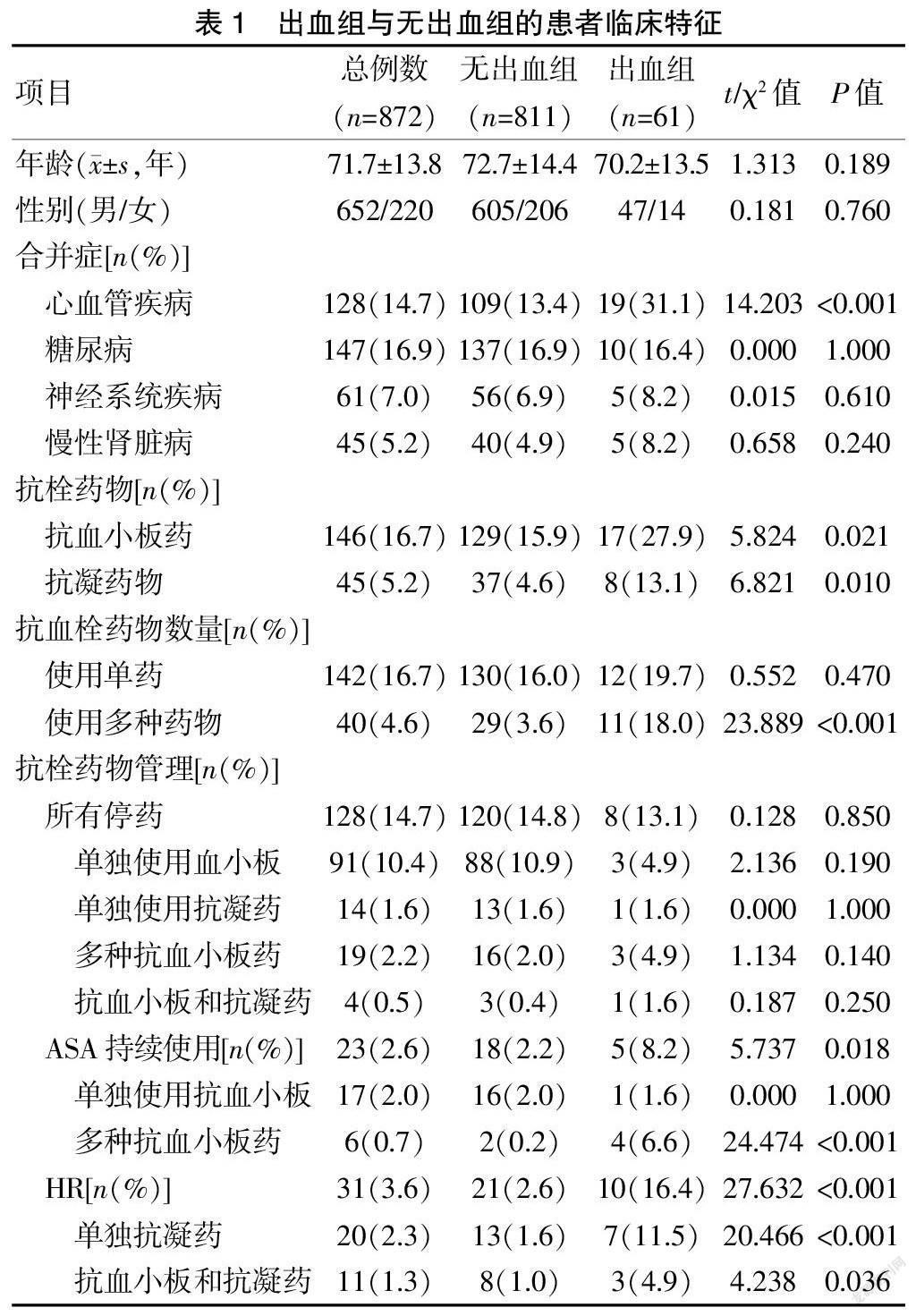
表1显示,ESD术后出血与心血管疾病、抗栓药物使用、持续使用ASA、使用多种抗栓药物、使用HR相关。表2显示,ESD术后出血与病灶位于胃上1/3、病灶直径≥38 mm相关。
2.2 术后出血危险因素的多因素分析
表3显示,应用HR、使用多种抗栓药物、切除标本直径≥38 mm、肿瘤位于胃上1/3与术后出血风险显著相关。ASA的持续使用不是术后出血的危险因素。
2.3 各组间术后出血率的比较
图1显示四组ESD术后出血率的差异。停药组和持续组出血率无明显差异(P=0.360)。HR组出血率明显高于停药组(P=0.002),但与持续组比较,差异无统计学意义(P=1.000)。
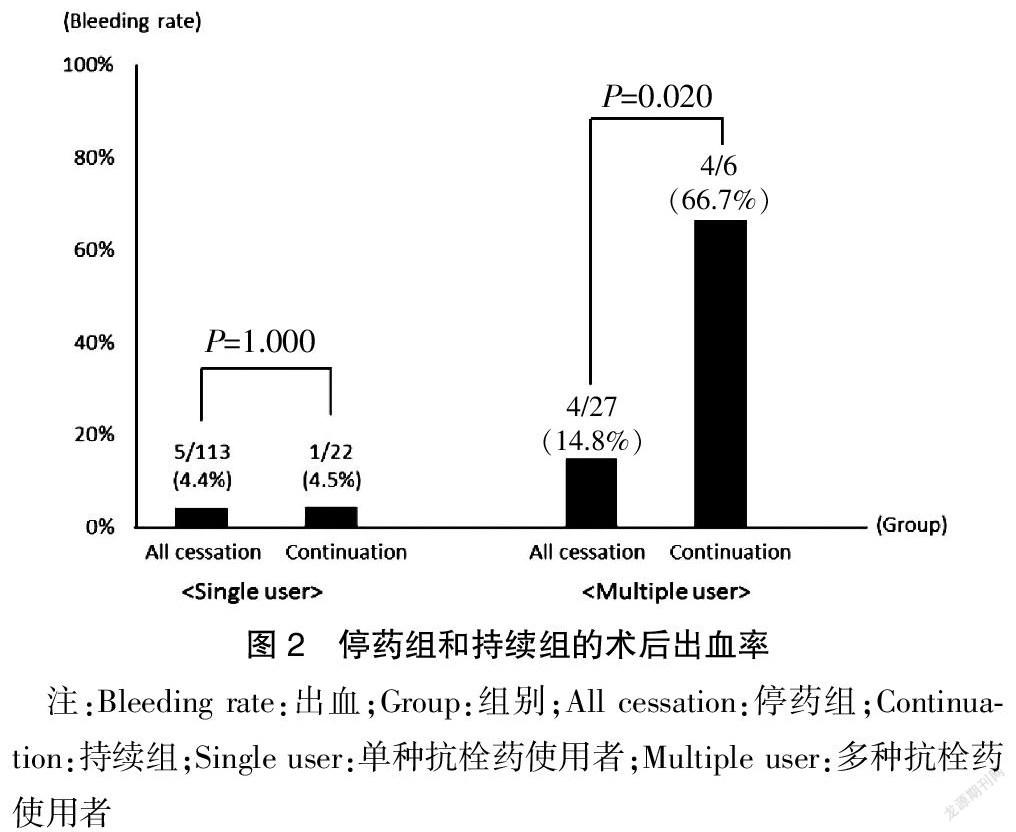
本研究还比较了在使用单种和多种抗栓药物的情况下,停药组和持续组的术后出血率差异(图2)。在单种抗栓药物使用人群中,停药组和持续组的术后出血率无统计学差异(4.4% vs. 4.5%,P=1.000)。而多种抗栓药物使用者中,持续组术后出血率明显高于停药组(66.7% vs. 14.8%,P=0.020)。
3 讨论
本研究主要探讨了抗栓药物对ESD术后出血的影响。肿瘤位于胃上1/3、切除标本直径≥38 mm、使用多种抗血栓药物、HR是ESD术后出血的危险因素。ASA的持续使用不是术后出血的危险因素,停药组和持续组术后出血率无统计学差异。多种抗血小板药物使用者继续使用ASA,与单独使用抗血小板药物相比,术后出血风险更大。
病灶位于胃上1/3易并发术后出血,考虑与胃底手术操作难度较大,黏膜下血管较丰富有关[13]。既往研究表明多发病灶及病灶大小≥20 mm在术中会造成较大创面,因此术后出血的发生率增加[14]。
一项荟萃分析[15]显示,持续ASA治疗下ESD出血风险未显著增加,但中断ASA后血栓栓塞事件明显增加。因此对于高血栓栓塞风险患者,可选择在胃ESD围术期继续使用ASA。
双联抗血小板治疗(DAPT)是急性冠脉综合征的标准治疗[16]。Tounou等[17]的研究显示继续DAPT的患者ESD术后出血的风险较单独使用ASA者增加。Cho等[18]发现与单独使用ASA相比,术后重新使用氯吡格雷者ESD术后出血的发生率更高。本研究发现使用多种抗栓药物者术前转换为单一ASA疗法,与单独使用ASA者相比,术后出血风险增加。但鉴于此种情况例数较少,仍需大样本前瞻性RCT证实胃ESD围术期将多种抗栓药物转换为ASA单药治疗的益处风险比。
一项回顾性研究表明,接受HR的患者ESD后出血发生率为23%~38%,且更易发生迟发性出血[19],可能与桥接过程中两种药物的重叠作用有关,从而在后期引起更强的抗栓作用。Douketis等[20]的RCT研究评估了HR对因慢性房扑或房颤而服用华法林的患者术后血栓栓塞和出血事件的影响,结果显示,围术期是否使用HR对血栓发生率无影响,但大出血风险升高。上述这些研究表明HR治疗增加了ESD后出血的风险,但预防血栓栓塞效果尚不明确,对血栓栓塞高危患者,ESD围术期不停用华法林治疗也是一种可行的选择。
本研究存在如下局限性:①系单中心回顾性研究,可能存在其他的影响因素未纳入研究;②涉及ASA持续使用及使用多种抗栓药物的样本量较小,结果可能存在偏倚。
综上所述,ESD术后出血风险与抗栓药物种类、组合、使用方法相关。在抗栓药物ASA停用或连续使用的情况下,可进行胃ESD术。使用多种抗栓药物或HR会增加ESD术后出血的风险。临床医生应关注相关风险因素,减少ESD术后出血的发生。
[参考文献]
[1] Tan Y,Lu J,Lv L,et al. Current status of endoscopic submucosal tunnel dissection for treatment of superficial gastrointestinal neoplastic lesions[J]. Expert Rev Gastroenterol Hepatol,2020,14(6):453-462.
[2] Zhu H,Li F,Tao K,et al. Bleeding after endoscopic resection between direct oral anticoagulants or warfarin: Systematic review and meta-analysis[J]. J Gastroenterol Hepatol,2021,24.Online ahead of print.
[3] Fujimoto K,Fujishiro M,Kato M,et al. Guidelines for gastroenterological endoscopy in patients undergoing antithrombotic treatment[J]. Dig Endosc,2014,26(1):1-14.
[4] Acosta RD,Abraham NS,Chandrasekhara V,et al. The management of antithrombotic agents for patients undergoing GI endoscopy[J]. Gastrointest Endosc,2016,83(1):3-16.
[5] Veitch AM,Vanbiervliet G,Gershlick AH,et al. Endoscopy in patients on antiplatelet or anticoagulant therapy,including direct oral anticoagulants:British society of gastroenterology(BSG) and European society of gastrointestinal endoscopy(ESGE) guidelines[J]. Gut,2016,65(3):374-389.
[6] Sanomura Y,Oka S,Tanaka S,et al. Continued use of low-dose aspirin does not increase the risk of bleeding during or after endoscopic submucosal dissection for early gastric cancer[J]. Gastric Cancer,2014,17(3):489-496.
[7] Furuhata T,Kaise M,Hoteya S,et al. Postoperative bleeding after gastric endoscopic submucosal dissection in patients receiving antithrombotic therapy[J]. Gastric Cancer,2017,20(1):207-214.
[8] Yoshida M,Kakushima N,Mori K,et al. Learning curve and clinical outcome of gastric endoscopic submucosal dissection performed by trainee operators[J]. Surg Endosc,2017,31(9):3614-3622.
[9] Park SK,Goong HJ,Ko BM,et al.Second-look endoscopy findings after endoscopic submucosal dissection for colorectal epithelial neoplasms[J]. Korean J Intern Med,2021.Online ahead of print.
[10] Choi JJ,Cho SJ,Na SH,et al.Use of direct oral anticoagulants does not significantly increase delayed bleeding after endoscopic submucosal dissection for early gastric neoplasms[J]. Sci Rep,2021,11(1):9399.
[11] Mukai S,Cho S,Kotachi T,et al. Analysis of delayed bleeding after endoscopic submucosal dissection for gastric epithelial neoplasms[J]. Gastroenterol Res Pract,2012, 2012:875 323.
[12] Yoshioka T,Nishida T,Tsujii M,et al. Renal dysfunction is an independent risk factor for bleeding after gastric ESD[J]. Endosc Int Open,2015,3(1):E39-E45.
[13] 王偉,郝璐,施新岗,等.内镜黏膜下剥离术在早期胃癌及癌前病变治疗中的价值[J].第二军医大学学报,2017,38(7):923-927.
[14] 李焱冬,张延强,俞江平,等.早期胃癌内镜黏膜下剥离术后追加手术的原因分析[J].中国微创外科杂志,2020, 20(4):300-303.
[15] Jaruvongvanich V,Sempokuya T,Wijarnpreecha K,et al.Continued versus interrupted aspirin use and bleeding risk after endoscopic submucosal dissection of gastric neoplasms:A meta-analysis[J].Ann Gastroenterol,2018, 31(3):344-349.
