低温胁迫下苦瓜叶片转录组差异基因分析及生理响应特征
2021-01-28杜文丽陈中钐许端祥徐同伟温庆放
杜文丽 陈中钐 许端祥 徐同伟 高 山 温庆放
(1福州市蔬菜科学研究所,福建 福州 350111;2福建省农业科学院作物所,福建 福州 350013)
苦瓜(Momordica charantiaL.)又名凉瓜,起源于东印度,现主要种植于热带、亚热带和温带区域,加勒比海和南美地区也有栽培。近年来,人们逐步认识到苦瓜的营养价值及保健功能。我国南方地区生产的苦瓜除供本地和北运外,还远销东南亚地区,己成为南方部分地区出口创汇的主要蔬菜之一[1-2]。苦瓜属喜温蔬菜,在实际生产中,苦瓜苗期常常遭受早春寒流或秋季气温骤降的侵袭,10℃以下的冷害导致生长缓慢甚至形成僵苗,严重制约苦瓜种植范围的扩大和上市时节的调节,生产上亟需选育耐低温且综合性状好的新品种[3]。
与植物耐低温相关的研究逐渐由细胞学、生理生化转向分子生物学,且植物耐低温分子机制的研究已取得了长足进步,现已有100 余种转基因耐低温植物,共涉及50 多个物种[4-5]。目前,低温胁迫涉及一系列复杂的信号传导网络,诱导植物体内相关基因的表达,但对于植物将低温胁迫信号传递到细胞核内激活转录因子,以及激活下游基因表达使机体出现耐低温特性的机制仍不清楚。前人研究发现CBF1 通过结合CRT/DRE(c-repeat/dehydration responsive element)顺式作用元件,调控耐低温特性基因表达来参与植物中低温胁迫下的信号传导,这种通过转录因子所调控的信号路在学术界已被广泛验证[6-7]。有研究学者先后在拟南芥中获得CBF2、CBF3 和CBF4 基因转入拟南芥中,发现拟南芥植株耐低温胁迫的能力得到显著提升,且导致许多与低温胁迫相关的生理生化指标发生变化,如脯氨酸和可溶性糖含量增加等[8]。周丽霞等[9]发现WRKY7、WRKY1 等基因对油棕的耐低温性发挥调控作用。李佳[10]研究发现马铃薯在4℃处理后 St2RMYB80 基因表达量下调,St4RMYB1 和St3RMYB2 基因表达量上调。
第二代测序技术已广泛应用于转录组测序(RNAseq)领域,通过比对植物生物和非生物胁迫转录组基因reads 数获得植物体大量基因信息,能够在分子水平上了解基因表达量的变化,揭示特定的生物学过程和分子机制[11-13]。Chen 等[13]通过Illumina nextseq 2500 测序平台对低温胁迫下的甘蔗叶片进行研究,发现2 583 个基因上调表达,3 302 个基因下调表达。黄超[11]利用Illumina Hiseq-2000 测序平台对4℃低温处理0.8 和32 h 的甜瓜叶片进行测序,筛选出19个包括编码WRKY、b HLH、NAC、AP2/ERF等转录因子在内可能与耐低温具有潜在相关的候选基因。此外,转录组测序技术已应用于大白菜、花椰菜、黄瓜等蔬菜作物研究中[14-17]。目前,关于苦瓜在低温胁迫方面的研究还限于表型、生理生化指标鉴定和遗传规律等方面[18-19],通过RNA-seq 揭示苦瓜的耐低温机制方面研究鲜有报道,在一定程度上约束了苦瓜育种进程。
本研究以福州市蔬菜科学研究所选育的较耐低温苦瓜自交系43 为研究对象,依托百迈客Illumina HiSeq2500 平台对26℃(对照)和模拟福建早春夜温8℃气候[20]处理12 h 的两个样品叶片进行转录组测序分析,再通过生理指标分析和分子手段对苦瓜响应低温胁迫的分子机制进行探讨,同时进一步挖掘苦瓜耐低温相关的候选基因,以期为苦瓜耐低温基因工程提供一定的理论支撑。
1 材料与方法
1.1 试验材料
供试材料为耐低温苦瓜自交系43,由福州市蔬菜科学研究所苦瓜课题组选育。选取饱满健壮的苦瓜种子采用温汤浸种法催芽,待种子露白后转移至营养钵中(椰糠+草木灰)中,随后放置于26℃培养箱(立德泰勒科学仪器有限公司,型号:LT-ACC)中培养,光强8 000 lx,相对湿度70%)。约2 周后苦瓜苗生长至四叶一心时,将培养箱温度调至8℃,选取生长良好、发育状态一致的苦瓜苗进行低温处理,处理前浇透水。观察每个时期的植株形态,其他培养条件同上[20]。处理0(对照)、4、8、12 h 后剪取幼苗真叶测定相关生理指标。剪取处理后剪取12 h 幼苗真叶用锡箔纸包好,以0 h 为对照,立即放置于液氮中速冻后送北京百迈客生物科技有限公司进行RNA-seq。
1.2 生理指标测定方法
硫代巴比妥酸(thiobarbituric acid,TAB)法用于测定丙二醛(malondialdehyde,MDA)含量。酸性茚三酮法用于测定游离脯氨酸(proline,Pro)含量。电解质渗出率(rate of electrolyte efflux,REC)的测定参考文献[21]。
1.3 RNA-seq 方法
总RNA 按照提取后经消化处理后及时对RNA 样品的纯度、浓度和完整性进行检测,保证使用高质量的RNA 进行转录组测序。依托Illumina HiSeq2500 高通量测序平台进行上机测试工作,PE150 为测序读设置值。利用FASTX 软件对获得的数据进行质量控制,即去除Raw Data 中的接头和低质量序列后得到Clean Data,再使用Trinity 软件进行组装最终获得Unigene序列。利用BLAST 程序(设置E-value= 10-5)使用NR、COG、KOG 及KEGG 等数据库对Unigene 进行注释及和分类。基因表达衡量指标采用FPKM 法[22],使用DESeq[23]对样品间差异表达进行分析,以样品间表达量符合错误发现率数≥2 且≤0.5 作为筛选标准获得差异表达基因。最后对差异表达的基因进行GO 功能注释、COG 功能注释和富集分析。
1.4 实时荧光定量PCR 检测
参照植物RNA 提取试剂盒(RNAprep Pure Plant Kit,天根生化科技有限公司)获得苦瓜叶片的总RNA,然后参照[Prime ScriptTM RT reagent Kit,宝生物工程(大连)有限公司]试剂盒说明反转录合成cDNA。用Primer 5.0 软件设计与低温逆境相关的苦瓜差异表达基因引物,以McCYP(GeneBank 登录号:HQ171897)作为内参基因,候选基因的引物序列见表1,引物由北京六合华大基因科技股份有限公司合成。实时荧光定量PCR(quantitative real-tirne PCR,qRTPCR)采用ABI 7500 Fast Real-Time PCR System(美国)进行PCR 扩增,每次试验设3 次重复。反应体系参照[Super Real Pre Mix Plus (SYBR Green),天根生化科技有限公司)]试剂盒说明书进行,数据采用2-ΔΔCt方法计算[24]。
1.5 数据处理
采用SPSS 16 软件对试验数据进行统计,利用Excel2016.1.0 软件作图。
2 结果与分析
2.1 低温胁迫下苦瓜的表型与生理生化指标变化
苦瓜经低温胁迫4 h 后,苦瓜的真叶就开始出现萎蔫失水的现象,这是植物受到低温胁迫的典型反应;低温胁迫8 h 后,叶柄软化、向下弯曲,未成熟茎出现更严重的萎蔫现象(图1-A)。但在低温胁迫12 h 后,又出现明显的恢复现象,表明苦瓜43 号自交系具有良好的低温耐受能力,适于作为本研究的材料。

图1 低温胁迫前后苦瓜表型变化和生理生化变化Fig.1 Phenotypic and physiological changes in cold-stressed bitter gourd
由图1-B 可知,在经过低温胁迫后MDA 含量先升高后降低,在低温胁迫8 和12 h 后,比0 h 分别增加了96.80%和60.34%,峰值约为对照的2 倍,说明此时苦瓜的细胞膜受到损伤导致MDA 含量增加,但在低温胁迫12 h 后损伤有所恢复。由图1-C 可知,随着低温胁迫时间延长,Pro 含量整体呈现先升高后降低的趋势,在低温胁迫4、8 和12 h 时,Pro 含量相比于对照分别提高了114.47%、125.20%和87.07%,这与MDA 含量的变化情况相一致。由图1-D 可知,REC 随胁迫时间的延长而持续增加并保持在较高水平,在低温胁迫4、8 和12 h 时,比对照分别增加了7.55、9.38 和12.47个百分点。
2.2 测序数据整体评估及差异表达基因的获得
为深入探索苦瓜在转录水平上对低温胁迫的应答,剪取8℃低温条件下处理0 和12 h 的苦瓜叶片,采用Illumiana HiSeq2500 平台进行转录组测序,共获得1.77 Gb Clean Data,Q30 值均大于91.00%(表2),GC含量均在48%的水平。Clean Data 经过滤、拼接和组装后获得的Unigene 数量为89 757 条,N50 长度为1 239 bp,平均长度达到700.75 bp (表3)。Unigene序列数量最多的分布在200 ~300 bp 之间,在500 ~1 000 bp 之间次之(42.64%),Unigene 长度达到1 000 bp 以上的占18.2%以上,共计16 329 条。以上结果表明RNA-seq 结果符合下一步生物信息学分析的要求。
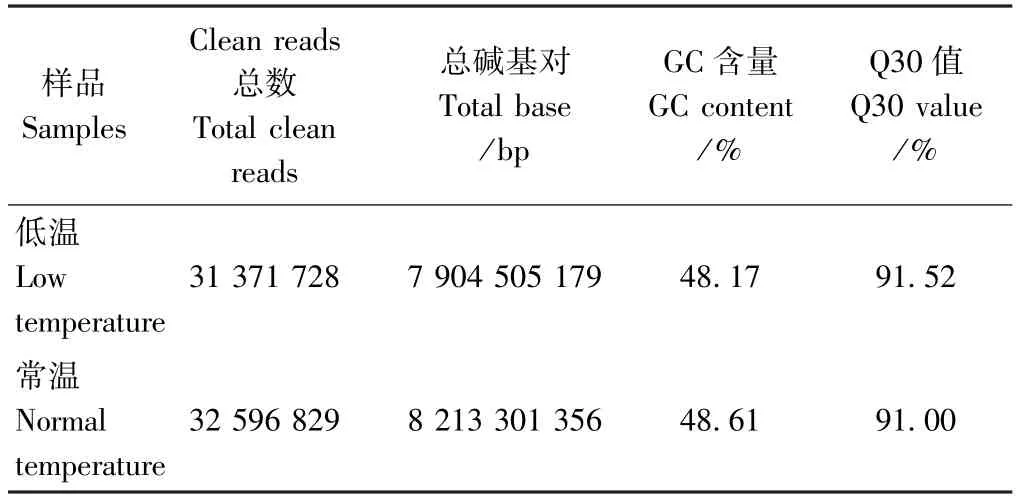
表2 测序数据结果统计Table 2 Statistic of evaluating the sequencing data

表3 测序数据结果统计Table 3 Statistic of evaluating the sequencing data
将得到的Unigene 序列比对结果经NR、KEGG等多个数据平台得到对应的注释信息(表4)。在预设的E 值范围最终有48 662 个注释信息的Unigene,占全部Unigenes 的54.2%。比对得到的Unigene 长度大于1 000 nt 的达到14 964 个,占所有得到注释Unigene 的30.5%。但仍有41 095 个Unigenes 在数据库中没有得到注释。通过对差异表达分析结果进行统计,在低温胁迫处理后共获得1 285 个差异表达基因,其中916 个基因上调、369个基因下调。

表4 测序数据结果统计Table 4 Statistic of evaluating the sequencing data
2.3 差异表达基因GO 分类
对差异表达基因进行GO 聚类分析聚类,结果有1 495 条Unigenes 映射到GO 不同功能节点上,显著富集主要包括在细胞组分、分子功能、生物过程中的50个亚类(图2)。其中最大的主类群是参与生物学过程的差异表达基因,共有749 个;归入细胞组分和分子功能类的分别为347 和399 个;细胞部分、细胞器和膜结构在细胞组分中是排名前三的亚类,分别为123、62 和46 个差异表达基因。在分子功能主类群,大多数的差异表达基因归属于催化活性(177 个)和结合活性(149个)。在生物学过程类群,由191 条Unigene 组成的代谢进程是数量最多的亚类,其次是细胞过程(174 个)和单一生物过程(134 个)。生物过程分组中共富集到14 个GO 条目,差异基因所占比例较大的有代谢过程、细胞过程、单个有机体过程、应激反应、生物调节。在细胞组分分组中共富集到8 个GO 条目,差异表达基因所占比例较高的有细胞部分细胞、膜、细胞器、膜结构。在分子功能分组中共富集11 个GO 条目,催化活性、结合活性占较大比例。这些大量积累的基因表明,苦瓜在遭受低温胁迫过程中进行着复杂的新陈代谢和酶促反应。
2.4 差异表达基因的COG 分类
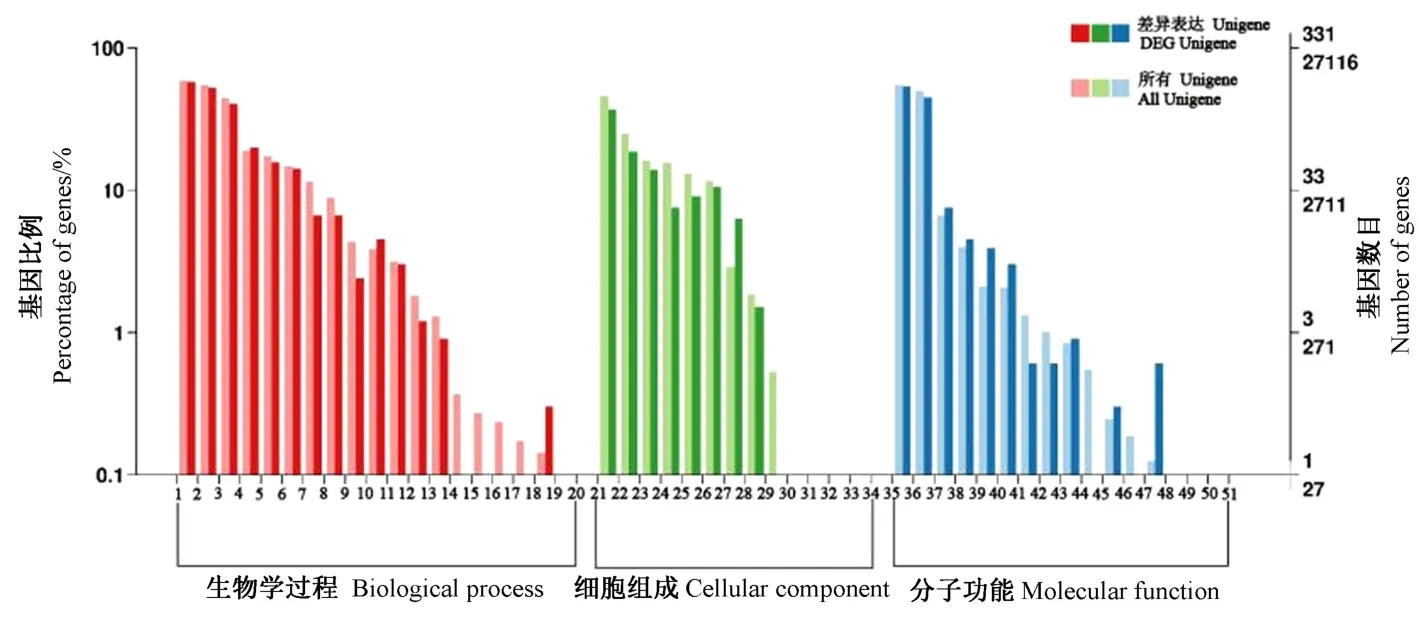
图2 苦瓜转录组GO 功能分类Fig.2 Gene ontology classification of Momordica charantia L.transcriptome
将转录组获得的差异表达基因与COG 数据库进行比对,对其所编码的蛋白质进行直系同源分类,进一步预测基因功能并进行分类统计(表5)。共得到了239 个COG 功能注释的信息,按其功能划分为24 类,其中有3 类功能类型在本研究中无Unigene 比对。其中,仅一般功能预测(16.74%)和转录(10.04%)类所占的比例最大,随后依次是次生代谢物合成,运输和代谢(9.62%)及重复,重组和修饰(8.79%)。
2.5 转录组差异表达基因代谢途径分析
将差异基因比对到KEGG 数据库获得基因注释结果以进一步探索基因功能(表6)。结果显示共有237 个差异基因归入94 种代谢路径。其中参与核糖体代谢途径的差异表达基因有19 个;其次有18 个差异表达Unigene 与苯丙素生物合成相关;与苯丙氨酸代谢路径相关的差异表达基因占第三位;此外,参与植物激素信号传导以及淀粉和糖类代谢途径的差异表达基因均为11 个。与脯氨酸合成相关的精氨酸和脯氨酸代谢通路与低温胁迫相关的氧化磷酸化(oxidative phosphorylation)通路放入差异表达基因分别获得1 个和2 个。代谢途径包含碳水化合物、信号传导、光合等涉及生命活动的各个阶段,表明这些代谢途径在苦瓜遭受低温胁迫时可能发挥着重要作用。
2.6 苦瓜耐低温相关差异表达候选基因
为了挖掘参与耐低温胁迫信号网络相关基因,在差异表达基因中筛选到了包括WRKY、ERF/AP2(乙烯应答)、ZAT转录因子等可能参与苦瓜耐低温胁迫的10 个重要基因(表7)。10 个候选基因的序列和相似性分析见附表1。
2.7 qRT-PCR 分析
为了验证RNA-seq 数据的准确性并进一步分析苦瓜候选基因的耐低温机制,对挑选出的10 个候选基因利用qRT-PCR 观测低温胁迫下动态变化情况,结果如图3 所示。WRKY33 的表达量在胁迫4 h 后急剧上升,8 h 时稍下调随后又有所上升,但都始终高于对照(0 h);MYB108 的表达量随胁迫时间的延长呈逐步上升趋势;ERF017 的表达量随低温胁迫时间的延长呈现先下降后上升的趋势;ERF021 和ERF053 的表达量在受到低温胁迫4 h 时急剧上升,且均在低温胁迫处理8 h 时达到峰值,在低温胁迫处理12 h 时稍有下降但仍高于对照;NAC25 的表达量在受到低温胁迫后下降,低温胁迫处理8 h 表达量上升后又下调;Ga2+ATPase和Ga2+ATPase2 的表达量随着低温胁迫时间的延长均呈现先上升后下降的趋势;ZAT11 和ZAT12的表达量在受到低温胁迫后先上调后下降,且峰值均出现在低温胁迫8 h,低温胁迫12 h 时仍高于对照。所有基因的表达变化与RNA-seq 所得的变化情况一致,说明转录组结果数据可靠。这些基因表达量的上调或下调也预示着它们在苦瓜耐低温胁迫中可能发挥着重要作用。

表5 差异表达基因的COG 注释分类情况Table 5 Classification of COG annotation about DEGs
3 讨论
苦瓜经低温胁迫后出现萎蔫失水的现象,随后又明显恢复,表明该苦瓜材料具有良好的低温耐受能力。MDA 是评价植物细胞膜系统损伤程度的重要指标,本研究中苦瓜受到一定程度的冷害后MDA 含量先升高后降低,说明植物损伤后逐渐得到恢复,这与在低温胁迫下甜瓜不同品种间的耐低温性与MDA 含量成显著负相关的研究结果一致[10]。Pro 是植物细胞内重要的渗透调节物质,通过提高细胞持水能力从而提高植物的耐低温特性[1,25]。本研究中Pro 含量先上升后下降,说明在低温胁迫前期,苦瓜体内能够快速促进Pro含量的提升使植物细胞膜结构免受损伤。MDA 和Pro的变化情况与苦瓜的表型变化一致,说明苦瓜在低温胁迫时可能刺激相关通路基因的表达以保护细胞膜系统不受损害。电解质参透率能反映植物在逆境条件下细胞膜透性程度[1]。本研究中苦瓜叶片的电解质参透率在低温胁迫的过程中始终维持较高水平,表明低温造成的膜损伤并没有在12 h 内得到完全修复。

表6 苦瓜部分差异表达Unigene 的代谢通路Table 6 Some metabolic pathways involving DEG of Momordica charantia L
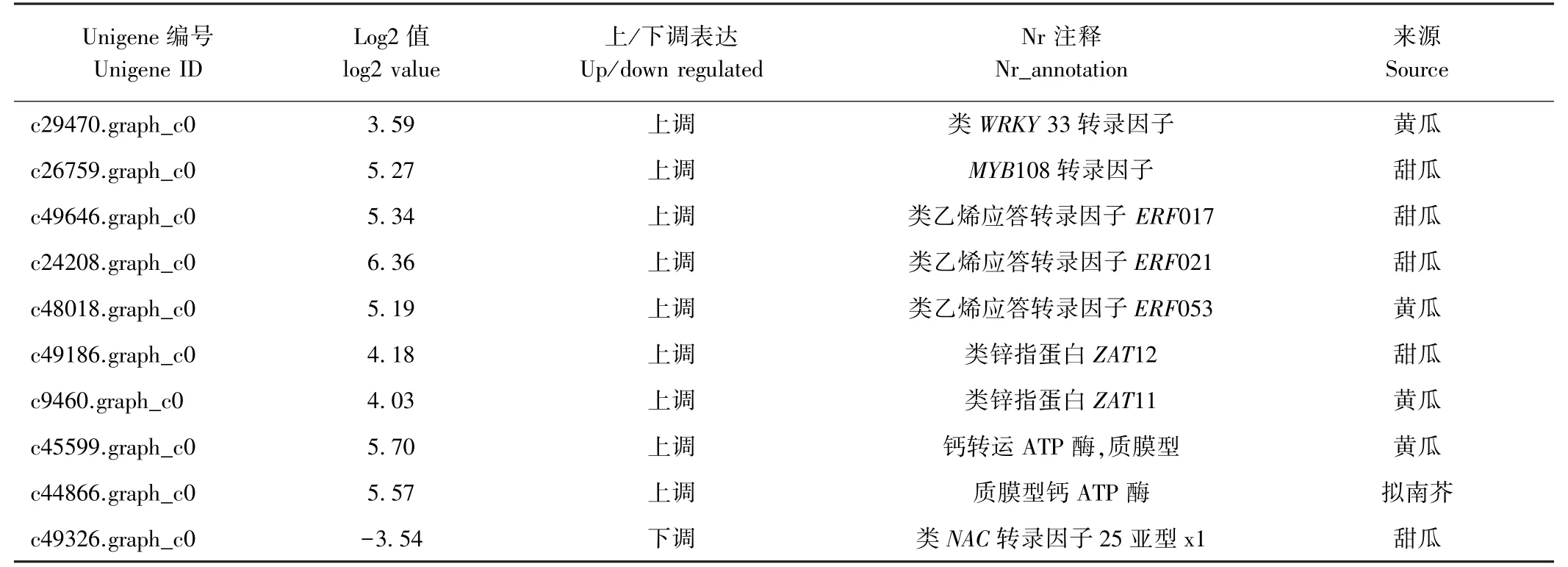
表7 差异表达中耐低温胁迫候选基因Table 7 Low temperature candidate gene of the DGEs

图3 低温胁迫下苦瓜候选基因的相对表达量Fig.3 Relative expression of candidate gene under cold stress in Momordica charantia L.
通过对低温胁迫条件下苦瓜叶片进行RNA-seq分析,共获得1 285 个差异表达基因,受低温诱导表达的基因数目明显多于低温抑制的基因数目。差异表达基因GO 富集到的大量基因存在于代谢、催化活性和应激反应亚类中,表明苦瓜在低温胁迫过程中进行着复杂的新陈代谢和应激反应。差异表达基因归类到物质代谢、植物激素信号传导、光合作用相关蛋白及植物昼夜节律等通路,表明苦瓜可能通过改变信号传导、环境应激及次级代谢物合成来参与低温胁迫的响应,这与黄瓜、番茄、葡萄通过转录组测序技术研究低温响应相关差异表达基因的主要通路结果类似[7,26-27]。研究表明WRKY、MYB、AP2/ERF、ZAT和NAC这几类转录因子在调节植物低温胁迫应答网络中起着关键性的调控作用[28-30]。对筛选出表达量变化较为明显的几类转录因子进行qRT-PCR 验证并对这些基因在苦瓜低温胁迫过程进行动态跟踪,发现WRKY33 基因表达量先上调后下降随后又上升,MYB108 表达量持续上升、ZAT11 和ZAT12 上调表达后下调,与前人研究结果也相一致[31]。ERF021 和ERF053 上调表达,之后出现下降趋势,ERF017 表达量随着胁迫时间的延长先略下调后上调,这与Du 等[32]证实在冷胁迫后期大量ERF上调表达的研究结果一致。NAC25 表达量在低温胁迫后剧烈下降,预示其可能负调控植物低温应答。Ca2+作为第二信使在植物感应外界逆境和信号传递过程中发挥重要的作用,Ca2+ATPase的功能研究证明该家族基因响应各种逆境胁迫[33-34],本研究Ca2+ATPase基因表达受低温诱导明显,说明其可能在苦瓜应对低温逆境时发挥重要作用。qRT-PCR 和转录组测序基因表达的上调和下调一致,具体的定量值有差异可能是机器或者不同批次处理植株中取样引起的误差,表明转录组测序的结果真实可信,基因表达和生理变化能够相互印证。此外,发现脯氨酸合成、氧化磷酸化过程通路中3 个差异基因表达被激活,这与生理生化测试结果一致,可作为苦瓜耐低温基因挖掘的补充资源。
由本研究结果推测在苦瓜耐低温胁迫中Ca2+作为信号分子激活相关转录因子的表达,被激活的转录因子再调控下游功能基因的表达及修饰,减弱了低温胁迫对植物细胞膜产生的破坏,促使植物体内失衡的活性氧和激素水平快速恢复,从而提高了植物的耐低温性。本研究筛选出的候选基因可能参与苦瓜机体耐低温胁迫过程,为下一步开展苦瓜耐低温相关分子机制研究提供了一定的理论支持。
4 结论
本研究以耐低温品种自交系43 号为材料对低温冷胁迫下苦瓜进行形态和相关生理指标测定及分析,并对26、8℃处理下的苦瓜叶片进行RNA-seq 获得了丰富的转录本信息,对差异表达基因的基因功能进行注释,了解苦瓜叶片在低温胁迫下生理变化过程,筛选出包括WRKY、NAC、AP2/ERF等转录因子家族候选基因,可能参与苦瓜机体耐低温胁迫过程调控。10 个差异表达基因的qRT-PCR 动态分析结果与RNA-seq 变化一致,说明转录组数据可靠,基因表达变化和生理指标的变化也一致。本研究利用转录组测序技术对低温胁迫下的苦瓜材料进行测序,通过生物信息学方法对苦瓜耐低温性的多种代谢途径进行分析,并从分子水平阐述了苦瓜低温胁迫下的响应机制,为进一步研究苦瓜耐低温胁迫分子生物学研究功能奠定了一定的理论基础。

附表1: 10 个候选基因相似性比较结果Schedule 1: Similarity comparison results of 10 candidate genes
